Inherited Metabolic Disorders)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Table S1. Disease Classification and Disease-Reaction Association
Table S1. Disease classification and disease-reaction association Disorder class Associated reactions cross Disease Ref[Goh check et al. -

Clinical and Molecular Characterization of Three Patients
Mahjoub et al. BMC Medical Genetics (2019) 20:167 https://doi.org/10.1186/s12881-019-0893-9 CASE REPORT Open Access Clinical and molecular characterization of three patients with Hepatocerebral form of mitochondrial DNA depletion syndrome: a case series Ghazale Mahjoub1, Parham Habibzadeh1,2, Hassan Dastsooz1,3, Malihe Mirzaei1, Arghavan Kavosi1, Laila Jamali1, Haniyeh Javanmardi2, Pegah Katibeh4, Mohammad Ali Faghihi1,5 and Seyed Alireza Dastgheib6* Abstract Background: Mitochondrial DNA depletion syndromes (MDS) are clinically and phenotypically heterogeneous disorders resulting from nuclear gene mutations. The affected individuals represent a notable reduction in mitochondrial DNA (mtDNA) content, which leads to malfunction of the components of the respiratory chain. MDS is classified according to the type of affected tissue; the most common type is hepatocerebral form, which is attributed to mutations in nuclear genes such as DGUOK and MPV17. These two genes encode mitochondrial proteins and play major roles in mtDNA synthesis. Case presentation: In this investigation patients in three families affected by hepatocerebral form of MDS who were initially diagnosed with tyrosinemia underwent full clinical evaluation. Furthermore, the causative mutations were identified using next generation sequencing and were subsequently validated using sanger sequencing. The effect of the mutations on the gene expression was also studied using real-time PCR. A pathogenic heterozygous frameshift deletion mutation in DGUOK gene was identified in parents of two affected patients (c.706–707 + 2 del: p.k236 fs) presenting with jaundice, impaired fetal growth, low-birth weight, and failure to thrive who died at the age of 3 and 6 months in family I. Moreover, a novel splice site mutation in MPV17 gene (c.461 + 1G > C) was identified in a patient with jaundice, muscle weakness, and failure to thrive who died due to hepatic failure at the age of 4 months. -

Cystathioninuria from Pyridoxine Deficiency Complicating Treatment of Hypercalcaemia in a Cretin
Arch Dis Child: first published as 10.1136/adc.41.217.273 on 1 June 1966. Downloaded from Arch. Dis. Childh., 1966, 41, 273. Cystathioninuria from Pyridoxine Deficiency Complicating Treatment of Hypercalcaemia in a Cretin PAUL FOURMAN, JEAN W. SUMMERSCALES, and D. M. MORGAN From the Departments of Chemical Pathology and Paediatrics, Leeds General Infirmary Rats with vitamin B6 deficiency excrete cysta- deficiency may continue to make cystathionine but thionine in the urine (Hope, 1957). Cystathionine they fail to split it. is an amino acid in the pathway of synthesis of Pyridoxal phosphate is a co-enzyme for many cysteine from methionine (Fig. 1). A methyl group other enzymes that are important in metabolism is removed from methionine to produce homocyst- (Holtz and Palm, 1964), including certain trans- eine, which condenses with serine to yield cysta- aminases and decarboxylases. Several of the thionine. This condensation is catalysed by a enzymes concerned in tryptophan metabolism transulphurase enzyme requiring pyridoxal phos- require pyridoxal phosphate. The net effect of phate as a co-enzyme. Finally, cystathionine splits vitamin B6 deficiency on tryptophan metabolism is to yield cysteine and homoserine. This reaction is usually to increase the excretion of xanthurenic acid, catalysed by cystathionase and also requires particularly after the addition ofa dose of tryptophan pyridoxal phosphate (White, Handler, and Smith, to the diet, but the precise reason for the increased 1964). Pyridoxal and its phosphate are forms of xanthurenic acid excretion is not clear (Greenberg, vitamin B6, the others being pyridoxamine and its Bohr, McGrath, and Rinehart, 1949; Holtz and copyright. phosphate, and pyridoxine. -

Cystathionline + H20 -- Cysteine + A-Ketobutyrate + NH3
VOL. 55, 1966 BIOCHEMISTRY: FINKELSTEIN ET AL. 865 17 Georgiev, G. P., 0. P. Samarina, M. I. Lerman, M. N. Smirnov, and A. N. Severtzov, Nature, 200, 1291 (1963). 8Greenman, D. L., W. D. Wicks, and F. T. Kenney, J. Biol. Chem., 240, 4420 (1965). 19 Paigen, K., J. Theor. Bwl., 3, 268 (1962). 20 Zubay, G., and M; H. F. Wilkins, J. Mol. Biol., 4, 444 (1962). 21 Zubay, G., in The Nucleohistones, ed. J. Bonner and P. Ts'o (San Francisco: Holden-Day, 1964), p. 95. 22Frenster, J. H., Nature, 206, 1269 (1965). DEFICIENCIES OF CYSTATHIONASE AND HOMOSERINE DEHYDRA TASE ACTIVITIES IN CYSTA THIONINURIA BY JAMES D. FINKELSTEIN, S. HARVEY MUDD, FILADELFO IRREVERRE, AND LEONARD LASTER VETERANS ADMINISTRATION HOSPITAL, WASHINGTON, D.C., NATIONAL INSTITUTE OF MENTAL HEALTH AND NATIONAL INSTITUTE OF ARTHRITIS AND METABOLIC DISEASES, NATIONAL INSTITUTES OF HEALTH, BETHESDA, MARYLAND Communicated by Seymour S. Kety, February 16, 1966 Congenital cystathioninuria is a familial disease first reported in 1958.1 Too few patients with this condition have been studied to allow definition of the clinical syndrome, but it may include various congenital defects and mental retardation or aberration.'-3 Harris et al.,' and subsequently Brenton et al.,4 demonstrated ab- normally high concentrations of cystathionine in tissue extracts from a cystathio- ninuric patient. Cystathionine was detected also in the serum of a patient reported by Frimpter et al.2 The presence of increased tissue cystathionine content led Harris et al. to advance the hypothesis that this syndrome resulted from a deficiency of the enzyme cystathionase,3 which normally cleaves cystathionine (reaction 1):1 Cystathionline + H20 -- cysteine + a-ketobutyrate + NH3. -

25. C:\Documents and Settings\Kwang-Il\My
The human disease network Goh K-I, Cusick ME, Valle D, Childs B, Vidal M, Barabasi′ A-L (2007) Proc Natl Acad Sci USA 104:8685-8690 Disorder Class Bone Coats Cancer Urolithiasise Osteopetrosis disease NDP Caffey van_Buchem Exudative Cardiovascular disease disease vitreoretinopathy Norrie SLC34A1 disease 439 LRP5 Connective tissue disorder Nevo Hyperostosis, syndrome COL1A1 endosteal Dermatological PLOD1 217 PAX9 Oligodontia Osteogenesis Osteoporosis 1164 Developmental Ehlers-Danlos imperfecta syndrome Arthropathy COL3A1 Hypodontia Ear, Nose, Throat Aneurysm, COL1A2 familial_arterial Myasthenic Witkop 733 syndrome Heart syndrome Pseudoachondroplasia Endocrine 3-methylglutaconicaciduria OPA3 WISP3 Optic Marfan block MSX1 atrophy OPA1 Aortic syndrome Paramyotonia Sick_sinus Gastrointestinal aneurysm congenita syndrome 3558 Intervertebral_disc Brugada SCN4A disease syndrome Syndactyly Spondyloepiphyseal COMP COL9A2 Hematological Glaucoma Weill-Marchesani Shprintzen-Goldberg Cramps, SCN5A Zlotogora-Ogur Cleft dysplasia syndrome syndrome potassium-aggravated Myotonia 2785 syndrome palate Parkes_Weber Basal_cell FBN1 congenita Oculodentodigital COL9A3 1432 Immunological 1414 CYP1B1 syndrome nevus_syndrome MASS Hypokalemic Acquired dysplasia Peters long_QT_syndrome Epiphyseal FLNB RASA1 PTCH Keratitis syndrome periodic MATN3 Metabolic SHH anomaly Eye Ectopia Thyrotoxic paralysis dysplasia Atelosteogenesis anomalies Marshall Larson Capillary Basal_cell Holoprosencephaly Coloboma, periodic KCNH2 PVRL1 malformations GJA1 Incontinentia syndrome SLC26A2 -

Diseases Catalogue
Diseases catalogue AA Disorders of amino acid metabolism OMIM Group of disorders affecting genes that codify proteins involved in the catabolism of amino acids or in the functional maintenance of the different coenzymes. AA Alkaptonuria: homogentisate dioxygenase deficiency 203500 AA Phenylketonuria: phenylalanine hydroxylase (PAH) 261600 AA Defects of tetrahydrobiopterine (BH 4) metabolism: AA 6-Piruvoyl-tetrahydropterin synthase deficiency (PTS) 261640 AA Dihydropteridine reductase deficiency (DHPR) 261630 AA Pterin-carbinolamine dehydratase 126090 AA GTP cyclohydrolase I deficiency (GCH1) (autosomal recessive) 233910 AA GTP cyclohydrolase I deficiency (GCH1) (autosomal dominant): Segawa syndrome 600225 AA Sepiapterin reductase deficiency (SPR) 182125 AA Defects of sulfur amino acid metabolism: AA N(5,10)-methylene-tetrahydrofolate reductase deficiency (MTHFR) 236250 AA Homocystinuria due to cystathionine beta-synthase deficiency (CBS) 236200 AA Methionine adenosyltransferase deficiency 250850 AA Methionine synthase deficiency (MTR, cblG) 250940 AA Methionine synthase reductase deficiency; (MTRR, CblE) 236270 AA Sulfite oxidase deficiency 272300 AA Molybdenum cofactor deficiency: combined deficiency of sulfite oxidase and xanthine oxidase 252150 AA S-adenosylhomocysteine hydrolase deficiency 180960 AA Cystathioninuria 219500 AA Hyperhomocysteinemia 603174 AA Defects of gamma-glutathione cycle: glutathione synthetase deficiency (5-oxo-prolinuria) 266130 AA Defects of histidine metabolism: Histidinemia 235800 AA Defects of lysine and -
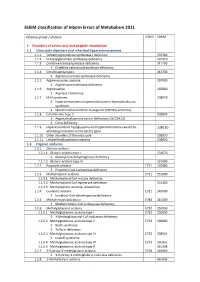
SSIEM Classification of Inborn Errors of Metabolism 2011
SSIEM classification of Inborn Errors of Metabolism 2011 Disease group / disease ICD10 OMIM 1. Disorders of amino acid and peptide metabolism 1.1. Urea cycle disorders and inherited hyperammonaemias 1.1.1. Carbamoylphosphate synthetase I deficiency 237300 1.1.2. N-Acetylglutamate synthetase deficiency 237310 1.1.3. Ornithine transcarbamylase deficiency 311250 S Ornithine carbamoyltransferase deficiency 1.1.4. Citrullinaemia type1 215700 S Argininosuccinate synthetase deficiency 1.1.5. Argininosuccinic aciduria 207900 S Argininosuccinate lyase deficiency 1.1.6. Argininaemia 207800 S Arginase I deficiency 1.1.7. HHH syndrome 238970 S Hyperammonaemia-hyperornithinaemia-homocitrullinuria syndrome S Mitochondrial ornithine transporter (ORNT1) deficiency 1.1.8. Citrullinemia Type 2 603859 S Aspartate glutamate carrier deficiency ( SLC25A13) S Citrin deficiency 1.1.9. Hyperinsulinemic hypoglycemia and hyperammonemia caused by 138130 activating mutations in the GLUD1 gene 1.1.10. Other disorders of the urea cycle 238970 1.1.11. Unspecified hyperammonaemia 238970 1.2. Organic acidurias 1.2.1. Glutaric aciduria 1.2.1.1. Glutaric aciduria type I 231670 S Glutaryl-CoA dehydrogenase deficiency 1.2.1.2. Glutaric aciduria type III 231690 1.2.2. Propionic aciduria E711 232000 S Propionyl-CoA-Carboxylase deficiency 1.2.3. Methylmalonic aciduria E711 251000 1.2.3.1. Methylmalonyl-CoA mutase deficiency 1.2.3.2. Methylmalonyl-CoA epimerase deficiency 251120 1.2.3.3. Methylmalonic aciduria, unspecified 1.2.4. Isovaleric aciduria E711 243500 S Isovaleryl-CoA dehydrogenase deficiency 1.2.5. Methylcrotonylglycinuria E744 210200 S Methylcrotonyl-CoA carboxylase deficiency 1.2.6. Methylglutaconic aciduria E712 250950 1.2.6.1. Methylglutaconic aciduria type I E712 250950 S 3-Methylglutaconyl-CoA hydratase deficiency 1.2.6.2. -

Blueprint Genetics Organic Acidemia/Aciduria &Amp
Organic Acidemia/Aciduria & Cobalamin Deficiency Panel Test code: ME0901 Is a 54 gene panel that includes assessment of non-coding variants. Is ideal for patients with a clinical suspicion of cobalamin deficiency, homocystinuria, maple syrup urine disease, methylmalonic acidemia, organic acidemia/aciduria or propionic acidemia. The genes on this panel are included in the Comprehensive Metabolism Panel. About Organic Acidemia/Aciduria & Cobalamin Deficiency Organic acidemia and aciduria refer to many disorders, where non-amino organic acids are excreted in urine. This is usually a result of deficient enzyme activity in amino acid catabolism. The clinical presentation of organic acidemia in young children includes neurologic symptoms, poor feeding and lethargy progressing to coma. Older persons with this disorder often also have neurological signs, recurrent ketoacidosis and loss of intellectual function. The symptoms result from the damaging accumulation of precursors of the defective pathway. The combined prevalence of organic acidurias is estimated at 1:1,000 newborns. Cobalamin, also known as vitamin B12, has cobalt in its structure. Humans are not able to synthesize B12. It must therefore be obtained from a food of animal origin (the only natural source of cobalamin in the human diet). Intracellular cobalamin deficiencies can be subgrouped based on the cellular complementation groups and defective genes. Mutations in genes MMAA, MMAB and MMADHC cause deficient synthesis of the coenzyme adenosylcobalamin (AdoCbl), while mutations in genes MMADHC, MTRR and MTR cause defective methylcobalamin (MeCbl) synthesis. Mutation in genes MMACHC, MMADHC, LMBRD1 and ABCD4 result in combined AdoCbl and MeCbl deficiency. Mutations in MMACHC explain approximately 80% of the cases with intracellular cobalamin deficiency, followed by MMADHC (<5%), TRR (<5%), LMBRD1 (<5%), MTR (<5%) and ABCD4 (<1%). -

Inherited Enzyme Defects: a Review
J Clin Pathol: first published as 10.1136/jcp.16.4.293 on 1 July 1963. Downloaded from J. clin. Path. (1963), 16, 293 Inherited enzyme defects: a review T. HARGREAVES' From the Department of Chemical Pathology, St. George's Hospital Medical School, Hyde Park Corner, London, S. W.I Sir Archibald Garrod in 1909 pointed out that four The consequences of a genetic change and an diseases, albinism, alkaptonuria. cystinuria, and alteration in the quality or quantity of a protein will pentosuria, were present from birth, lasted through- depend on the role normally subserved by that out life without worsening or improvement, and protein; in the cases that we are considering this is were present in other members of the family (Garrod, derangement of enzymatic function. The derange- 1909). These diseases were described as 'inborn errors ments that can occur include a blocked metabolic of metabolism'. The original four diseases have sequence. In the reaction A---* B-- C--# D, if been expanded to over 50 and the actual site of the C--# D is blocked then a clinical disorder may biochemical abnormality has been elucidated in many result from a failure to produce D, e.g., hypo- of them. In this review we shall consider those glycaemia due to an inability to form glucose from diseases which are either known or thought to be glucose-6-phosphate in von Gierke's disease. The due to single enzyme defects. We have not con- precursor C may accumulate; for example, bilirubin sidered those diseases that are thought to be due to accumulates in the absence of glucuronyl transferase. -

Dennis M. Krikler M.B
Postgrad Med J: first published as 10.1136/pgmj.46.542.687 on 1 December 1970. Downloaded from Postgraduate Medical Journal (December 1970) 46, 687-697. Diseases of Jews DENNIS M. KRIKLER M.B. (Cape Town), F.R.C.P.E., M.R.C.P. Consultant Physician, Prince of Wales's General Hospital, London N. 15 Summary Their vernacular was Ladino, based on Spanish. Jews who were expelled from Iberia of Jews from These were the The relative social and genetic isolation at the end of the fifteenth century; most settled in other communities, which was much more marked in the Balkans and North Africa, but some went to the past than now, has led to the belief that they are Holland and subsequently Great Britain. Sepharad unusually prone to a variety of illnesses. Until the for in the Middle of was the Hebrew name Spain last few decades assessments of the incidence Ages; Germany was similarly known as Ashkenaz various diseases among them were usually based on (Fishberg, 191 1). impressions rather than planned surveys or careful Oriental Jews, living in the Middle East and even analyses, and many misconceptions still persist. It is further afield, are probably the descendants of those proposed to consider the present state of knowledge deported to Babylon in 586 B.C., who did not as well as to indicate the historical and social basis for return to Judea when permitted to do so 54 years any tendencies for Jews to suffer from, or perhaps to reinforcements during subse- made to later, with periodic resist, some diseases. -

21 Disorders of Sulfur Amino Acid Metabolism
21 Disorders of Sulfur Amino Acid Metabolism Generoso Andria, Brian Fowler, Gianfranco Sebastio 21.1 Homocystinuria due to Cystathione β-Synthase Deficiency – 275 21.1.1 Clinical Presentation – 275 21.1.2 Metabolic Derangement – 276 21.1.3 Genetics – 276 21.1.4 Diagnostic Tests – 277 21.1.5 Treatment and Prognosis – 277 21.2 Methionine S-Adenosyltransferase Deficiency – 278 21.2.1 Clinical Presentation – 278 21.2.2 Metabolic Derangement – 278 21.2.3 Genetics – 279 21.2.4 Diagnostic Tests – 279 21.2.5 Treatment and Prognosis – 279 21.3 Glycine N-Methyltransferase Deficiency – 279 21.3.1 Clinical Presentation – 279 21.3.2 Metabolic Derangement – 279 21.3.3 Genetics – 279 21.3.4 Diagnostic Tests – 279 21.3.5 Treatment and Prognosis – 279 21.4 S-Adenosylhomocysteine Hydrolase Deficiency – 279 21.4.1 Clinical Presentation – 279 21.4.2 Metabolic Derangement – 279 21.4.3 Genetics – 280 21.4.4 Diagnostic Tests – 280 21.4.5 Treatment and Prognosis – 280 21.5 γ-Cystathionase Deficiency – 280 21.5.1 Clinical Presentation – 280 21.5.2 Metabolic Derangement – 280 21.5.3 Genetics – 280 21.5.4 Diagnostic Tests – 280 21.5.5 Treatment and Prognosis – 280 21.6 Isolated Sulfite Oxidase Deficiency – 280 21.6.1 Clinical Presentation – 280 21.6.2 Metabolic Derangement – 280 21.6.3 Genetics – 281 21.6.4 Diagnostic Tests – 281 21.6.5 Treatment and Prognosis – 281 References – 281 274 Chapter 21 · Disorders of Sulfur Amino Acid Metabolism Metabolism of the Sulfur-Containing Amino Acids Methionine, homocysteine and cysteine are linked by 5-methyl-tetrahydrofolate (THF), catalyzed by cobal- the methylation cycle (. -

Metabolic Screening List of 140+ Metabolic Abnormalities by GC/MS Analysis
Metabolic Screening List of 140+ Metabolic Abnormalities by GC/MS Analysis DISORDERS OF AROMATIC AMINO ACID METABOLISM 1 Hyperphenylalaninemia 2 Phenylketonuria 3 BH4 deficiency 4 Tyrosinemia I II III 5 Transient neonatal, oculocutaneous & hepatorenal forms 6 Tyrosinemia Hepatorenal form only 7 Hawkinsinuria 8 Alcaptonuria DISORDERS OF BRANCHED CHAIN AMINO ACID METABOLISM 9 Maple syrup urine disease 10 Dihydrolipoyl dehydrogenase (E3) deficiency 11 Isovaleric academia 12 3-methylcrotonyl-CoA carboxylase deficiency 13 Holocarboxylase synthetase deficiency 14 Biotinidase deficiency 15 3-Methylglutaconic aciduria 16 3-Hydroxy-3-methylglutaric aciduria 17 3-oxothiolase deficiency 18 3-Oxoacid CoA transterase deficiency 19 Propionic academia 20 Methylmaonic academia 21 Malonyl-CoA decarboxylase deficiency 22 Hyperleucinemia 23 Hypervalinemia 24 3-hydroxyisobutyryl CoA deacylase deficiency 25 Ethylhydracrylic aciduria 26 2-Oxoadpic aciduria DISORDERS OF DIBASIC AMINO ACID METABOLISM 27 Glutaric aciduria TypeI 28 Hyperornithinemia-hyperammonemia- homocitrullinuria (HHH) syndrome 29 Lysinuric protein intolerance 30 N-acetylglutamate synthetase deficiency DISORDERS OF THE UREA CYCLE 31 Vitamin B 12 deficiency 32 Carbamyl phosphate synthase deficiency 33 Arigininosuccinase deficiency 34 Argininosuccinate synthase deficiency 35 Ornithine carbamoyltransferase deficiency 36 Argininemia DISORDERS OF PYRIMIDINE METABOLISM 37 Orotic aciduria Metabolic Screening List of 140+ Metabolic Abnormalities by GC/MS Analysis 38 Dihydropyrimidine dehydrogenase