Universidade Federal De Goiás Instituto De Ciências
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

"National List of Vascular Plant Species That Occur in Wetlands: 1996 National Summary."
Intro 1996 National List of Vascular Plant Species That Occur in Wetlands The Fish and Wildlife Service has prepared a National List of Vascular Plant Species That Occur in Wetlands: 1996 National Summary (1996 National List). The 1996 National List is a draft revision of the National List of Plant Species That Occur in Wetlands: 1988 National Summary (Reed 1988) (1988 National List). The 1996 National List is provided to encourage additional public review and comments on the draft regional wetland indicator assignments. The 1996 National List reflects a significant amount of new information that has become available since 1988 on the wetland affinity of vascular plants. This new information has resulted from the extensive use of the 1988 National List in the field by individuals involved in wetland and other resource inventories, wetland identification and delineation, and wetland research. Interim Regional Interagency Review Panel (Regional Panel) changes in indicator status as well as additions and deletions to the 1988 National List were documented in Regional supplements. The National List was originally developed as an appendix to the Classification of Wetlands and Deepwater Habitats of the United States (Cowardin et al.1979) to aid in the consistent application of this classification system for wetlands in the field.. The 1996 National List also was developed to aid in determining the presence of hydrophytic vegetation in the Clean Water Act Section 404 wetland regulatory program and in the implementation of the swampbuster provisions of the Food Security Act. While not required by law or regulation, the Fish and Wildlife Service is making the 1996 National List available for review and comment. -

ARTIGO Florística De Trepadeiras No Parque Estadual Das Fontes Do Ipiranga, São Paulo, SP, Brasil Berta Lúcia Pereira Villagra1,2* E Sergio Romaniuc Neto1
e B d io o c t i ê u t n i c t i s Revista Brasileira de Biociências a n s I Brazilian Journal of Biosciences U FRGS ISSN 1980-4849 (on-line) / 1679-2343 (print) ARTIGO Florística de trepadeiras no Parque Estadual das Fontes do Ipiranga, São Paulo, SP, Brasil Berta Lúcia Pereira Villagra1,2* e Sergio Romaniuc Neto1 Recebido: 03 de agosto de 2009 Aceito: 22 de abril de 2010 Disponível on-line em http://www.ufrgs.br/seerbio/ojs/index.php/rbb/article/view/1329 RESUMO: (Florística de trepadeiras no Parque Estadual das Fontes do Ipiranga, São Paulo, SP, Brasil). O Parque Estadual das Fontes do Ipiranga (PEFI) é um dos poucos remanescentes de vegetação na região metropolitana de São Paulo. A vegetação é caracterizada como floresta ombrófila densa com elementos de floresta estacional semidecidual, nas florestas tropicais as trepa- deiras são um importante componente na sua fisionomia e florística, freqüentemente apresentando alta diversidade. O objetivo deste trabalho foi inventariar o componente de trepadeiras em fragmento florestal e contribuir para o conhecimento deste grupo de plantas. Para o estudo da riqueza das trepadeiras do PEFI foram examinadas exsicatas depositadas em herbários, assim como realizadas coletas quinzenalmente por um período de 18 meses. Ocorreram no PEFI 187 espécies de trepadeiras, distribuídas em 109 gêneros, pertencentes a 32 famílias. As famílias com maior riqueza específica foram Fabaceae (21), Bignoniaceae (20) e Asteraceae (20). Os gêneros mais importantes em número de espécies foram Mikania e Passiflora, com 12 espécies cada. Novas ocorrências de trepadeiras para o PEFI foram detectadas num total de 5 espécies. -

Lições Das Interações Planta – Beija-Flor
UNIVERSIDADE ESTADUAL DE CAMPINAS INSTITUTO DE BIOLOGIA JÉFERSON BUGONI REDES PLANTA-POLINIZADOR NOS TRÓPICOS: LIÇÕES DAS INTERAÇÕES PLANTA – BEIJA-FLOR PLANT-POLLINATOR NETWORKS IN THE TROPICS: LESSONS FROM HUMMINGBIRD-PLANT INTERACTIONS CAMPINAS 2017 JÉFERSON BUGONI REDES PLANTA-POLINIZADOR NOS TRÓPICOS: LIÇÕES DAS INTERAÇÕES PLANTA – BEIJA-FLOR PLANT-POLLINATOR NETWORKS IN THE TROPICS: LESSONS FROM HUMMINGBIRD-PLANT INTERACTIONS Tese apresentada ao Instituto de Biologia da Universidade Estadual de Campinas como parte dos requisitos exigidos para a obtenção do Título de Doutor em Ecologia. Thesis presented to the Institute of Biology of the University of Campinas in partial fulfillment of the requirements for the degree of Doctor in Ecology. ESTE ARQUIVO DIGITAL CORRESPONDE À VERSÃO FINAL DA TESE DEFENDIDA PELO ALUNO JÉFERSON BUGONI E ORIENTADA PELA DRA. MARLIES SAZIMA. Orientadora: MARLIES SAZIMA Co-Orientador: BO DALSGAARD CAMPINAS 2017 Campinas, 17 de fevereiro de 2017. COMISSÃO EXAMINADORA Profa. Dra. Marlies Sazima Prof. Dr. Felipe Wanderley Amorim Prof. Dr. Thomas Michael Lewinsohn Profa. Dra. Marina Wolowski Torres Prof. Dr. Vinícius Lourenço Garcia de Brito Os membros da Comissão Examinadora acima assinaram a Ata de Defesa, que se encontra no processo de vida acadêmica do aluno. DEDICATÓRIA À minha família por me ensinar o amor à natureza e a natureza do amor. Ao povo brasileiro por financiar meus estudos desde sempre, fomentando assim meus sonhos. EPÍGRAFE “Understanding patterns in terms of the processes that produce them is the essence of science […]” Levin, S.A. (1992). The problem of pattern and scale in ecology. Ecology 73:1943–1967. AGRADECIMENTOS Manifestar a gratidão às tantas pessoas que fizeram parte direta ou indiretamente do processo que culmina nesta tese não é tarefa trivial. -

Florística E Diversidade Em Afloramentos Calcários Na Mata Atlântica
UNIVERSIDADE ESTADUAL PAULISTA “JÚLIO DE MESQUITA FILHO” unesp INSTITUTO DE BIOCIÊNCIAS – RIO CLARO PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOLOGIA VEGETAL) FLORÍSTICA E DIVERSIDADE EM AFLORAMENTOS CALCÁRIOS NA MATA ATLÂNTICA THARSO RODRIGUES PEIXOTO Dissertação apresentada ao Instituto de Biociências do Câmpus de Rio Claro, Universidade Estadual Paulista, como parte dos requisitos para obtenção do título de Mestre em Ciências Biológicas (Biologia Vegetal). Rio Claro, SP 2018 PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS BIOLÓGICAS (BIOLOGIA VEGETAL) FLORÍSTICA E DIVERSIDADE EM AFLORAMENTOS CALCÁRIOS NA MATA ATLÂNTICA THARSO RODRIGUES PEIXOTO ORIENTADOR: JULIO ANTONIO LOMBARDI Dissertação apresentada ao Instituto de Biociências do Câmpus de Rio Claro, Universidade Estadual Paulista, como parte dos requisitos para obtenção do título de Mestre em Ciências Biológicas (Biologia Vegetal). Rio Claro, SP 2018 581.5 Peixoto, Tharso Rodrigues P379f Florística e diversidade em afloramentos calcários na Mata Atlântica / Tharso Rodrigues Peixoto. - Rio Claro, 2018 131 f. : il., figs., gráfs., tabs., fots., mapas Dissertação (mestrado) - Universidade Estadual Paulista, Instituto de Biociências de Rio Claro Orientador: Julio Antonio Lombardi 1. Ecologia vegetal. 2. Plantas vasculares. 3. Carste. 4. Floresta ombrófila. 5. Filtro ambiental. I. Título. Ficha Catalográfica elaborada pela STATI - Biblioteca da UNESP Campus de Rio Claro/SP - Ana Paula S. C. de Medeiros / CRB 8/7336 Dedico esta dissertação aos meus pais e às minhas irmãs. AGRADECIMENTOS Agradeço acima de tudo aos meus pais, Aparecida e Sebastião, por estarem sempre ao meu lado. Pelo exemplo de vida, apoio constante, por terem me proporcionado uma ótima educação e força nas horas mais difíceis. Sem vocês dificilmente teria atingido meus objetivos. -

Cocoa Beach Maritime Hammock Preserve Management Plan
MANAGEMENT PLAN Cocoa Beach’s Maritime Hammock Preserve City of Cocoa Beach, Florida Florida Communities Trust Project No. 03 – 035 –FF3 Adopted March 18, 2004 TABLE OF CONTENTS SECTION PAGE I. Introduction ……………………………………………………………. 1 II. Purpose …………………………………………………………….……. 2 a. Future Uses ………….………………………………….…….…… 2 b. Management Objectives ………………………………………….... 2 c. Major Comprehensive Plan Directives ………………………..….... 2 III. Site Development and Improvement ………………………………… 3 a. Existing Physical Improvements ……….…………………………. 3 b. Proposed Physical Improvements…………………………………… 3 c. Wetland Buffer ………...………….………………………………… 4 d. Acknowledgment Sign …………………………………..………… 4 e. Parking ………………………….………………………………… 5 f. Stormwater Facilities …………….………………………………… 5 g. Hazard Mitigation ………………………………………………… 5 h. Permits ………………………….………………………………… 5 i. Easements, Concessions, and Leases …………………………..… 5 IV. Natural Resources ……………………………………………..……… 6 a. Natural Communities ………………………..……………………. 6 b. Listed Animal Species ………………………….…………….……. 7 c. Listed Plant Species …………………………..…………………... 8 d. Inventory of the Natural Communities ………………..………….... 10 e. Water Quality …………..………………………….…..…………... 10 f. Unique Geological Features ………………………………………. 10 g. Trail Network ………………………………….…..………..……... 10 h. Greenways ………………………………….…..……………..……. 11 i Adopted March 18, 2004 V. Resources Enhancement …………………………..…………………… 11 a. Upland Restoration ………………………..………………………. 11 b. Wetland Restoration ………………………….…………….………. 13 c. Invasive Exotic Plants …………………………..…………………... 13 d. Feral -

Demographic History and the Low Genetic Diversity in Dipteryx Alata (Fabaceae) from Brazilian Neotropical Savannas
Heredity (2013) 111, 97–105 & 2013 Macmillan Publishers Limited All rights reserved 0018-067X/13 www.nature.com/hdy ORIGINAL ARTICLE Demographic history and the low genetic diversity in Dipteryx alata (Fabaceae) from Brazilian Neotropical savannas RG Collevatti1, MPC Telles1, JC Nabout2, LJ Chaves3 and TN Soares1 Genetic effects of habitat fragmentation may be undetectable because they are generally a recent event in evolutionary time or because of confounding effects such as historical bottlenecks and historical changes in species’ distribution. To assess the effects of demographic history on the genetic diversity and population structure in the Neotropical tree Dipteryx alata (Fabaceae), we used coalescence analyses coupled with ecological niche modeling to hindcast its distribution over the last 21 000 years. Twenty-five populations (644 individuals) were sampled and all individuals were genotyped using eight microsatellite loci. All populations presented low allelic richness and genetic diversity. The estimated effective population size was small in all populations and gene flow was negligible among most. We also found a significant signal of demographic reduction in most cases. Genetic differentiation among populations was significantly correlated with geographical distance. Allelic richness showed a spatial cline pattern in relation to the species’ paleodistribution 21 kyr BP (thousand years before present), as expected under a range expansion model. Our results show strong evidences that genetic diversity in D. alata is the outcome of the historical changes in species distribution during the late Pleistocene. Because of this historically low effective population size and the low genetic diversity, recent fragmentation of the Cerrado biome may increase population differentiation, causing population decline and compromising long-term persistence. -
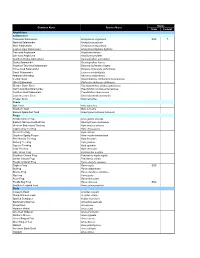
St. Joseph Bay Native Species List
Status Common Name Species Name State Federal Amphibians Salamanders Flatwoods Salamander Ambystoma cingulatum SSC T Marbled Salamander Ambystoma opacum Mole Salamander Ambystoma talpoideum Eastern Tiger Salamander Ambystoma tigrinum tigrinum Two-toed Amphiuma Amphiuma means One-toed Amphiuma Amphiuma pholeter Southern Dusky Salamander Desmognathus auriculatus Dusky Salamander Desmognathus fuscus Southern Two-lined Salamander Eurycea bislineata cirrigera Three-lined Salamander Eurycea longicauda guttolineata Dwarf Salamander Eurycea quadridigitata Alabama Waterdog Necturus alabamensis Central Newt Notophthalmus viridescens louisianensis Slimy Salamander Plethodon glutinosus glutinosus Slender Dwarf Siren Pseudobranchus striatus spheniscus Gulf Coast Mud Salamander Pseudotriton montanus flavissimus Southern Red Salamander Pseudotriton ruber vioscai Eastern Lesser Siren Siren intermedia intermedia Greater Siren Siren lacertina Toads Oak Toad Bufo quercicus Southern Toad Bufo terrestris Eastern Spadefoot Toad Scaphiopus holbrooki holbrooki Frogs Florida Cricket Frog Acris gryllus dorsalis Eastern Narrow-mouthed Frog Gastrophryne carolinensis Western Bird-voiced Treefrog Hyla avivoca avivoca Cope's Gray Treefrog Hyla chrysoscelis Green Treefrog Hyla cinerea Southern Spring Peeper Hyla crucifer bartramiana Pine Woods Treefrog Hyla femoralis Barking Treefrog Hyla gratiosa Squirrel Treefrog Hyla squirella Gray Treefrog Hyla versicolor Little Grass Frog Limnaoedus ocularis Southern Chorus Frog Pseudacris nigrita nigrita Ornate Chorus Frog Pseudacris -

Redalyc.Seed Inflow to a Forest Patch Promoted by Understory Frugivorous
Biota Neotropica ISSN: 1676-0611 [email protected] Instituto Virtual da Biodiversidade Brasil Souza da Mota Gomes, Verônica; Tamashiro, Jorge Yoshio; Rodrigues Silva, Wesley Seed inflow to a forest patch promoted by understory frugivorous birds Biota Neotropica, vol. 11, núm. 4, 2011, pp. 95-102 Instituto Virtual da Biodiversidade Campinas, Brasil Available in: http://www.redalyc.org/articulo.oa?id=199122242010 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Biota Neotrop., vol. 11, no. 4 Seed inflow to a forest patch promoted by understory frugivorous birds Verônica Souza da Mota Gomes1,2,4, Jorge Yoshio Tamashiro3 & Wesley Rodrigues Silva1,2 1Laboratório de Interações Vertebrados-Plantas, Departamento de Biologia Animal, Instituto de Biologia – IB, Universidade Estadual de Campinas – UNICAMP, CP 6109, CEP 13083-970, Campinas, SP, Brasil 2Programa de Pós-graduação em Ecologia, Instituto de Biologia – IB, Universidade Estadual de Campinas – UNICAMP, CP 6109, CEP 13083-970,Campinas, SP, Brasil 3Departamento de Biologia Vegetal, Instituto de Biologia – IB, Universidade Estadual de Campinas – UNICAMP, CP 6109, CEP 13083-970, Campinas, SP, Brasil 4Corresponding author: Verônica Souza da Mota Gomes, e-mail: [email protected] GOMES, V.S.M., TAMASHIRO, J.Y. & SILVA, W.R. Seed inflow to a forest patch promoted by understory frugivorous birds. Biota Neotrop. 11(4): http://www.biotaneotropica.org.br/v11n4/en/ abstract?article+bn02211042011 Abstract: We studied the contribution of understory frugivorous birds to the seed inflow into a late successional Atlantic forest patch in southeastern Brazil. -

Hydrologic Restoration Plan for the Tate's Hell State Forest
Tate’s Hell State Forest Hydrologic Restoration Plan Volume I Northwest Florida Water Management District 81 Water Management Drive, Havana, Florida 32333-4712 Florida Division of Forestry 290 Airport Road, Carrabelle, FL 32322 i GOVERNING BOARD George Roberts, Chair Panama City Philip McMillan, Vice Chair Blountstown Steve Ghazvini, Secretary/Treasurer Tallahassee Stephanie Bloyd Joyce Estes Jerry Pate Panama City Beach Eastpoint Pensacola Peter Antonacci Ralph Rish Tim Norris Tallahassee Port St. Joe Santa Rosa Beach Douglas E. Barr Executive Director For additional information, write or call: Northwest Florida Water Management District 81 Water Management Drive Havana, Florida 32333-4712 (850) 539-5999 DISTRICT OFFICES Headquarters 81 Water Management Drive Havana, FL 32333-4712 Telephone (850) 539-5999 Fax (850) 539-2777 Crestview 800 Hospital Drive Crestview, Florida 32539-7385 Telephone (850) 683-5044 Fax (850) 683-5050 Tallahassee The Delaney Center Building, Suite 2-D 2252 Killearn Center Boulevard Tallahassee, FL 32309-3573 Telephone (850) 921-2986 Fax (850) 921-3083 Pensacola (Field Office) 2261 West Nine Mile Road Pensacola, FL 32534-9416 Telephone (850) 484-5125 Fax (850) 484-5133 Marianna 4765 Pelt Street Marianna, FL 32446-6846 Telephone (850) 482-9522 Fax (850) 482-1376 Econfina (Field Office) 6418 E. Highway 20 Youngstown, FL 32466-3808 Telephone (850) 722-9919 Fax (850) 722-8982 Acknowledgements: This Hydrologic Restoration Plan is the result of the work and contributions of many individuals. At the Northwest Florida Water Management District, Ron Bartel, Director of the Resource Management Division, supervised this effort and provided oversight during the plan development process. We gratefully acknowledge Linda Chaisson, who participated in many of the field reviews along with Nick Wooten, Duncan Cairns, David Clayton, and John Crowe, who provided valuable guidance and suggestions regarding the plan‟s content. -

Fine-Scale Genetic Structure in Tibouchina Papyrus (Pohl) Toledo (Melastomataceae), an Endemic and Habitat-Restricted Species from Central Brazil
Plant Syst Evol (2015) 301:1207–1213 DOI 10.1007/s00606-014-1144-3 ORIGINAL ARTICLE Fine-scale genetic structure in Tibouchina papyrus (Pohl) Toledo (Melastomataceae), an endemic and habitat-restricted species from Central Brazil Jacqueline de Souza Lima • Rosane Garcia Collevatti • Thannya Nascimento Soares • La´zaro Jose´ Chaves • Mariana Pires de Campos Telles Received: 27 December 2012 / Accepted: 25 July 2014 / Published online: 9 September 2014 Ó Springer-Verlag Wien 2014 Abstract Spatial genetic structure (SGS) is the non-ran- aggregation) of individuals in the three localities. Low SGS dom distribution of genotypes in space, which is usually occurs in populations with aggregation patterns, corrobo- correlated with life history traits and is driven by ecological rating the overall hypothesis, although in this species, this and demographic processes. This study aimed to use spatial pattern depends on the landscape characteristics of each statistical analysis methods to assess genetic diversity and local population. spatial genetic structure in three known disjunct localities where Tibouchina papyrus occurs, varying in aggregation Keywords Cerrado biome Á Gene flow Á Microsatellite Á and density of individuals and in landscape characteristics. Pau-papel Á SGS This small tree species is endemic to the ‘‘Cerrado’’ (sav- annas) region of Central Brazil and is also restricted to elevation rock fields (‘‘campo rupestre’’). Therefore, it can Introduction be considered a model species to help guide studies on Cerrado endemic plants that are isolated with geographic Spatial genetic structure (SGS) is the non-random distri- distributions restricted to this highland habitat. The analyses bution of genotypes within a population (Vekemans and were based on the polymorphisms at ten microsatellite loci. -

Acanthaceae Da Reserva Florestal Mata Do Paraíso, Viçosa, Minas Gerais1 DENISE M
Revista Brasil. Bot., V.25, n.4, p.495-504, dez. 2002 Acanthaceae da Reserva Florestal Mata do Paraíso, Viçosa, Minas Gerais1 DENISE M. BRAZ2, 5, RITA M. CARVALHO-OKANO3 e CÍNTIA KAMEYAMA4 (recebido: 16 de janeiro de 2002; aceito: 7 de agosto de 2002) ABSTRACT – (Acanthaceae of Mata do Paraíso Forest Reserve, Viçosa, Minas Gerais). A floristic survey of Acanthaceae is presented for the Mata do Paraíso Forest Reserve in the city of Viçosa, state of Minas Gerais, Brazil. The vegetation is mainly composed by forests belonging to the Atlantic Rain Forest Complex. Four genera and six species are recognized: Geissomeria schottiana Nees, Justicia scheidweileri V.A.W. Graham, Mendoncia velloziana Mart., Ruellia brevifolia (Pohl) C. Ezcurra, R. menthoides (Nees) Hiern, and R. subsessilis (Nees) Lindau. R. menthoides is a new record for the state of Minas Gerais. Identification keys for genera and species are provided, as well as descriptions, illustrations, geographic distributions, and comments on the taxonomic problems, uses and habitats of the species. RESUMO – (Acanthaceae da Reserva Florestal Mata do Paraíso, Viçosa, Minas Gerais). O trabalho apresenta o levantamento das Acanthaceae da Reserva Florestal Mata do Paraíso, no Município de Viçosa, MG, uma área predominantemente florestal do complexo vegetacional da Mata Atlântica. Foram registrados quatro gêneros e seis espécies: Geissomeria schottiana Nees, Justicia scheidweileri V.A.W. Graham, Mendoncia velloziana Mart., Ruellia brevifolia (Pohl) C. Ezcurra, R. menthoides (Nees) Hiern e R. subsessilis (Nees) Lindau, sendo que R. menthoides constituiu uma nova citação para Minas Gerais. São apresentadas chaves analíticas para gêneros e espécies, descrições, ilustrações, comentários taxonômicos e informações sobre usos e distribuição geográfica das espécies. -

Lamiales – Synoptical Classification Vers
Lamiales – Synoptical classification vers. 2.6.2 (in prog.) Updated: 12 April, 2016 A Synoptical Classification of the Lamiales Version 2.6.2 (This is a working document) Compiled by Richard Olmstead With the help of: D. Albach, P. Beardsley, D. Bedigian, B. Bremer, P. Cantino, J. Chau, J. L. Clark, B. Drew, P. Garnock- Jones, S. Grose (Heydler), R. Harley, H.-D. Ihlenfeldt, B. Li, L. Lohmann, S. Mathews, L. McDade, K. Müller, E. Norman, N. O’Leary, B. Oxelman, J. Reveal, R. Scotland, J. Smith, D. Tank, E. Tripp, S. Wagstaff, E. Wallander, A. Weber, A. Wolfe, A. Wortley, N. Young, M. Zjhra, and many others [estimated 25 families, 1041 genera, and ca. 21,878 species in Lamiales] The goal of this project is to produce a working infraordinal classification of the Lamiales to genus with information on distribution and species richness. All recognized taxa will be clades; adherence to Linnaean ranks is optional. Synonymy is very incomplete (comprehensive synonymy is not a goal of the project, but could be incorporated). Although I anticipate producing a publishable version of this classification at a future date, my near- term goal is to produce a web-accessible version, which will be available to the public and which will be updated regularly through input from systematists familiar with taxa within the Lamiales. For further information on the project and to provide information for future versions, please contact R. Olmstead via email at [email protected], or by regular mail at: Department of Biology, Box 355325, University of Washington, Seattle WA 98195, USA.