Mollusca: Polyplacophora
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Some Aspects of the Biology of Three Northwestern Atlantic Chitons
University of New Hampshire University of New Hampshire Scholars' Repository Doctoral Dissertations Student Scholarship Spring 1978 SOME ASPECTS OF THE BIOLOGY OF THREE NORTHWESTERN ATLANTIC CHITONS: TONICELLA RUBRA, TONICELLA MARMOREA, AND ISCHNOCHITON ALBUS (MOLLUSCA: POLYPLACOPHORA) PAUL DAVID LANGER University of New Hampshire, Durham Follow this and additional works at: https://scholars.unh.edu/dissertation Recommended Citation LANGER, PAUL DAVID, "SOME ASPECTS OF THE BIOLOGY OF THREE NORTHWESTERN ATLANTIC CHITONS: TONICELLA RUBRA, TONICELLA MARMOREA, AND ISCHNOCHITON ALBUS (MOLLUSCA: POLYPLACOPHORA)" (1978). Doctoral Dissertations. 2329. https://scholars.unh.edu/dissertation/2329 This Dissertation is brought to you for free and open access by the Student Scholarship at University of New Hampshire Scholars' Repository. It has been accepted for inclusion in Doctoral Dissertations by an authorized administrator of University of New Hampshire Scholars' Repository. For more information, please contact [email protected]. INFORMATION TO USERS This material was produced from a microfilm copy of the original document. While the most advanced technological means to photograph and reproduce this document have been used, the quality is heavily dependent upon the quality of the original submitted. The following explanation of techniques is provided to help you understand markings or patterns which may appear on this reproduction. 1.The sign or "target" for pages apparently lacking from the document photographed is "Missing Page(s)". If it was possible to obtain the missing page(s) or section, they are spliced into the film along with adjacent pages. This may have necessitated cutting thru an image and duplicating adjacent pages to insure you complete continuity. 2. When an image on the film is obliterated with a large round black mark, it is an indication that the photographer suspected that the copy may have moved during exposure and thus cause a blurred image. -

The Malacological Society of London
ACKNOWLEDGMENTS This meeting was made possible due to generous contributions from the following individuals and organizations: Unitas Malacologica The program committee: The American Malacological Society Lynn Bonomo, Samantha Donohoo, The Western Society of Malacologists Kelly Larkin, Emily Otstott, Lisa Paggeot David and Dixie Lindberg California Academy of Sciences Andrew Jepsen, Nick Colin The Company of Biologists. Robert Sussman, Allan Tina The American Genetics Association. Meg Burke, Katherine Piatek The Malacological Society of London The organizing committee: Pat Krug, David Lindberg, Julia Sigwart and Ellen Strong THE MALACOLOGICAL SOCIETY OF LONDON 1 SCHEDULE SUNDAY 11 AUGUST, 2019 (Asilomar Conference Center, Pacific Grove, CA) 2:00-6:00 pm Registration - Merrill Hall 10:30 am-12:00 pm Unitas Malacologica Council Meeting - Merrill Hall 1:30-3:30 pm Western Society of Malacologists Council Meeting Merrill Hall 3:30-5:30 American Malacological Society Council Meeting Merrill Hall MONDAY 12 AUGUST, 2019 (Asilomar Conference Center, Pacific Grove, CA) 7:30-8:30 am Breakfast - Crocker Dining Hall 8:30-11:30 Registration - Merrill Hall 8:30 am Welcome and Opening Session –Terry Gosliner - Merrill Hall Plenary Session: The Future of Molluscan Research - Merrill Hall 9:00 am - Genomics and the Future of Tropical Marine Ecosystems - Mónica Medina, Pennsylvania State University 9:45 am - Our New Understanding of Dead-shell Assemblages: A Powerful Tool for Deciphering Human Impacts - Sue Kidwell, University of Chicago 2 10:30-10:45 -

Download Preprint
1 Mobilising molluscan models and genomes in biology 2 Angus Davison1 and Maurine Neiman2 3 1. School of Life Sciences, University Park, University of Nottingham, NG7 2RD, UK 4 2. Department of Biology, University of Iowa, Iowa City, IA, USA and Department of Gender, 5 Women's, and Sexuality Studies, University of Iowa, Iowa, City, IA, USA 6 Abstract 7 Molluscs are amongst the most ancient, diverse, and important of all animal taxa. Even so, 8 no individual mollusc species has emerged as a broadly applied model system in biology. 9 We here make the case that both perceptual and methodological barriers have played a role 10 in the relative neglect of molluscs as research organisms. We then summarize the current 11 application and potential of molluscs and their genomes to address important questions in 12 animal biology, and the state of the field when it comes to the availability of resources such 13 as genome assemblies, cell lines, and other key elements necessary to mobilising the 14 development of molluscan model systems. We conclude by contending that a cohesive 15 research community that works together to elevate multiple molluscan systems to ‘model’ 16 status will create new opportunities in addressing basic and applied biological problems, 17 including general features of animal evolution. 18 Introduction 19 Molluscs are globally important as sources of food, calcium and pearls, and as vectors of 20 human disease. From an evolutionary perspective, molluscs are notable for their remarkable 21 diversity: originating over 500 million years ago, there are over 70,000 extant mollusc 22 species [1], with molluscs present in virtually every ecosystem. -

(Approx) Mixed Micro Shells (22G Bags) Philippines € 10,00 £8,64 $11,69 Each 22G Bag Provides Hours of Fun; Some Interesting Foraminifera Also Included
Special Price £ US$ Family Genus, species Country Quality Size Remarks w/o Photo Date added Category characteristic (€) (approx) (approx) Mixed micro shells (22g bags) Philippines € 10,00 £8,64 $11,69 Each 22g bag provides hours of fun; some interesting Foraminifera also included. 17/06/21 Mixed micro shells Ischnochitonidae Callistochiton pulchrior Panama F+++ 89mm € 1,80 £1,55 $2,10 21/12/16 Polyplacophora Ischnochitonidae Chaetopleura lurida Panama F+++ 2022mm € 3,00 £2,59 $3,51 Hairy girdles, beautifully preserved. Web 24/12/16 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 30mm+ € 4,00 £3,45 $4,68 30/04/21 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 27.9mm € 2,80 £2,42 $3,27 30/04/21 Polyplacophora Ischnochitonidae Stenoplax limaciformis Panama F+++ 16mm+ € 6,50 £5,61 $7,60 Uncommon. 24/12/16 Polyplacophora Chitonidae Acanthopleura gemmata Philippines F+++ 25mm+ € 2,50 £2,16 $2,92 Hairy margins, beautifully preserved. 04/08/17 Polyplacophora Chitonidae Acanthopleura gemmata Australia F+++ 25mm+ € 2,60 £2,25 $3,04 02/06/18 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 41mm+ € 4,00 £3,45 $4,68 West Indian 'fuzzy' chiton. Web 24/12/16 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 32mm+ € 3,00 £2,59 $3,51 West Indian 'fuzzy' chiton. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 44mm+ € 5,00 £4,32 $5,85 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F++ 35mm € 2,50 £2,16 $2,92 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 29mm+ € 3,00 £2,59 $3,51 Caribbean. -

Florida Keys Species List
FKNMS Species List A B C D E F G H I J K L M N O P Q R S T 1 Marine and Terrestrial Species of the Florida Keys 2 Phylum Subphylum Class Subclass Order Suborder Infraorder Superfamily Family Scientific Name Common Name Notes 3 1 Porifera (Sponges) Demospongia Dictyoceratida Spongiidae Euryspongia rosea species from G.P. Schmahl, BNP survey 4 2 Fasciospongia cerebriformis species from G.P. Schmahl, BNP survey 5 3 Hippospongia gossypina Velvet sponge 6 4 Hippospongia lachne Sheepswool sponge 7 5 Oligoceras violacea Tortugas survey, Wheaton list 8 6 Spongia barbara Yellow sponge 9 7 Spongia graminea Glove sponge 10 8 Spongia obscura Grass sponge 11 9 Spongia sterea Wire sponge 12 10 Irciniidae Ircinia campana Vase sponge 13 11 Ircinia felix Stinker sponge 14 12 Ircinia cf. Ramosa species from G.P. Schmahl, BNP survey 15 13 Ircinia strobilina Black-ball sponge 16 14 Smenospongia aurea species from G.P. Schmahl, BNP survey, Tortugas survey, Wheaton list 17 15 Thorecta horridus recorded from Keys by Wiedenmayer 18 16 Dendroceratida Dysideidae Dysidea etheria species from G.P. Schmahl, BNP survey; Tortugas survey, Wheaton list 19 17 Dysidea fragilis species from G.P. Schmahl, BNP survey; Tortugas survey, Wheaton list 20 18 Dysidea janiae species from G.P. Schmahl, BNP survey; Tortugas survey, Wheaton list 21 19 Dysidea variabilis species from G.P. Schmahl, BNP survey 22 20 Verongida Druinellidae Pseudoceratina crassa Branching tube sponge 23 21 Aplysinidae Aplysina archeri species from G.P. Schmahl, BNP survey 24 22 Aplysina cauliformis Row pore rope sponge 25 23 Aplysina fistularis Yellow tube sponge 26 24 Aplysina lacunosa 27 25 Verongula rigida Pitted sponge 28 26 Darwinellidae Aplysilla sulfurea species from G.P. -

Non-Collinear Hox Gene Expression in Bivalves and the Evolution
www.nature.com/scientificreports OPEN Non‑collinear Hox gene expression in bivalves and the evolution of morphological novelties in mollusks David A. Salamanca‑Díaz1, Andrew D. Calcino1, André L. de Oliveira2 & Andreas Wanninger 1* Hox genes are key developmental regulators that are involved in establishing morphological features during animal ontogeny. They are commonly expressed along the anterior–posterior axis in a staggered, or collinear, fashion. In mollusks, the repertoire of body plans is widely diverse and current data suggest their involvement during development of landmark morphological traits in Conchifera, one of the two major lineages that comprises those taxa that originated from a uni‑shelled ancestor (Monoplacophora, Gastropoda, Cephalopoda, Scaphopoda, Bivalvia). For most clades, and bivalves in particular, data on Hox gene expression throughout ontogeny are scarce. We thus investigated Hox expression during development of the quagga mussel, Dreissena rostriformis, to elucidate to which degree they might contribute to specifc phenotypic traits as in other conchiferans. The Hox/ParaHox complement of Mollusca typically comprises 14 genes, 13 of which are present in bivalve genomes including Dreissena. We describe here expression of 9 Hox genes and the ParaHox gene Xlox during Dreissena development. Hox expression in Dreissena is frst detected in the gastrula stage with widely overlapping expression domains of most genes. In the trochophore stage, Hox gene expression shifts towards more compact, largely mesodermal domains. Only few of these domains can be assigned to specifc developing morphological structures such as Hox1 in the shell feld and Xlox in the hindgut. We did not fnd traces of spatial or temporal staggered expression of Hox genes in Dreissena. -

Electrophoretic Heterogeneity Within and Between Flat Periwinkles
Hydrobiologia 378: 11–19, 1998. R. M. O’Riordan, G. M. Burnell, M. S. Davies & N. F. Ramsay (eds), Aspects of Littorinid Biology. 11 © 1998 Kluwer Academic Publishers. Printed in Belgium. Electrophoretic heterogeneity within and between flat periwinkles (Mollusca: Gastropoda) along an intertidal transect at Ria Ferrol, northwest Spain C. Olabarria1, J.-M. Timmermans2 & T. Backeljau2,∗ 1 Dept. Biology, Faculty of Biology, University of Santiago de Compostela, E-15706 Santiago de Compostela, Spain 2 Royal Belgian Institute of Natural Sciences, Vautierstraat 29, B-1000 Brussels, Belgium (∗ author for correspondence) Key words: esterases, Littorinidae, myoglobin, population genetics, Spain, systematics Abstract Using isoelectric focusing of esterases (EST), general proteins (GP) and myoglobin (Mb), we surveyed intra- and interspecific differentiation in flat periwinkles along a vertical intertidal transect in the Ensenada do Baño at Ria Ferrol, N.W. Spain. In this region, L. obtusata occurs in four algal belts, although it is rare in the lowest zone defined by Fucus serratus. L. fabalis is common in the F. serratus and F. vesiculosus belt, but is absent higher up on Ascophyllum nodosum and F. spiralis. Our data show that (1) EST and GP consistently differentiate between L. obtusata and L. fabalis, without however providing useful diagnostic markers, (2) L. fabalis is the less variable (heterozygous), but more heterogeneous species, (3) Mb patterns show significant heterogeneity in L. obtusata between the F. serratus zone and the other algal belts, but not in L. fabalis, and (4) the data on littorinid Mb appear inconsistent with a dimeric protein controlled by a single locus. Yet, assuming two loci coding for a monomeric (or dissociated dimeric) protein produces for the flat periwinkles a data set in which no significant deviations from Hardy-Weinberg expectations were detected. -

Zooarchaeology of Cinnamon Bay, St. John, Us Virgin Islands
Bull. Fla. Mus. Nat. Hist. (2003) 44(1): 131 -158 131 ZOOARCHAEOLOGY OF CINNAMON BAY, ST. JOHN, U.S. VIRGIN ISLANDS: PRE-COLUMBIAN OVEREXPLOITATION OF ANIMAL RESOURCES Irvy R. Quitmyeri The zooarchaeological remains from a stratigraphic sequence excavated from the ceremonial site of Cinnamon Bay, St. John, U.S. Virgin Islands, were studied. The samples were recovered using a fine-gauge (1/16 in) screen. During the course of this study, 443 minimum numbers of individuals and 99 species of vertebrates and invertebrates were identified. The fauna was analyzed by estimating the trophic level of reef, inshore, and pelagic zooarchaeological components from three strata representing the Monserrate (ca. A.D. 950), Santa Elena (ca. A.D. 570), and Chican (ca. A.D. 460) ceramic periods. The trophic level model shows an initial increase in the trophic level of taxa from the reef between the Monserrate and Santa Elena periods. This initial increase corresponds to the exponential growth of midden density. Relative to the earlier faunal assemblages, midden density and the mean trophic level of reef resources declines during the Chican period. Greater reliance on pelagic species from the deeper waters offshore and the increased use of mollusks from inshore habitats is also seen. The data show that at low levels of cultural complexity humans can alter their environments. This is particularly true of island biota where biological reservoirs are small. Key words: candy, Caribbean, island biogeography, trophic level, zooarchaeology This chapter presents a study of well-recovered Caribbean pre-Columbian people is not well zooarchaeological remains from the Cinnamon Bay site understood and should be considered in its formative (12Vam-2-3), St. -

'Disco' Clam Ctenoides Ales (Finlay, 1927): Mechanisms and Behavioral Function
Flashing in the 'Disco' Clam Ctenoides ales (Finlay, 1927): Mechanisms and Behavioral Function By Lindsey Dougherty Dissertation submitted in partial satisfaction of the requirements for the degree of Doctor of Philosophy in Integrative Biology in the Graduate Division of the University of California, Berkeley Committee in charge: Professor Roy L. Caldwell, Chair Professor David R. Lindberg Professor Damian O. Elias Spring 2016 Abstract Flashing in the 'Disco' Clam Ctenoides ales (Finlay, 1927): Mechanisms and Behavioral Function by Lindsey Dougherty Doctor of Philosophy in Integrative Biology University of California, Berkeley Professor Roy L. Caldwell, Chair This dissertation investigated the ‘disco’ clam Ctenoides ales (Limidae), which is the only bivalve in the world that has a behaviorally-mediated flashing display. Topics covered include (i) mechanisms, ultrastructure and movement that produce the flashing, (ii) the fitness value (function) of the flashing, (iii) the clams’ sensory abilities and vision, and (iv) the clams’ ecology, distribution and habitat. The flashing occurs on the clams’ mantle lip. Electron microscopy revealed two distinct tissue sides; one highly scattering side that contains dense aggregations of spheres composed of silica (white), and one highly absorbing side that does not (red). High-speed video confirmed that the two sides alternate rapidly, creating the appearance of flashing. Optical modeling suggested that the sphere’s diameter is nearly optimal for scattering light, especially at shorter wavelengths, which predominate in the ocean. This simple mechanism produces a striking optical effect. Three potential hypotheses for the fitness value of the flashing were investigated; conspecific attraction, prey luring, and/or predator deterrence. The lack of movement toward other C. -
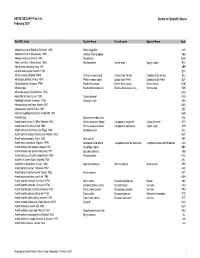
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Developing Perspectives on Molluscan Shells, Part 1: Introduction and Molecular Biology
CHAPTER 1 DEVELOPING PERSPECTIVES ON MOLLUSCAN SHELLS, PART 1: INTRODUCTION AND MOLECULAR BIOLOGY KEVIN M. KOCOT1, CARMEL MCDOUGALL, and BERNARD M. DEGNAN 1Present Address: Department of Biological Sciences and Alabama Museum of Natural History, The University of Alabama, Tuscaloosa, AL 35487, USA; E-mail: [email protected] School of Biological Sciences, The University of Queensland, St. Lucia, Queensland 4072, Australia CONTENTS Abstract ........................................................................................................2 1.1 Introduction .........................................................................................2 1.2 Insights From Genomics, Transcriptomics, and Proteomics ............13 1.3 Novelty in Molluscan Biomineralization ..........................................21 1.4 Conclusions and Open Questions .....................................................24 Keywords ...................................................................................................27 References ..................................................................................................27 2 Physiology of Molluscs Volume 1: A Collection of Selected Reviews ABSTRACT Molluscs (snails, slugs, clams, squid, chitons, etc.) are renowned for their highly complex and robust shells. Shell formation involves the controlled deposition of calcium carbonate within a framework of macromolecules that are secreted by the outer epithelium of a specialized organ called the mantle. Molluscan shells display remarkable morphological -
Diversity of Benthic Marine Mollusks of the Strait of Magellan, Chile
ZooKeys 963: 1–36 (2020) A peer-reviewed open-access journal doi: 10.3897/zookeys.963.52234 DATA PAPER https://zookeys.pensoft.net Launched to accelerate biodiversity research Diversity of benthic marine mollusks of the Strait of Magellan, Chile (Polyplacophora, Gastropoda, Bivalvia): a historical review of natural history Cristian Aldea1,2, Leslie Novoa2, Samuel Alcaino2, Sebastián Rosenfeld3,4,5 1 Centro de Investigación GAIA Antártica, Universidad de Magallanes, Av. Bulnes 01855, Punta Arenas, Chile 2 Departamento de Ciencias y Recursos Naturales, Universidad de Magallanes, Chile 3 Facultad de Ciencias, Laboratorio de Ecología Molecular, Departamento de Ciencias Ecológicas, Universidad de Chile, Santiago, Chile 4 Laboratorio de Ecosistemas Marinos Antárticos y Subantárticos, Universidad de Magallanes, Chile 5 Instituto de Ecología y Biodiversidad, Santiago, Chile Corresponding author: Sebastián Rosenfeld ([email protected]) Academic editor: E. Gittenberger | Received 19 March 2020 | Accepted 6 June 2020 | Published 24 August 2020 http://zoobank.org/9E11DB49-D236-4C97-93E5-279B1BD1557C Citation: Aldea C, Novoa L, Alcaino S, Rosenfeld S (2020) Diversity of benthic marine mollusks of the Strait of Magellan, Chile (Polyplacophora, Gastropoda, Bivalvia): a historical review of natural history. ZooKeys 963: 1–36. https://doi.org/10.3897/zookeys.963.52234 Abstract An increase in richness of benthic marine mollusks towards high latitudes has been described on the Pacific coast of Chile in recent decades. This considerable increase in diversity occurs specifically at the beginning of the Magellanic Biogeographic Province. Within this province lies the Strait of Magellan, considered the most important channel because it connects the South Pacific and Atlantic Oceans. These characteristics make it an interesting area for marine research; thus, the Strait of Magellan has histori- cally been the area with the greatest research effort within the province.