Buxbaum Y Escontria Chiotilla
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Cactaceas 2005 4 O.Pdf
98 Volumen 50 No. 4 octubre-diciembre 2005 CACTÁCEAS Y SUCULENTAS MEXICANAS Volumen 50 No. 4 octubre - diciembre 2005 Editor Fundador Jorge Meyrán Consejo Editorial Anatomía y Morfología Dra. Teresa Terrazas Colegio de Posgraduados Ecología Dr. Arturo Flores-Martínez Escuela Nacional de Ciencias Biológicas, IPN Etnobotánica Dr. Javier Caballero Nieto Jardín Botánico IB-UNAM Evolución y Genética Dr. Luis Eguiarte Instituto de Ecología, UNAM Fisiología Dr. Oscar Briones Instituto de Ecología A. C. Florística Cactáceas y Suculentas Mexicanas es una revista trimestral de circulación Dra. Raquel Galván internacional, arbitrada, publicada por la Sociedad Mexicana de Cactología, Escuela Nacional de Ciencias Biológicas, IPN A. C. desde 1955, su finalidad es promover el estudio científico y despertar Química Dra. Kasuko Aoki el interés en esta rama de la botánica. UAM-Xochimilco El contenido de los artículos es responsabilidad exclusiva de los autores. Se Sistemas Reproductivos autoriza su reproducción total o parcial siempre y cuando se cite la fuente. Dr. Francisco Molina F. Instituto de Ecología Campus Hermosillo, UNAM La revista Cactáceas y Suculentas Mexicanas se encuentra registrada en los Taxonomía y Sistemática siguientes índices: CAB Abstracts, Periodica y Latindex. Dr. Fernando Chiang Instituto de Biología, UNAM The journal Cactáceas y Suculentas Mexicanas is a publication of the Editores Mexican Society of Cactology, published since 1955. Dr. Jordan Golubov UAM-Xochimilco Complete or partial copying of articles is permitted only if the original Dra. María C. Mandujano Sánchez reference is cited. Instituto de Ecología, UNAM Asistentes editoriales The journal Cactaceas y Suculentas Mexicanas is registered in Biól. Gisela Aguilar Morales the following indices: CAB Abstracts, Periodica and Latindex. -

Repertorium Plantarum Succulentarum LIV (2003) Repertorium Plantarum Succulentarum LIV (2003)
ISSN 0486-4271 IOS Repertorium Plantarum Succulentarum LIV (2003) Repertorium Plantarum Succulentarum LIV (2003) Index nominum novarum plantarum succulentarum anno MMIII editorum nec non bibliographia taxonomica ab U. Eggli et D. C. Zappi compositus. International Organization for Succulent Plant Study Internationale Organisation für Sukkulentenforschung December 2004 ISSN 0486-4271 Conventions used in Repertorium Plantarum Succulentarum — Repertorium Plantarum Succulentarum attempts to list, under separate headings, newly published names of succulent plants and relevant literature on the systematics of these plants, on an annual basis. New names noted after the issue for the relevant year has gone to press are included in later issues. Specialist periodical literature is scanned in full (as available at the libraries at ZSS and Z or received by the compilers). Also included is information supplied to the compilers direct. It is urgently requested that any reprints of papers not published in readily available botanical literature be sent to the compilers. — Validly published names are given in bold face type, accompanied by an indication of the nomenclatu- ral type (name or specimen dependent on rank), followed by the herbarium acronyms of the herbaria where the holotype and possible isotypes are said to be deposited (first acronym for holotype), accord- ing to Index Herbariorum, ed. 8 and supplements as published in Taxon. Invalid, illegitimate, or incor- rect names are given in italic type face. In either case a full bibliographic reference is given. For new combinations, the basionym is also listed. For invalid, illegitimate or incorrect names, the articles of the ICBN which have been contravened are indicated in brackets (note that the numbering of some regularly cited articles has changed in the Tokyo (1994) edition of ICBN). -
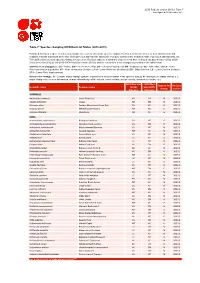
Table 7: Species Changing IUCN Red List Status (2012-2013)
IUCN Red List version 2013.2: Table 7 Last Updated: 25 November 2013 Table 7: Species changing IUCN Red List Status (2012-2013) Published listings of a species' status may change for a variety of reasons (genuine improvement or deterioration in status; new information being available that was not known at the time of the previous assessment; taxonomic changes; corrections to mistakes made in previous assessments, etc. To help Red List users interpret the changes between the Red List updates, a summary of species that have changed category between 2012 (IUCN Red List version 2012.2) and 2013 (IUCN Red List version 2013.2) and the reasons for these changes is provided in the table below. IUCN Red List Categories: EX - Extinct, EW - Extinct in the Wild, CR - Critically Endangered, EN - Endangered, VU - Vulnerable, LR/cd - Lower Risk/conservation dependent, NT - Near Threatened (includes LR/nt - Lower Risk/near threatened), DD - Data Deficient, LC - Least Concern (includes LR/lc - Lower Risk, least concern). Reasons for change: G - Genuine status change (genuine improvement or deterioration in the species' status); N - Non-genuine status change (i.e., status changes due to new information, improved knowledge of the criteria, incorrect data used previously, taxonomic revision, etc.) IUCN Red List IUCN Red Reason for Red List Scientific name Common name (2012) List (2013) change version Category Category MAMMALS Nycticebus javanicus Javan Slow Loris EN CR N 2013.2 Okapia johnstoni Okapi NT EN N 2013.2 Pteropus niger Greater Mascarene Flying -

Astrophytum Ornatum
MARÍA LORAINE MATIAS-PALAFOX1,2*, CECILIA LEONOR JIMÉNEZ-SIERRA2, JORDAN GOLUBOV3 AND MARÍA C. MANDUJANO4 Botanical Sciences 95 (2): 245-258, 2017 Abstract Background: There are no previous studies on the reproductive biology of the endemic and endangered cactus species DOI: 10.17129/botsci.780 Astrophytum ornatum. Questions: Is fowering continuous or episodic? What are the breeding and mating systems and what foral visitors are Copyright: © 2017 Matias-Palafox associated? and Does the reproductive success change over time? et al. This is an open access article Study species: Astrophytum ornatum (Cactaceae). distributed under the terms of the Study site and years of study: Observations from 2010 to 2011, in the highest density population of A. ornatum in Creative Commons Attribution Li- cense, which permits unrestricted Metztitlán Canyon (Hgo. México). use, distribution, and reproduction Methods: Monthly surveys and monitoring of reproductive structures. Tracking fowers in anthesis. Controlled pol- in any medium, provided the original linations to determine the mating system and determination of the Outcrossing Index (OCI), the pollen /ovule ratio and author and source are credited. breeding system. Results: Astrophytum ornatum produced fower buds throughout the year, but 89.2% of them were aborted. Four events of ephemeral fowering population were presented per year. The species is self-incompatible and controlled pollinations indicated pollinator limitation of several bee species. The OCI indicates that the species is facultative xenogamous, and pollen/ovule ratio indicates obligate xenogamy. On average there were 54 seeds/fruit and individuals produced 4 Author Contributions. fruits/year. M. L. Matias-Palafox: conceived, Conclusions: The continuous production of buds had rarely been reported for cacti. -

Smoley Special List SUMMER 2015
Bob Smoley’s Gardenworld 3720 SW 183rd Ter. – Dunnellon, FL 34432 Tel. 352-465-8254 – Fax. 352-465-4032 – [email protected] 2015 Summer – NEW PLANT OFFERINGS Most of these plants are not listed on the web site and are in small quantities…some are larger than generally offered and none have catalog numbers….when they are sold a lot of them offered might not be offered again or for a while so….first come ….first served….shipping, of course, is additional. Listed first are the most recent additions to this special listing. SINCE I AM NOW RECOVERING FROM A MAJOR SURGICAL OPERATION ORDERS MAY GO OUT A BIT SLOWER…..MY RECOVERY, I AM TOLD, CAN TAKE AS LONG AS 2-3 MONTHS BUT I HOPE IT WILL HAPPIN QUICKER. WE ARE SLOWING DOWN THE BUSINESS TRYING TO SEMI RETIRE AND ENJOY OUR GRADNCHILDREN. MARY ANN, MY WIFE, HAS LEARNED A LOT AND IS AND WILL BE OFFERING LESS IN THE FUTURE. AT ANY RATE EMAIL ME AT ANY TIME TO ASK ANY QUESTIONS AND WE WILL SOLVE THEM THE BEST WE CAN. PLANTS MARKED WITH * WILL REQUIRE EXTRA CARE IN PACKING AND SHIPPING CAN BE QUITE PRICY…..WE WILL ONLY CHARGE WHAT IT COSTS TO SEND….WE ARE NOT IN THE BUSINESS TO MAKE MONEY ON SHIPPING……. Albuca circinata – small bulbs with grass like foliage, 3-4 inch pot size. SPECIAL $4.00 Albuca sp. Agerby Hills – another bulb, nice easy grower, 3 inch pot size. SPECIAL $4.00 Albuca namaquensis – another with nice whispy grass like leaves. SPECIAL $4.00 Albuca scholandii – South African bulb, one inch bulbs SPECIAL $4.00 Echinopsis calorubra – for 3 inch pots plus. -

Comercio Espinoso Comercio Espinoso
Comercio EspinosoComercio TRAFFIC NORTEAMÉRICA Comercio Espinoso Comercio y conservacion de cactos en el Desierto Chihuahuense Christopher S. Robbins, Editor TRAFFIC, the wildlife trade monitoring network, works to ensure that trade in wild plants and animals is not a threat to the con- servation of nature. It has offices covering most parts of the world and works in close co-operation with the Secretariat of the Convention on International Trade in Endangered Species of Wild Fauna and Flora (CITES). For further information contact: The Director TRAFFIC North America c/o World Wildlife Fund-US 1250 24th Street, N.W. Washington, D.C. 20037 Telephone: 202-293-4800 Fax: 202-775-8287 Email: [email protected] Web Site: www.traffic.org Comercio Espinoso Comercio y conservación de cactos en el Desierto Chihuahuense Christopher S. Robbins, Editor Parte I: Los cactos del Desierto Chihuahuense en los Estados Unidos: Una evaluación del comercio, la administración y las prioridades de conservación por Christopher S. Robbins Parte II: Los cactos del Desierto Chihuahuense en México: Una evaluación del comercio, la administración y las prioridades de conservación por Rolando Tenoch Bárcenas Luna Enero 2003 TRAFFIC Norteamérica Fondo Mundial para la Naturaleza 1250 24th Street NW Washington DC 20037 Visite www.traffic.org para una edición electrónica de este informe, y para obtener más información sobre TRAFFIC Norteamérica. © 2003 WWF. Todos los derechos reservados por el Fondo Mundial para la Naturaleza, Inc. Todo el material que aparece en esta publicación está protegido por los derechos del autor y puede ser reproducido con permiso previo. Cualquier reproducción, de toda o parte de esta publicación debe acreditar a TRAFFIC Norteamérica. -

The Passion for Cacti and Other Succulents ISSN 2285 – 3987
the passion for cacti and other succulents ISSN 2285 – 3987 10 Oct 2014 the passion for cacti and other succulents contents 3 · Editorial 10 97 · Sprekelia formosissima Ecology-Biology | Eduart | Xerophilia Conservation Contributions Connoisseur’s Notes 85 · When succulents attack! A peninsula under threat 4 · Carnivorous xeric flora in San 42 · Agave potatorum and other | Jennifer Pannell Luis Potosi. Mexico xerophytes in Tepanco de López, | Pedro Nájera Quezada Puebla | Francisco Moreno Aztekium valdezii Dossier 31 · Iconography of Agave univittata Haw. and Agave lechuguilla Torr. 57 · Mammillaria theresae Cutak and 95 · The step forward (Agavaceae) Mammillaria deherdtiana Farwig | Dag Panco | Piet van der Meer & al. (On the history of cv. albiflora) | Stefan Nitzschke Xero-Art Travelogues 72 · Touring some Lithops in the wild 98 · Some of my recent fine rta | Judd Kirkel Welwitch 17 · Three weeks in Mexico works Part one | Leo Rodríguez | Aldo Delladdio News & Events 52 · A Dane visiting Romania 48 · A new fantastic plant: Online Journals A story about friendship and Mammillaria bertholdii Linzen 103 · Online magazines cacti. spec. nova | Xerophlia Part one | Xerophilia | Erik Holm 61 · Festa del Cactus 2014 What’s cooking? | Andrea Cattabriga Bits & Pieces 105 · What else do we have prepared 101 · A sad summer for for Xerophilia 11 30 · An example of evolutionary the Romanian cactus | Xerophilia regression enthusiasts | Andrea Cattabriga | Xerophilia Founders: Eduart Zimer • Dag Panco • Valentin Posea • is resting with the authors. By simply submitting the papers for publication the Editorial team: Eduart Zimer - Editor • Dag Panco - PR • Andrea Cattabriga authors confirm that they are the legal copyright holders. Opinions expressed by - Graphic layout • Pedro Nájera Quezada - Field researches • Miguel Angel the authors in the journal are not necessarily those of the members of Editorial Gonzalez Botello - Cartography. -

To the Point
TO THE POINT Newsletter of the Cactus and Succulent Society of America SUPPLEMENT TO THE CACTUS AND SUCCULENT JOURNAL Vol 87 No 1 << January - February >> 2015 EDUCATION TROPHY TO THE POINT Joe Clements <[email protected]> NEWSLETTER OF THE CSSA 927 Occidental Dr., Claremont CA 91711-2552 Send copy of show schedule/program giving credit to the CSSA for donation of the trophy with Vol 87 No. 1 - January - February 2015 request. Two or more entries are required to qualify. CSSA Officers (2-yr terms) Allow at least 6 weeks after request. Terms ending 1/2017 President: Gregg DeChirico 415-407-7898 MEMBERSHIP Vice-President: Judy Pigue 816-886-1177 Active Membership, including Journal and Immediate Past President: Newsletter for USA $50; Associate (spouse/ Laurel Woodley 310-375-4472 significant other/partner) membership is an add’l Secretary: Lee J. Miller 202-232-0629 $10. Institutional $100. See Affiliate Information. Treasurer: Clifford Meng 714-870-4887 Membership is on a yearly basis from join date or date of renewal. Members will receive 6 issues of the CSSA Journal and To The Point each CSSA Directors (4-yr terms) subscription year. Life Membership, including Terms ending 1/2016 Journal and Newsletter is $900. International Joseph Clements 909-816-7398 Membership (all countries) is $70. Send fees in Eric Driskill 314-757-4201 $ U.S. or Visa/MasterCard (no cash) to Cactus & Cynthia Robinson 602-615-2261 Succulent Society of America, P. O. Box 1000, Terms ending 1/2017 Claremont, CA 91711; Tel: 626-852-8085. email Randy Baldwin 805-683-1561 <[email protected]> or use our convenient Buck Hemenway 951-360-8802 membership online at CSSAinc.org. -

Prickly Trade: Trade & Conservation of Chihuahuan Desert Cacti (PDF, 1.1
Prickly Trade Trade and Conservation of Chihuahuan Desert Cacti Christopher S. Robbins, Editor Prickly Trade Trade and Conservation of Chihuahuan Desert Cacti Christopher S. Robbins, Editor Part I: Chihuahuan Desert Cacti in the United States: An Assessment of Trade, Management, and Conservation Priorities by Christopher S. Robbins Part II: Chihuahuan Desert Cacti in Mexico: An Assessment of Trade, Management, and Conservation Priorities by Rolando Tenoch Bárcenas Luna January 2003 TRAFFIC North America World Wildlife Fund 1250 24th Street NW Washington DC 20037 Visit www.traffic.org for an electronic edition of this report, and for more information about TRAFFIC North America. © 2003 WWF. All rights reserved by World Wildlife Fund, Inc. All material appearing in this publication is copyrighted and may be reproduced with permission. Any reproduction, in full or in part, of this publication must credit TRAFFIC North America. The views of the authors expressed in this publication do not necessarily reflect those of the TRAFFIC Network, World Wildlife Fund (WWF), or IUCN-The World Conservation Union. The designation of geographical entities in this publication and the presentation of the material do not imply the expression of any opinion whatsoever on the part of TRAFFIC or its supporting organizations concerning the legal status of any country, territory, or area, or of its authorities, or concerning the delimitation of its frontiers or boundaries. The TRAFFIC symbol copyright and Registered Trademark ownership are held by WWF. TRAFFIC is a joint program of WWF and IUCN. Suggested citation: Robbins, Christopher S., ed. 2003. Prickly Trade: Trade and Conservation of Chihuahuan Desert Cacti, by Christopher S. -

Liste Der Seit 1997 Neu Beschriebenen Mexikanischen Kakteen (Stand 31.12.2015)
Liste der seit 1997 neu beschriebenen mexikanischen Kakteen (Stand 31.12.2015) Vorwort: Diese Liste wurde der Deutschen Kakteen-Gesellschaft e. V. von Andrea Cattabriga, Bologna, Italien zur Verfügung gestellt und durch Angaben aus The International Plant Names Index (online abrufbar unter www.ipni.org) ergänzt. Sie wurde weder auf die Vollständigkeit noch auf inhaltliche Richtigkeit überprüft. Von einigen Taxa existieren mittlerweile auch Umkombinationen, die aber in der Liste nicht aufgeführt sind. Taxon Literatur Acharagma huasteca Elhart CactusWorld 29(2): 105–106. 2011. Ancistrocactus brevihamatus (Engelmann) Britton & Rose Cacti Trans-Pecos: 339–343. 2004. var. pallidus A. D. Zimmerman ex A. M. Powell Ancistrocactus pinkavanus García-Morales, González-Botello Acta Succulenta 2(1): 35. 2014. & R. González Ariocarpus kotschoubeyanus (Lemaire) K. Schumann subsp. Acta Mus. Richnov., Sect. Nat. 9(1): 51–52. neotulensis Halda 2002. Ariocarpus kotschoubeyanus (Lemaire) K. Schumann subsp. Acta Mus. Richnov., Sect. Nat. 9(1): 3–4. 2002. skarupkeanus Halda & Horáček Ariocarpus retusus Scheidweiler subsp. pectinatus Weisbarth Kakteen and. Sukk. 54(11): 291. 2003. Ariocarpus agavoides (Castaneda) E .F. Anderson Acta Mus. Richnov., Sect. Nat. 10(2): 149. 2003. subsp. pulcher Halda & Horáček Ariocarpus confusus Halda & Horáček Cactaceae etc. 7(1): 1, 3–4. 1997. Ariocarpus retusus Scheidweiler Cactaceae etc. 7(3): 97–98. 1997. subsp. scapharostroides Halda & Horáček Ariocarpus scapharostrus Boedeker var. swobodae Halda, Acta Mus. Richnov., Sect. Nat. 5(4): 163. 1998. Horáček & Panarotto Ariocarpus trigonus K. Schumann var. horacekii Halda Cactaceae etc. 7(3): 97–99. 1997. Astrophytum capricorne (A. Dietrich) Britton & Rose Kaktusy (Brno) 47:(1): 4–10. 2011. subsp. sanjuanense Pavlíček Astrophytum caput-medusae D. -
High Proportion of Cactus Species Threatened with Extinction
ORE Open Research Exeter TITLE High proportion of cactus species threatened with extinction AUTHORS Goettsch, B; Hilton-Taylor, C; Cruz-Pinon, G; et al. JOURNAL Nature Plants DEPOSITED IN ORE 01 September 2015 This version available at http://hdl.handle.net/10871/18155 COPYRIGHT AND REUSE Open Research Exeter makes this work available in accordance with publisher policies. A NOTE ON VERSIONS The version presented here may differ from the published version. If citing, you are advised to consult the published version for pagination, volume/issue and date of publication High proportion of cactus species threatened with extinction Supplementary Information Supplementary Methods References (26-37) Database IUCN’s online database, the Species Information Service (SIS), was used to capture the species information. This database was developed to capture and store the information necessary to carry out conservation assessments using the IUCN Red List Categories and Criteria 2. It consists of text and numeric fields, and the different classification schemes (e.g. habitat types, threats, use and trade; 5) are integrated as selection boxes. This allows for post hoc analyses. Data compilation The first step in data compilation consisted of populating the SIS database with information available from the literature. The information was entered in the form of the species distributions, population trends, habitat preferences and ecology, conservation actions, use and trade. This task was carried out prior to the workshops (see below) to provide the experts with information they could build on to assess species. Occurrence point data Over 38,000 occurrence point data records were compiled from academic institutions and experts, in the form of geographic coordinates. -

Factores De Riesgo En Las Cactaceae Amenazadas De Una Región Semiárida En El Sur Del Desierto Chihuahuense, México
FACTORES DE RIESGO EN LAS CACTACEAE AMENAZADAS DE UNA REGIÓN SEMIÁRIDA EN EL SUR DEL DESIERTO CHIHUAHUENSE, MÉXICO José Guadalupe Hernández-Oria, Ruth Chávez-MARTÍNEZ y Emiliano Sánchez-MARTÍNEZ RESUMEN El Semidesierto Queretano, en el centro de México, alberga para explorar su efecto en las poblaciones amenazadas. Se encon- uno de las principales ensambles de cactáceas amenazadas en el tró que la transformación y destrucción de hábitat derivada de Desierto Chihuahuense, la ecoregión con la mayor diversidad de actividades antrópicas, al igual que características demográficas Cactaceae en el mundo. Desde hace algunas décadas se recono- adversas como la baja densidad poblacional y de plántulas, repre- ce una aguda y compleja problemática para la supervivencia de sentan los mayores riesgos para el contingente de cactáceas ame- estos taxa, debido principalmente a las actividades antrópicas y nazadas. Los resultados sugieren que la modificación y pérdida la extracción ilegal. Las especies amenazadas comúnmente son de hábitat deben ser considerados factores de alto impacto para biológicamente raras, dada sus limitadas áreas de distribución y la supervivencia y vulnerabilidad de las especies amenazadas. La abundancia. No obstante, se desconoce la influencia de elementos conservación de este ensamble cactológico implica la protección de riesgo potencial en el desarrollo natural de las especies. Por de los matorrales secos como ambiente natural fundamental para ello se evaluó un conjunto de potenciales factores de perturbación su salvaguarda,