Manual De Hepatites Virais
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Supplementary Table 1: Adhesion Genes Data Set
Supplementary Table 1: Adhesion genes data set PROBE Entrez Gene ID Celera Gene ID Gene_Symbol Gene_Name 160832 1 hCG201364.3 A1BG alpha-1-B glycoprotein 223658 1 hCG201364.3 A1BG alpha-1-B glycoprotein 212988 102 hCG40040.3 ADAM10 ADAM metallopeptidase domain 10 133411 4185 hCG28232.2 ADAM11 ADAM metallopeptidase domain 11 110695 8038 hCG40937.4 ADAM12 ADAM metallopeptidase domain 12 (meltrin alpha) 195222 8038 hCG40937.4 ADAM12 ADAM metallopeptidase domain 12 (meltrin alpha) 165344 8751 hCG20021.3 ADAM15 ADAM metallopeptidase domain 15 (metargidin) 189065 6868 null ADAM17 ADAM metallopeptidase domain 17 (tumor necrosis factor, alpha, converting enzyme) 108119 8728 hCG15398.4 ADAM19 ADAM metallopeptidase domain 19 (meltrin beta) 117763 8748 hCG20675.3 ADAM20 ADAM metallopeptidase domain 20 126448 8747 hCG1785634.2 ADAM21 ADAM metallopeptidase domain 21 208981 8747 hCG1785634.2|hCG2042897 ADAM21 ADAM metallopeptidase domain 21 180903 53616 hCG17212.4 ADAM22 ADAM metallopeptidase domain 22 177272 8745 hCG1811623.1 ADAM23 ADAM metallopeptidase domain 23 102384 10863 hCG1818505.1 ADAM28 ADAM metallopeptidase domain 28 119968 11086 hCG1786734.2 ADAM29 ADAM metallopeptidase domain 29 205542 11085 hCG1997196.1 ADAM30 ADAM metallopeptidase domain 30 148417 80332 hCG39255.4 ADAM33 ADAM metallopeptidase domain 33 140492 8756 hCG1789002.2 ADAM7 ADAM metallopeptidase domain 7 122603 101 hCG1816947.1 ADAM8 ADAM metallopeptidase domain 8 183965 8754 hCG1996391 ADAM9 ADAM metallopeptidase domain 9 (meltrin gamma) 129974 27299 hCG15447.3 ADAMDEC1 ADAM-like, -

Cell Biology of Tight Junction Barrier Regulation and Mucosal Disease
Downloaded from http://cshperspectives.cshlp.org/ on October 1, 2021 - Published by Cold Spring Harbor Laboratory Press Cell Biology of Tight Junction Barrier Regulation and Mucosal Disease Aaron Buckley and Jerrold R. Turner Departments of Pathology and Medicine (Gastroenterology), Brigham and Women’s Hospital and Harvard Medical School, Boston, Massachusetts 02115 Correspondence: [email protected] Mucosal surfaces are lined by epithelial cells. In the intestine, the epithelium establishes a selectively permeable barrier that supports nutrient absorption and waste secretion while preventing intrusion by luminal materials. Intestinal epithelia therefore play a central role in regulating interactions between the mucosal immune system and luminal contents, which include dietary antigens, a diverse intestinal microbiome, and pathogens. The paracellular space is sealed by the tight junction, which is maintained by a complex network of protein interactions. Tight junction dysfunction has been linked to a variety of local and systemic diseases. Two molecularly and biophysically distinct pathways across the intestinal tight junc- tion are selectively and differentially regulated by inflammatory stimuli. This review discusses the mechanisms underlying these events, their impact on disease, and the potential of using these as paradigms for development of tight junction-targeted therapeutic interventions. ucosal surfaces and the epithelial cells that adherens). The tight junction is a selectively Mline them are present at sites where tissues permeable barrier that generally represents the interface directly with the external environment rate-limiting step of paracellular transport. The or internal compartments that are contiguous adherens junction and desmosome provide es- with the external environment. Examples in- sential adhesive and mechanical properties that clude the gastrointestinal tract, the pulmonary contribute to barrier function but do not seal tree, and the genitourinary tract. -

Quinone Oxidoreductase-1 in the Tight Junctions of Colonic Epithelial Cells
BMB Rep. 2014; 47(9): 494-499 BMB www.bmbreports.org Reports Role of NADH: quinone oxidoreductase-1 in the tight junctions of colonic epithelial cells Seung Taek Nam1,#, Jung Hwan Hwang2,#, Dae Hong Kim1, Mi Jung Park1, Ik Hwan Lee1, Hyo Jung Nam1, Jin Ku Kang1, Sung Kuk Kim1, Jae Sam Hwang3, Hyo Kyun Chung4, Minho Shong4, Chul-Ho Lee2,* & Ho Kim1,* 1Department of Life Science, College of Natural Science, Daejin University, Pocheon 487-711, 2Laboratory Animal Resource Center, Korea Research Institute of Bioscience and Biotechnology (KRIBB), Daejeon 305-806, 3Department of Agricultural Biology, National Academy of Agricultural Science, RDA, Suwon 441-707, 4Department of Internal Medicine, Chungnam National University, Daejon 301-721, Korea NADH:quinone oxidoreductase 1 (NQO1) is known to be lating the intracellular ratio of NAD and NADH (two funda- involved in the regulation of energy synthesis and metabolism, mental mediators of energy metabolism) in various cell and the functional studies of NQO1 have largely focused on systems. NQO1 is also known as an antioxidant flavoprotein metabolic disorders. Here, we show for the first time that that scavenges reactive oxygen species (ROS) (3). Having pre- compared to NQO1-WT mice, NQO1-KO mice exhibited a viously shown that NQO1 activity is associated with cancer (4) marked increase of permeability and spontaneous inflammation and metabolic disorders, including diabetes and obesity (5), in the gut. In the DSS-induced colitis model, NQO1-KO mice we herein focused on the possible role of NQO1 in the gastro- showed more severe inflammatory responses than NQO1-WT intestinal tract. We report for the first time that the expression mice. -

Defenders and Challengers of Endothelial Barrier Function
REVIEW published: 18 December 2017 doi: 10.3389/fimmu.2017.01847 Defenders and Challengers of Endothelial Barrier Function Nader Rahimi* Department of Pathology, Boston University School of Medicine, Boston, MA, United States Regulated vascular permeability is an essential feature of normal physiology and its dysfunction is associated with major human diseases ranging from cancer to inflam- mation and ischemic heart diseases. Integrity of endothelial cells also play a prominent role in the outcome of surgical procedures and organ transplant. Endothelial barrier function and integrity are regulated by a plethora of highly specialized transmembrane receptors, including claudin family proteins, occludin, junctional adhesion molecules (JAMs), vascular endothelial (VE)-cadherin, and the newly identified immunoglobulin (Ig) and proline-rich receptor-1 (IGPR-1) through various distinct mechanisms and signaling. On the other hand, vascular endothelial growth factor (VEGF) and its tyrosine kinase receptor, VEGF receptor-2, play a central role in the destabilization of endothelial barrier function. While claudins and occludin regulate cell–cell junction via recruitment of zonula occludens (ZO), cadherins via catenin proteins, and JAMs via ZO and afadin, IGPR-1 recruits bullous pemphigoid antigen 1 [also called dystonin (DST) and SH3 protein inter- Edited by: acting with Nck90/WISH (SH3 protein interacting with Nck)]. Endothelial barrier function Thomas Luft, is moderated by the function of transmembrane receptors and signaling events that act University Hospital Heidelberg, Germany to defend or destabilize it. Here, I highlight recent advances that have provided new Reviewed by: insights into endothelial barrier function and mechanisms involved. Further investigation Luiza Guilherme, of these mechanisms could lead to the discovery of novel therapeutic targets for human University of São Paulo, Brazil diseases associated with endothelial dysfunction. -

Estudio Del Receptor 2 De La Dopamina En Ovario Humano Y Efecto De Su Modulación Sobre El Síndrome De Hiperestimulación Ovárica”
Facultad de Medicina y Odontología Departamento de Pediatría, Obstetricia y Ginecología. “Estudio del receptor 2 de la dopamina en ovario humano y efecto de su modulación sobre el Síndrome de Hiperestimulación Ovárica” Tesis doctoral presentada por: Francisco Manuel Delgado Rosas Dirigida por: Prof. Antonio Pellicer Martínez Dr. Raúl Gómez Gallego Prof. Francisco Gaytán Luna Tutor: Prof. Carlos Simón Vallés 290 F OBSTETRICIA I GINECOLOGIA II Valencia 2012 D. Antonio Pellicer Martínez, Catedrático del Departamento de Pediatría, Obstetricia y Ginecología de la Facultad de Medicina de la Universidad de Valencia. D. Raúl Gómez Gallego, Doctor en Ciencias Biológicas e Investigador contratado por la Fundación IVI. Valencia D. Francisco Gaytán Luna, Catedrático del Departamento de Biología Celular, Fisiología e Inmunología de la Facultad de Medicina de la Universidad de Córdoba. CERTIFICAN: Que el trabajo titulado: “Estudio del receptor 2 de la dopamina en ovario humano y efecto de su modulación sobre el Síndrome de Hiperestimulación Ovárica” ha sido realizado íntegramente por D. Francisco Manuel Delgado Rosas bajo nuestra supervisión. Dicho trabajo está concluido y reúne todos los requisitos para su presentación y defensa como TESIS DOCTORAL ante un tribunal. Y para que conste así a los efectos oportunos, firmamos la presente certificación en Valencia a 22 de Febrero de 2012. Fdo. Prof. Antonio Pellicer Martínez Fdo. Dr. Raúl Gómez Gallego Fdo. Prof. Francisco Gaytán Luna LISTA DE ABREVIATURAS AII: Angiotensina II ACE: Enzima convertidora de -

Tight Junction-Based Epithelial Microenvironment and Cell Proliferation
Oncogene (2008) 27, 6930–6938 & 2008 Macmillan Publishers Limited All rights reserved 0950-9232/08 $32.00 www.nature.com/onc REVIEW Tight junction-based epithelial microenvironment and cell proliferation S Tsukita1, Y Yamazaki, T Katsuno, A Tamura and S Tsukita2 Laboratory of Biological Science, Graduate School of Frontier Biosciences/Graduate School of Medicine, Osaka University, Suita, Osaka, Japan Belt-like tight junctions (TJs), referred to as zonula bodies of multicellular organisms. The sheet-like divi- occludens, have long been regarded as a specialized sions allow diffusion barrier formation and selective differentiation of epithelial cell membranes. They are permeation of substances and ions (permselectivity), required for cell adhesion and paracellular barrier func- both excluding unnecessary or toxic molecules and tions, and are now thought to be partly involved in fence including necessary components to maintain home- functions and in cell polarization. Recently, the molecular ostasis. The combination of the belt-like adherens bases of TJs have gradually been unveiled. TJs are junctions (AJs) and tight junctions (TJs) have important constructed by TJ strands, whose basic frameworks are functions in the formation of epithelial cell sheets and composed of integral membrane proteins with four also in the formation of paracellular permselective transmembrane domains, designated claudins. The claudin barriers through their functions as septa (Mitic and family is supposedly composed of at least 24 members in Anderson, 1998; Tsukita and Furuse, 1999; Hartsock mice and humans. Other types of integral membrane and Nelson, 2008). Paracellular barrier functions with proteins with four transmembrane domains, namely occlu- permselectivity are unique to the epithelial cell system din and tricellulin, as well as the single transmembrane and regulate the internal homeostasis of ions and solutes proteins, JAMs (junctional adhesion molecules)and CAR in the body. -
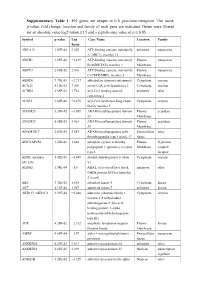
Supplementary Table 1
Supplementary Table 1. 492 genes are unique to 0 h post-heat timepoint. The name, p-value, fold change, location and family of each gene are indicated. Genes were filtered for an absolute value log2 ration 1.5 and a significance value of p ≤ 0.05. Symbol p-value Log Gene Name Location Family Ratio ABCA13 1.87E-02 3.292 ATP-binding cassette, sub-family unknown transporter A (ABC1), member 13 ABCB1 1.93E-02 −1.819 ATP-binding cassette, sub-family Plasma transporter B (MDR/TAP), member 1 Membrane ABCC3 2.83E-02 2.016 ATP-binding cassette, sub-family Plasma transporter C (CFTR/MRP), member 3 Membrane ABHD6 7.79E-03 −2.717 abhydrolase domain containing 6 Cytoplasm enzyme ACAT1 4.10E-02 3.009 acetyl-CoA acetyltransferase 1 Cytoplasm enzyme ACBD4 2.66E-03 1.722 acyl-CoA binding domain unknown other containing 4 ACSL5 1.86E-02 −2.876 acyl-CoA synthetase long-chain Cytoplasm enzyme family member 5 ADAM23 3.33E-02 −3.008 ADAM metallopeptidase domain Plasma peptidase 23 Membrane ADAM29 5.58E-03 3.463 ADAM metallopeptidase domain Plasma peptidase 29 Membrane ADAMTS17 2.67E-04 3.051 ADAM metallopeptidase with Extracellular other thrombospondin type 1 motif, 17 Space ADCYAP1R1 1.20E-02 1.848 adenylate cyclase activating Plasma G-protein polypeptide 1 (pituitary) receptor Membrane coupled type I receptor ADH6 (includes 4.02E-02 −1.845 alcohol dehydrogenase 6 (class Cytoplasm enzyme EG:130) V) AHSA2 1.54E-04 −1.6 AHA1, activator of heat shock unknown other 90kDa protein ATPase homolog 2 (yeast) AK5 3.32E-02 1.658 adenylate kinase 5 Cytoplasm kinase AK7 -

Relocalization of Cell Adhesion Molecules During Neoplastic Transformation of Human Fibroblasts
INTERNATIONAL JOURNAL OF ONCOLOGY 39: 1199-1204, 2011 Relocalization of cell adhesion molecules during neoplastic transformation of human fibroblasts CRISTINA BELGIOVINE, ILARIA CHIODI and CHIARA MONDELLO Istituto di Genetica Molecolare, Consiglio Nazionale delle Ricerche, Via Abbiategrasso 207, 27100 Pavia, Italy Received May 6, 2011; Accepted June 10, 2011 DOI: 10.3892/ijo.2011.1119 Abstract. Studying neoplastic transformation of telomerase cell-cell contacts (1,2). Cadherins are transmembrane glyco- immortalized human fibroblasts (cen3tel), we found that the proteins mediating homotypic cell-cell adhesion via their transition from normal to tumorigenic cells was associated extracellular domain. Through their cytoplasmic domain, with the loss of growth contact inhibition, the acquisition of an they bind to catenins, which mediate the connection with the epithelial-like morphology and a change in actin organization, actin cytoskeleton. Different types of cadherins are expressed from stress fibers to cortical bundles. We show here that these in different cell types; e.g. N-cadherin is typically expressed variations were paralleled by an increase in N-cadherin expres- in mesenchymal cells, such as fibroblasts, while E-cadherin sion and relocalization of different adhesion molecules, such participates in the formation of adherens junctions in cells of as N-cadherin, α-catenin, p-120 and β-catenin. These proteins epithelial origin. The role of E-cadherin and β-catenin in the presented a clear membrane localization in tumorigenic cells development and progression of tumors of epithelial origin compared to a more diffuse, cytoplasmic distribution in is well documented (3). In particular, loosening of cell-cell primary fibroblasts and non-tumorigenic immortalized cells, contacts because of loss of E-cadherin expression and nuclear suggesting that tumorigenic cells could form strong cell-cell accumulation of β-catenin are hallmarks of the epithelial- contacts and cell contacts did not induce growth inhibition. -

Claudin Multigene Family Encoding Four-Transmembrane Domain Protein Components of Tight Junction Strands
Proc. Natl. Acad. Sci. USA Vol. 96, pp. 511–516, January 1999 Cell Biology Claudin multigene family encoding four-transmembrane domain protein components of tight junction strands KAZUMASA MORITA*†,MIKIO FURUSE*, KAZUSHI FUJIMOTO‡, AND SHOICHIRO TSUKITA*§ Departments of *Cell Biology, †Dermatology, and ‡Anatomy, Faculty of Medicine, Kyoto University, Sakyo-ku, Kyoto 606, Japan Communicated by Setsuro Ebashi, National Institute for Physiological Sciences, Okazaki, Japan, November 9, 1998 (received for review September 4, 1998) ABSTRACT Two related integral membrane proteins, well as fence functions of TJs (24–27). Recently, gene knock- claudin-1 and -2, recently were identified as novel components out of occludin was performed successfully, but, unexpectedly, of tight junction (TJ) strands. Here, we report six more occludin-deficient epithelial cells still demonstrated a well claudin-like proteins, indicating the existence of a claudin developed network of TJ strands (28). gene family. Three of these were reported previously as RVP1, Most recently, as the second and third components of TJ Clostridium perfringens enterotoxin receptor, and TMVCF, but strand, claudin-1 and -2, '22-kDa integral membrane proteins their physiological functions were not determined. Through that are structurally related (38% identical at the amino acid similarity searches followed by PCR, we isolated full length sequence level), were identified (29). These two proteins also cDNAs of mouse RVP1, Clostridium perfringens enterotoxin bear four transmembrane domains but do not show any receptor, and TMVCF as well as three mouse claudin-like sequence similarity to occludin. Furthermore, it was shown proteins and designated them as claudin-3 to -8, respectively. that claudin-1 and -2 have an ability to induce the formation All of these claudin family members showed similar patterns of networks of strandsygrooves at cell–cell contact sites when on hydrophilicity plots, which predicted four transmembrane introduced into fibroblasts lacking TJs (30). -

Reciprocal Regulation of the Junctional Proteins Claudin-1 and Connexin43 by Interleukin-1 in Primary Human Fetal Astrocytes
The Journal of Neuroscience, 2000, Vol. 20 RC114 1of6 Reciprocal Regulation of the Junctional Proteins Claudin-1 and Connexin43 by Interleukin-1 in Primary Human Fetal Astrocytes Heather S. Duffy,1 Gareth R. John,2 Sunhee C. Lee,2 Celia F. Brosnan,1,2 and David C. Spray1 Departments of 1Neuroscience and 2Pathology, Albert Einstein College of Medicine, Bronx, New York 10461 Vertebrate tissues use multiple junctional types to establish and no change in expression of zonula occludens proteins ZO-1 maintain tissue architecture, including gap junctions for cyto- and -2. Immunofluorescence staining localized claudin-1 to cell plasmic connectivity and tight junctions (TJs) for paracellular membranes in IL-1-treated astrocytes, whereas freeze- and/or cell polarity barriers. The integral membrane proteins of fracture replicas showed strand-like arrays of intramembranous gap junctions are connexins, whereas TJs are a complex be- particles in treated cells resembling rudimentary TJ assemblies. tween occludin and members of a recently characterized mul- We conclude that in human astrocytes, IL-1 regulates expres- tigene family, the claudins. In normal brain, astrocytes are sion of the claudin multigene family and that gap and tight coupled by gap junctions composed primarily of connexin43 junction proteins are inversely regulated by this proinflamma- (Cx43), whereas TJs have not been detected in these cells. We tory cytokine. We suggest that in pathological conditions of the now show that treatment of primary human astrocytes with the human CNS, elevated IL-1 expression fundamentally alters cytokine interleukin-1 (IL-1) causes rapid induction of astrocyte-to-astrocyte connectivity. claudin-1, with an expression pattern reciprocal to loss of Cx43. -

Occludin Is Required for Cytokine-Induced Regulation of Tight Junction Barriers
2844 Research Article Occludin is required for cytokine-induced regulation of tight junction barriers Christina M. Van Itallie1,*, Alan S. Fanning2, Jennifer Holmes2 and James M. Anderson2 1Department of Medicine and 2Department of Cell and Molecular Physiology, University of North Carolina, Chapel Hill, NC 27599, USA *Author for correspondence ([email protected]) Accepted 10 May 2010 Journal of Cell Science 123, 2844-2852 © 2010. Published by The Company of Biologists Ltd doi:10.1242/jcs.065581 Summary The function of occludin remains elusive. Proposed roles include maintenance of tight junction barriers, signaling and junction remodeling. To investigate a potential role in mediating cytokine-induced changes in barrier properties, we measured barrier responses to interferon- plus TNF in control, occludin-overexpressing and occludin knockdown MDCK II monolayers. MDCK cells show a complex response to cytokines characterized by a simultaneous increase in the transepithelial electrical resistance and a decrease in the barrier for large solutes. We observed that overexpression of occludin increased and occludin knockdown decreased sensitivity to cytokines as assessed by both these parameters. It is known that caveolin-1 interacts with occludin and is implicated in several models of cytokine-dependent barrier disruption; we found that occludin knockdown altered the subcellular distribution of caveolin-1 and that partitioning of caveolin into detergent-insoluble lipid rafts was influenced by changing occludin levels. Knockdown of caveolin decreased the cytokine-induced flux increase, whereas the increase in the electrical barrier was unaltered; the effect of double knockdown of occludin and caveolin was similar to that of occludin single knockdown, consistent with the possibility that they function in the same pathway. -

ATP Depletion Increases Tyrosine Phosphorylation of -Catenin and Plakoglobin in Renal Tubular Cells
J Am Soc Nephrol 10: 2297–2305, 1999 ATP Depletion Increases Tyrosine Phosphorylation of b-Catenin and Plakoglobin in Renal Tubular Cells JOHN H. SCHWARTZ, THEODORA SHIH, SARAH A. MENZA, and WILFRED LIEBERTHAL Evans Department of Clinical Research, Department of Medicine, Renal Division, Boston Medical Center, Boston, Massachusetts. Abstract. This study examines the hypothesis that the loss of ameliorates the fall in transepithelial resistance induced by integrity of the junctional complex induced by ATP depletion ATP depletion. Also, using immunofluorescence microscopy it is related to alterations in tyrosine phosphorylation of the was demonstrated that ATP depletion results in a marked adherens junction proteins b-catenin and plakoglobin. ATP diminution of E-cadherin staining in the basolateral membrane depletion of cultured mouse proximal tubular (MPT) cells of MPT cells. Vanadate mimics this effect of ATP depletion, induces a marked increase in tyrosine phosphorylation of both whereas genistein ameliorates the reduction in the intensity of b-catenin and plakoglobin. The tyrosine phosphatase inhibitor E-cadherin staining induced by ATP depletion. Because it is vanadate has the same effect in ATP-replete (control) mono- has been well established that hyperphosphorylation of the layers, whereas genistein, a tyrosine kinase inhibitor, reduces catenins leads to dissociation of the adherens junction and to phosphorylation of both proteins in ATP-replete monolayers dysfunction of the junctional complex, it is proposed that the and prevents the hyperphosphorylation of these proteins with increase in tyrosine phosphorylation of catenins observed in ATP depletion. This study also demonstrates that the fall in the MPT cells during ATP depletion contributes to the loss of transepithelial resistance of MPT monolayers induced by ATP function of the junctional complex associated with sublethal depletion can be reproduced by treatment of ATP-replete injury.