Tesis. D. Zamora
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
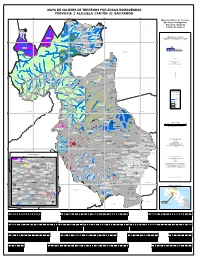
5Bcf43a74d065 202 Zonashom
MAPA DE VALORES DE TERRENOS POR ZONAS HOMOGÉNEAS PROVINCIA 2 ALAJUELA CANTÓN 02 SAN RAMÓN 420000 430000 440000 450000 A La Fo rtu Finca Educativa Don Juanna Mapa de Valores de Terrenos El Jauuri Finca Ofelia o r Q r u u nm eb por Zonas Homogéneas B r ad o 2 02 13 R17/U17 a í P R i ed ra Cerro Blanco 2 02 13 U19 Empacadora Santa Fe 2 02 13 R04/U04ænm Provincia 2 Alajuela Volcano Gold 2 02 13 R18/U18 Cabinas Taboo nmæ 2 02 13 R06/U06 Caserío El Banco a rit ed Pi a Cantón 02 Alajuela ad ao Plaza br ac Canopy El Desafío e C Qu da ænm ra eb Qu a Concepción gu rrito ha Bu c Río ha Plaza C Castillo Nuevo Cerro Chato 2 02 13nmæ R05/U05 ío Ebaisnmæ R 2 02 nm13æ U03 s a c n a 2 02 13 R15/U15 l B Cementerio tinas Cris ebrada s Q Qu a u Q ñ e u æ e b a nm e P r n b a o u r Caserío Cerro Alegre Cairo 2 02 13 R07/U07 í d t a r a d æ R o a nm D F F a lo o n í r s e 2 02 13 R02/U02 t a R s j a o R Urb. La Cruz lle 2 02 13 U26 Q a u C e Linda Vista Ministerio de Hacienda b 2 02 13 R21/U21 ra d a 2 02 13 R16 Villa Vila æ P hachagüita a Quebrada C nm j nmColono a Finca La Bonanza Órgano de Normalización Técnica nm 2 02 13 R01/U01æ 2 02 13 U20 Q ue Cerro Los Perdidos br ad a 2 02 13 R08/U08 Gr æ an Hotel Bosques 2 02 13 R22/U22 de nm 2 02 13 R25/U25 1150000 Tilarán 1150000 ænm Hotel Chachagua Rain Forest Quintas La Pradera Coco Loco Canal 2 02 13 U09 Planta Hidroeléctrica Peñas Blancas 2 02 13 R14 Texas AyM University Plaza 2 02 13 R24/U24 nm 2 02 13 U11 Fila Delio Herrea ænm Cruz Roja Finca Cocoritos Plantel del ICE 2 02 13 U23 PEÑAS BLANCAS æ R ío C San Carlos a R 2 02 13 R10/U10 ñ ío o A 2 02 13 R12/U12 nm s N gu a o e l G l g a i r ta Ca La Altura o lle b Ra a d J io C o ima í nm R Q Q u e A ls u e a b L e b m E a b r T r a i a d g r d a a a S P a a l v i t a r s l a a l n Zona de Protección a C Aprobado por: Poco Sol Qu eb ra San Miguel A Florencia da T ar gu Pueblo Nuevo as al 2 02 14 R12/U12 nmæ Ing. -

Nombre Del Comercio Provincia Distrito Dirección Horario
Nombre del Provincia Distrito Dirección Horario comercio Almacén Agrícola Alajuela Aguas Claras Alajuela, Upala Aguas Claras, Cruce Del L-S 7:00am a 6:00 pm Aguas Claras Higuerón Camino A Rio Negro Comercial El Globo Alajuela Aguas Claras Alajuela, Upala Aguas Claras, contiguo L - S de 8:00 a.m. a 8:00 al Banco Nacional p.m. Librería Fox Alajuela Aguas Claras Alajuela, Upala Aguas Claras, frente al L - D de 7:00 a.m. a 8:00 Liceo Aguas Claras p.m. Librería Valverde Alajuela Aguas Claras Alajuela, Upala, Aguas Claras, 500 norte L-D de 7:00 am-8:30 pm de la Escuela Porfirio Ruiz Navarro Minisúper Asecabri Alajuela Aguas Claras Alajuela, Upala Aguas Claras, Las Brisas L - S de 7:00 a.m. a 6:00 400mts este del templo católico p.m. Minisúper Los Alajuela Aguas Claras Alajuela, Upala, Aguas Claras, Cuatro L-D de 6 am-8 pm Amigos Bocas diagonal a la Escuela Puro Verde Alajuela Aguas Claras Alajuela, Upala Aguas Claras, Porvenir L - D de 7:00 a.m. a 8:00 Supermercado 100mts sur del liceo rural El Porvenir p.m. (Upala) Súper Coco Alajuela Aguas Claras Alajuela, Upala, Aguas Claras, 300 mts L - S de 7:00 a.m. a 7:00 norte del Bar Atlántico p.m. MINISUPER RIO Alajuela AGUAS ALAJUELA, UPALA , AGUAS CLARAS, L-S DE 7:00AM A 5:00 PM NIÑO CLARAS CUATRO BOCAS 200M ESTE EL LICEO Abastecedor El Alajuela Aguas Zarcas Alajuela, Aguas Zarcas, 25mts norte del L - D de 8:00 a.m. -

Estado De Rutas
Sábado 14 de octubre, 2017 Estado de rutas Se han presentado 539 daños en diferentes puntos de 121 rutas 466 daños han sido en carreteras, 47 en puentes y 26 en alcantarillas 340 puntos que presentaron daño ya fueron habilitados 161 puntos se mantienen con paso regulado 38 puntos con paso cerrado *Es importante aclarar que aunque hay rutas que se muestran cerradas, han sido habilitados pasos alternos por vías cantonales, por lo que los pasos cerrados son 11 en total. Rutas cerradas Ruta Provincia Distrito Localidad Daño Tipo de daño Estado 1 Alajuela Jesús María Hundimiento Agrietamiento calzada Cerrado 620 Puntarenas Santa Elena Reserva Monteverde Derrumbe Derrumbes y árboles en calzada de Cerrado rodamiento 1 Ruta Provincia Distrito Localidad Daño Tipo de daño Estado 608 Puntarenas Corredores Toda La Ruta Otro Destrucción de la ruta en manejo de Cerrado aguas, terraplenado y superficie de ruedo. 926 Guanacaste Talarán La Torre Deslizamiento Deslizamiento de 35 metros de Cerrado carretera 145 Guanacaste Quebrada Pueblo Nuevo Deslizamiento Deslizamiento total de la vía tramo de Cerrado Grande 15 metros 606 Guanacaste Talarán La Esperanza Deslizamiento Caída de calzada Cerrado 707 Alajuela Escobal Rio Grande Deslizamiento Deslizamiento de un carril de la Cerrado carretera, tramo de lastre 2 Ruta Provincia Distrito Localidad Daño Tipo de daño Estado 625 Puntarenas Pilas Pilas Derrumbe Derrumbes en la vía Cerrado 2 Puntarenas Potrero El Brujo Derrumbe Derrumbes en la vía Cerrado Grande 2 Puntarenas Boruca Palmar Norte Derrumbe Cerrado Derrumbes en la vía e inestabilidad de taludes muy altos 2 Puntarenas Boruca Palmar Norte Socavación Rio socavó la carretera y cortó el paso Cerrado 3 Ruta Provincia Distrito Localidad Daño Tipo de daño Estado 2 Puntarenas Potrero El Brujo Socavación Rio socavó la carretera y cortó el paso Cerrado Grande 939 Guanacaste 10 Conventillos Pegaderos y Pegaderos y huecos en la vía. -

Aphids (Hemiptera, Aphididae)
A peer-reviewed open-access journal BioRisk 4(1): 435–474 (2010) Aphids (Hemiptera, Aphididae). Chapter 9.2 435 doi: 10.3897/biorisk.4.57 RESEARCH ARTICLE BioRisk www.pensoftonline.net/biorisk Aphids (Hemiptera, Aphididae) Chapter 9.2 Armelle Cœur d’acier1, Nicolas Pérez Hidalgo2, Olivera Petrović-Obradović3 1 INRA, UMR CBGP (INRA / IRD / Cirad / Montpellier SupAgro), Campus International de Baillarguet, CS 30016, F-34988 Montferrier-sur-Lez, France 2 Universidad de León, Facultad de Ciencias Biológicas y Ambientales, Universidad de León, 24071 – León, Spain 3 University of Belgrade, Faculty of Agriculture, Nemanjina 6, SER-11000, Belgrade, Serbia Corresponding authors: Armelle Cœur d’acier ([email protected]), Nicolas Pérez Hidalgo (nperh@unile- on.es), Olivera Petrović-Obradović ([email protected]) Academic editor: David Roy | Received 1 March 2010 | Accepted 24 May 2010 | Published 6 July 2010 Citation: Cœur d’acier A (2010) Aphids (Hemiptera, Aphididae). Chapter 9.2. In: Roques A et al. (Eds) Alien terrestrial arthropods of Europe. BioRisk 4(1): 435–474. doi: 10.3897/biorisk.4.57 Abstract Our study aimed at providing a comprehensive list of Aphididae alien to Europe. A total of 98 species originating from other continents have established so far in Europe, to which we add 4 cosmopolitan spe- cies of uncertain origin (cryptogenic). Th e 102 alien species of Aphididae established in Europe belong to 12 diff erent subfamilies, fi ve of them contributing by more than 5 species to the alien fauna. Most alien aphids originate from temperate regions of the world. Th ere was no signifi cant variation in the geographic origin of the alien aphids over time. -

Dissecting Genome Reduction and Trait Loss in Insect Endosymbionts
Ann. N.Y. Acad. Sci. ISSN 0077-8923 ANNALS OF THE NEW YORK ACADEMY OF SCIENCES Issue: The Year in Evolutionary Biology REVIEW ARTICLE Dissecting genome reduction and trait loss in insect endosymbionts Amparo Latorre1,2 and Alejandro Manzano-Mar´ın1 1Institut Cavanilles de Biodiversitat I Biologia Evolutiva, Universitat de Valencia, C/Catedratico´ JoseBeltr´ an,´ Paterna, Valencia, Spain. 2Area´ de Genomica´ y Salud de la Fundacion´ para el fomento de la Investigacion´ Sanitaria y Biomedicadela´ Comunitat Valenciana (FISABIO)-Salud Publica,´ Valencia,` Spain Address for correspondence: Amparo Latorre, Institut Cavanilles de Biodiversitat i Biologia Evolutiva, Universitat de Valencia, C/Catedratico´ JoseBeltr´ an´ 2, 46071 Paterna, Valencia, Spain. [email protected] Symbiosis has played a major role in eukaryotic evolution beyond the origin of the eukaryotic cell. Thus, organisms across the tree of life are associated with diverse microbial partners, conferring to the host new adaptive traits that enable it to explore new niches. This is the case for insects thriving on unbalanced diets, which harbor mutualistic intracellular microorganisms, mostly bacteria that supply them with the required nutrients. As a consequence of the lifestyle change, from free-living to host-associated mutualist, a bacterium undergoes many structural and metabolic changes, of which genome shrinkage is the most dramatic. The trend toward genome size reduction in endosymbiotic bacteria is associated with large-scale gene loss, reflecting the lack of an effective selection mechanism to maintain genes that are rendered superfluous by the constant and rich environment provided by the host. This genome- reduction syndrome is so strong that it has generated the smallest bacterial genomes found to date, whose gene contents are so limited that their status as cellular entities is questionable. -

Código Presupuestario Centro Educativo Dirección
CÓDIGO CENTRO EDUCATIVO DIRECCIÓN REGIONAL CIRCUITO PRESUPUESTARIO 1247 PATRIARCA SAN JOSÉ OCCIDENTE 01 1261 PATA DE GALLO OCCIDENTE 01 1262 ABRAHAM PANIAGUA NÚÑEZ OCCIDENTE 01 1292 GEORGINA BOLMARCICH DE ORLICH OCCIDENTE 01 1297 JORGE WASHINGTON OCCIDENTE 01 1298 J.N. FELICITAS RAMÍREZ VEGA OCCIDENTE 01 1316 JOSÉ JOAQUÍN SALAS PÉREZ OCCIDENTE 01 1320 LLANO BRENES OCCIDENTE 01 1327 MACARIO VALVERDE MADRIGAL OCCIDENTE 01 1333 LA UNIÓN OCCIDENTE 01 1335 MONSEÑOR CLODOVEO HIDALGO SOLANO OCCIDENTE 01 1350 RINCÓN DE MORA OCCIDENTE 01 1352 RÍO GRANDE OCCIDENTE 01 1355 MIXTA SAN RAFAEL OCCIDENTE 01 1369 LABORATORIO OCCIDENTE 01 1371 RINCÓN DE OROZCO OCCIDENTE 01 4033 INSTITUTO JULIO ACOSTA GARCÍA OCCIDENTE 01 4037 LICEO PATRIARCA SAN JOSÉ OCCIDENTE 01 ENSEÑANZA ESPECIAL Y REHABILITACION DE SAN 4495 OCCIDENTE 01 RAMÓN 4849 NOCTURNO JULIAN VOLIO LLORENTE OCCIDENTE 01 5643 J.N. JOSÉ JOAQUÍN SALAS PÉREZ OCCIDENTE 01 5996 EXPERIMENTAL BILINGÜE DE SAN RAMON OCCIDENTE 01 6250 CNV. ESCUELA JORGE WASHINGTON OCCIDENTE 01 6535 C.T.P. CALLE ZAMORA OCCIDENTE 01 6535 SECCION NOCTURNA C.T.P. CALLE ZAMORA OCCIDENTE 01 1242 ALBERTO MANUEL BRENES MORA OCCIDENTE 02 1252 ÁNGELES NORTE OCCIDENTE 02 1253 FÉLIX ÁNGEL SALAS CABEZAS OCCIDENTE 02 1281 LOS JARDINES OCCIDENTE 02 1282 LOS LAGOS OCCIDENTE 02 1289 FEDERICO SALAS CARVAJAL OCCIDENTE 02 1291 FRANCISCO JOSE ORLICH BOLMARCICH OCCIDENTE 02 1304 LA BALSA OCCIDENTE 02 1308 JULIÁN VOLIO LLORENTE OCCIDENTE 02 1312 LA PAZ OCCIDENTE 02 1318 LISÍMACO CHAVARRÍA PALMA OCCIDENTE 02 1330 MANUEL QUESADA BASTOS OCCIDENTE 02 1331 MERCEDES QUESADA QUESADA OCCIDENTE 02 1337 NAUTILIO ACOSTA PIEPPER OCCIDENTE 02 1338 RUPERTO ZUÑIGA SANCHO OCCIDENTE 02 1343 JUAN JOSÉ VALVERDE MADRIGAL OCCIDENTE 02 1361 SIMÓN BOLÍVAR OCCIDENTE 02 4032 LICEO NUESTRA SEÑORA DE LOS ANGELES OCCIDENTE 02 5548 DULCE NOMBRE OCCIDENTE 02 5808 J.N. -

Oficina Subregional De Grecia
Instituto de Desarrollo Rural de Costa Rica Oficina Subregional de Grecia Informe de Caracterización Básica Territorio Atenas-Palmares-Naranjo-San Ramón-Zarcero Costa Rica, 2016 Tabla de contenidos Lista de Cuadros ................................................................................................................................... i Lista de Ilustraciones ...........................................................................................................................iii Lista de Gráficos ................................................................................................................................. iv Glosario de acrónimos y siglas............................................................................................................ v Resumen .............................................................................................................................................. vi Introducción ........................................................................................................................................ 1 1. Contexto de los territorios Inder .................................................................................................. 5 1.1. Los Territorios Rurales ............................................................................................... 5 1.2. Caracterización del área de trabajo ........................................................................... 8 2. Objetivos .................................................................................................................................. -

6 VARIATION in the OBLIGATE SYMBIONTS of APHIDS by Kevin
Variation in the Obligate Symbionts of Aphids Item Type text; Electronic Dissertation Authors Vogel, Kevin Publisher The University of Arizona. Rights Copyright © is held by the author. Digital access to this material is made possible by the University Libraries, University of Arizona. Further transmission, reproduction or presentation (such as public display or performance) of protected items is prohibited except with permission of the author. Download date 24/09/2021 13:19:10 Link to Item http://hdl.handle.net/10150/222898 6 VARIATION IN THE OBLIGATE SYMBIONTS OF APHIDS by Kevin J. Vogel ________________________ A Dissertation Submitted to the Faculty of the DEPARTMENT OF ECOLOGY AND EVOLUTIONARY BIOLOGY In Partial Fulfillment of the Requirements For the Degree of DOCTOR OF PHILOSOPHY In the Graduate College THE UNIVERSITY OF ARIZONA 2012 2 THE UNIVERSITY OF ARIZONA GRADUATE COLLEGE As members of the Dissertation Committee, we certify that we have read the dissertation prepared by Kevin J. Vogel entitled VARIATION IN THE OBLIGATE SYMBIONTS OF APHIDS and recommend that it be accepted as fulfilling the dissertation requirement for the Degree of Doctor of Philosophy _______________________________________________________________________ Date: 3-9-2012 Nancy A. Moran _______________________________________________________________________ Date: 3-9-2012 Michael W. Nachman _______________________________________________________________________ Date: 3-9-2012 Jeremiah D. Hackett _______________________________________________________________________ Date: 3-9-2012 Noah K. Whiteman Final approval and acceptance of this dissertation is contingent upon the candidate’s submission of the final copies of the dissertation to the Graduate College. I hereby certify that I have read this dissertation prepared under my direction and recommend that it be accepted as fulfilling the dissertation requirement. -

Aphids (Hemiptera, Aphididae) Armelle Coeur D’Acier, Nicolas Pérez Hidalgo, Olivera Petrovic-Obradovic
Aphids (Hemiptera, Aphididae) Armelle Coeur d’Acier, Nicolas Pérez Hidalgo, Olivera Petrovic-Obradovic To cite this version: Armelle Coeur d’Acier, Nicolas Pérez Hidalgo, Olivera Petrovic-Obradovic. Aphids (Hemiptera, Aphi- didae). Alien terrestrial arthropods of Europe, 4, Pensoft Publishers, 2010, BioRisk, 978-954-642-554- 6. 10.3897/biorisk.4.57. hal-02824285 HAL Id: hal-02824285 https://hal.inrae.fr/hal-02824285 Submitted on 6 Jun 2020 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. A peer-reviewed open-access journal BioRisk 4(1): 435–474 (2010) Aphids (Hemiptera, Aphididae). Chapter 9.2 435 doi: 10.3897/biorisk.4.57 RESEARCH ARTICLE BioRisk www.pensoftonline.net/biorisk Aphids (Hemiptera, Aphididae) Chapter 9.2 Armelle Cœur d’acier1, Nicolas Pérez Hidalgo2, Olivera Petrović-Obradović3 1 INRA, UMR CBGP (INRA / IRD / Cirad / Montpellier SupAgro), Campus International de Baillarguet, CS 30016, F-34988 Montferrier-sur-Lez, France 2 Universidad de León, Facultad de Ciencias Biológicas y Ambientales, Universidad de León, 24071 – León, Spain 3 University of Belgrade, Faculty of Agriculture, Nemanjina 6, SER-11000, Belgrade, Serbia Corresponding authors: Armelle Cœur d’acier ([email protected]), Nicolas Pérez Hidalgo (nperh@unile- on.es), Olivera Petrović-Obradović ([email protected]) Academic editor: David Roy | Received 1 March 2010 | Accepted 24 May 2010 | Published 6 July 2010 Citation: Cœur d’acier A (2010) Aphids (Hemiptera, Aphididae). -

Provincia Nombre Provincia Cantón Nombre Cantón Distrito Nombre
Provincia Nombre Provincia Cantón Nombre Cantón Distrito Nombre Distrito Barrio Nombre Barrio 1 San José 1 San José 1 CARMEN 1 Amón 1 San José 1 San José 1 CARMEN 2 Aranjuez 1 San José 1 San José 1 CARMEN 3 California (parte) 1 San José 1 San José 1 CARMEN 4 Carmen 1 San José 1 San José 1 CARMEN 5 Empalme 1 San José 1 San José 1 CARMEN 6 Escalante 1 San José 1 San José 1 CARMEN 7 Otoya. 1 San José 1 San José 2 MERCED 1 Bajos de la Unión 1 San José 1 San José 2 MERCED 2 Claret 1 San José 1 San José 2 MERCED 3 Cocacola 1 San José 1 San José 2 MERCED 4 Iglesias Flores 1 San José 1 San José 2 MERCED 5 Mantica 1 San José 1 San José 2 MERCED 6 México 1 San José 1 San José 2 MERCED 7 Paso de la Vaca 1 San José 1 San José 2 MERCED 8 Pitahaya. 1 San José 1 San José 3 HOSPITAL 1 Almendares 1 San José 1 San José 3 HOSPITAL 2 Ángeles 1 San José 1 San José 3 HOSPITAL 3 Bolívar 1 San José 1 San José 3 HOSPITAL 4 Carit 1 San José 1 San José 3 HOSPITAL 5 Colón (parte) 1 San José 1 San José 3 HOSPITAL 6 Corazón de Jesús 1 San José 1 San José 3 HOSPITAL 7 Cristo Rey 1 San José 1 San José 3 HOSPITAL 8 Cuba 1 San José 1 San José 3 HOSPITAL 9 Dolorosa (parte) 1 San José 1 San José 3 HOSPITAL 10 Merced 1 San José 1 San José 3 HOSPITAL 11 Pacífico (parte) 1 San José 1 San José 3 HOSPITAL 12 Pinos 1 San José 1 San José 3 HOSPITAL 13 Salubridad 1 San José 1 San José 3 HOSPITAL 14 San Bosco 1 San José 1 San José 3 HOSPITAL 15 San Francisco 1 San José 1 San José 3 HOSPITAL 16 Santa Lucía 1 San José 1 San José 3 HOSPITAL 17 Silos. -

Functional and Evolutionary Analysis of the Genome of an Obligate Fungal Symbiont
GBE Functional and Evolutionary Analysis of the Genome of an Obligate Fungal Symbiont Kevin J. Vogel1,3,* and Nancy A. Moran2 1Department of Ecology and Evolutionary Biology, University of Arizona 2Department of Ecology and Evolutionary Biology, Yale University 3Present address: Department of Entomology, University of Georgia, Athens, GA *Corresponding author: E-mail: [email protected]. Accepted: March 29, 2013 Data deposition: This Whole Genome Shotgun project has been deposited at DNA Data Bank of Japan/EMBL/GenBank under the accession AOFP00000000. The version described in this article is the first version, AOFP01000000. Abstract Nutritional symbionts of insects include some of the most bizarre genomes studied to date, with extremely reduced size, biased base composition, and limited metabolic abilities. A monophyletic group of aphids within the subfamily Cerataphidinae have lost the bacterial symbiont common to all other Aphididae (Buchnera aphidicola), which have been replaced by a eukaryotic one, the yeast- like symbiont (YLS). As symbionts are expected to experience reduced effective population size (Ne) and largely clonal life cycles, we used this system as a model to test the hypothesis that chronically high levels of genetic drift will result in an increase in size of a eukaryotic genome. We sequenced the genome of the YLS of the aphid Cerataphis brasiliensis and observed elevated rates of protein sequence evolution and intron proliferation in YLS orthologs relative to those of its closest-sequenced relative, consistent with predictions. A moderate amount of repetitive DNA was found along with evidence of directed mutation to prevent proliferation of repetitive elements. Despite increased intron numbers, the overall genome structure appears not to have undergone massive expansion and is around 25 Mb in size. -

The Hemiptera-Sternorrhyncha (Insecta) of Hong Kong, China—An Annotated Inventory Citing Voucher Specimens and Published Records
Zootaxa 2847: 1–122 (2011) ISSN 1175-5326 (print edition) www.mapress.com/zootaxa/ Monograph ZOOTAXA Copyright © 2011 · Magnolia Press ISSN 1175-5334 (online edition) ZOOTAXA 2847 The Hemiptera-Sternorrhyncha (Insecta) of Hong Kong, China—an annotated inventory citing voucher specimens and published records JON H. MARTIN1 & CLIVE S.K. LAU2 1Corresponding author, Department of Entomology, Natural History Museum, Cromwell Road, London SW7 5BD, U.K., e-mail [email protected] 2 Agriculture, Fisheries and Conservation Department, Cheung Sha Wan Road Government Offices, 303 Cheung Sha Wan Road, Kowloon, Hong Kong, e-mail [email protected] Magnolia Press Auckland, New Zealand Accepted by C. Hodgson: 17 Jan 2011; published: 29 Apr. 2011 JON H. MARTIN & CLIVE S.K. LAU The Hemiptera-Sternorrhyncha (Insecta) of Hong Kong, China—an annotated inventory citing voucher specimens and published records (Zootaxa 2847) 122 pp.; 30 cm. 29 Apr. 2011 ISBN 978-1-86977-705-0 (paperback) ISBN 978-1-86977-706-7 (Online edition) FIRST PUBLISHED IN 2011 BY Magnolia Press P.O. Box 41-383 Auckland 1346 New Zealand e-mail: [email protected] http://www.mapress.com/zootaxa/ © 2011 Magnolia Press All rights reserved. No part of this publication may be reproduced, stored, transmitted or disseminated, in any form, or by any means, without prior written permission from the publisher, to whom all requests to reproduce copyright material should be directed in writing. This authorization does not extend to any other kind of copying, by any means, in any form, and for any purpose other than private research use.