M1222018.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Cadastre Des Autorisations TPV Page 1 De
Cadastre des autorisations TPV N° N° DATE DE ORIGINE BENEFICIAIRE AUTORISATIO CATEGORIE SERIE ITINERAIRE POINT DEPART POINT DESTINATION DOSSIER SEANCE CT D'AGREMENT N Casablanca - Beni Mellal et retour par Ben Ahmed - Kouribga - Oued Les Héritiers de feu FATHI Mohamed et FATHI Casablanca Beni Mellal 1 V 161 27/04/2006 Transaction 2 A Zem - Boujad Kasbah Tadla Rabia Boujad Casablanca Lundi : Boujaad - Casablanca 1- Oujda - Ahfir - Berkane - Saf Saf - Mellilia Mellilia 2- Oujda - Les Mines de Sidi Sidi Boubker 13 V Les Héritiers de feu MOUMEN Hadj Hmida 902 18/09/2003 Succession 2 A Oujda Boubker Saidia 3- Oujda La plage de Saidia Nador 4- Oujda - Nador 19 V MM. EL IDRISSI Omar et Driss 868 06/07/2005 Transaction 2 et 3 B Casablanca - Souks Casablanca 23 V M. EL HADAD Brahim Ben Mohamed 517 03/07/1974 Succession 2 et 3 A Safi - Souks Safi Mme. Khaddouj Bent Salah 2/24, SALEK Mina 26 V 8/24, et SALEK Jamal Eddine 2/24, EL 55 08/06/1983 Transaction 2 A Casablanca - Settat Casablanca Settat MOUTTAKI Bouchaib et Mustapha 12/24 29 V MM. Les Héritiers de feu EL KAICH Abdelkrim 173 16/02/1988 Succession 3 A Casablanca - Souks Casablanca Fès - Meknès Meknès - Mernissa Meknès - Ghafsai Aouicha Bent Mohamed - LAMBRABET née Fès 30 V 219 27/07/1995 Attribution 2 A Meknès - Sefrou Meknès LABBACI Fatiha et LABBACI Yamina Meknès Meknès - Taza Meknès - Tétouan Meknès - Oujda 31 V M. EL HILALI Abdelahak Ben Mohamed 136 19/09/1972 Attribution A Casablanca - Souks Casablanca 31 V M. -

MPLS VPN Service
MPLS VPN Service PCCW Global’s MPLS VPN Service provides reliable and secure access to your network from anywhere in the world. This technology-independent solution enables you to handle a multitude of tasks ranging from mission-critical Enterprise Resource Planning (ERP), Customer Relationship Management (CRM), quality videoconferencing and Voice-over-IP (VoIP) to convenient email and web-based applications while addressing traditional network problems relating to speed, scalability, Quality of Service (QoS) management and traffic engineering. MPLS VPN enables routers to tag and forward incoming packets based on their class of service specification and allows you to run voice communications, video, and IT applications separately via a single connection and create faster and smoother pathways by simplifying traffic flow. Independent of other VPNs, your network enjoys a level of security equivalent to that provided by frame relay and ATM. Network diagram Database Customer Portal 24/7 online customer portal CE Router Voice Voice Regional LAN Headquarters Headquarters Data LAN Data LAN Country A LAN Country B PE CE Customer Router Service Portal PE Router Router • Router report IPSec • Traffic report Backup • QoS report PCCW Global • Application report MPLS Core Network Internet IPSec MPLS Gateway Partner Network PE Router CE Remote Router Site Access PE Router Voice CE Voice LAN Router Branch Office CE Data Branch Router Office LAN Country D Data LAN Country C Key benefits to your business n A fully-scalable solution requiring minimal investment -

زمور- زعير Annuaire Statistique Regional Rabat- Sale- Zemmour-Zaer
المملكة المغربية ROYAUME DU MAROC المندوبية السامية للتخطيط HAUT-COMMISSARIAT AU PLAN المديرية الجهوية بالرباط DIRECTION REGIONALE A RABAT النشرة اﻹحصائية السنوية 2009 جهة الرباط- سﻻ- زمور- زعير ANNUAIRE STATISTIQUE REGIONAL RABAT- SALE- ZEMMOUR-ZAER الفهرس Sommaire مقدمة Introduction 3 الفصل 1 : التنظيم اﻹداري Chapitre 1: Organisation administrative 7-5 الفصل 2 : السكان Chapitre 2: Population 17-9 الفصل 3 : المناخ Chapitre 3: Climatologie 21-19 الفصل 4 : الفﻻحة ، الغابات و الصيد البحري Chapitre 4: Agriculture, Forêts et Pêche 34-23 الفصل 5 : الطاقة و المياه Chapitre 5: Energie et Eau 44-36 الفصل 6 : التجارة و الصناعة Chapitre 6: Commerce et Industrie 54-46 الفصل 7 : الصناعة التقليدية Chapitre 7: Artisanat 61-56 الفصل 8 : البناء و العقار Chapitre 8: Construction et foncier 68-63 الفصل 9 : النقل Chapitre 9: Transport 74-70 الفصل 10 : السياحة Chapitre 10: Tourisme 86-76 Enseignement et formation الفصل 11 : التعليم و تكوين اﻷطر Chapitre 11: 108-88 des cadres الفصل 12 : التكوين المهني Chapitre 12: Formation professionnelle 112-110 الفصل 13 : الصحة Chapitre 13: Santé 124-114 الفصل 14 : التشغيل Chapitre 14: Emploi 128-126 الفصل 15 : العدل Chapitre 15: Justice 134-130 Jeunesse, Sport, Culture et الفصل 16 : الشبيبة، الرياضة، الثقافة و الترفيه Chapitre 16: 140-136 Loisirs الفصل 17 : التعاون الوطني Chapitre 17: Entraide nationale 147-142 الفصل 18 : البيئة Chapitre 18: Environnement 151-149 الفصل 19 : اﻹستثمارات Chapitre 19: Investissements 158-153 الفصل 20 : اﻷثمان Chapitre 20: Prix 162-160 الفصل 21 : اﻷبناك Chapitre 21: Banques 166-163 مقدمة INTRODUCTION Une vision intégrée et planifiée du لتحقٌق رؤٌة مندمجة و تخطٌط تنموي، جهوي و محلً، ﻻ développement régional et local ne peut بد من التوفر على نظام للمعلومات اﻹحصائٌة الجهوٌة. -

Royaume Du Maroc Cour Des Comptes Evaluation De L'execution Des
ROYAUME DU MAROC COUR DES COMPTES EVALUATION DE L’EXECUTION DES CONTRATS DE GESTION DELEGUEE DES SERVICES DE COLLECTE DES DECHETS MENAGERS ET ASSIMILES, ET DE NETTOIEMENT AU NIVEAU DE LA REGION DE RABAT-SALE-KENITRA Septembre 2020 Evaluation de l’exécution des contrats de gestion déléguée des services de collecte des déchets ménagers et assimilés, et de nettoiement au niveau de la région de Rabat-Salé-Kénitra Délibéré Conformément aux dispositions de la loi n°62.99 formant code des juridictions financières telle que modifiée et complétée ; Suite à la mission d’évaluation de l’exécution des contrats de gestion déléguée des services de collecte des déchets ménagers et assimilés et de nettoiement au niveau de la région de Rabat- Salé-Kénitra réalisée, par l’équipe composée de M. Tarik AMHOUD, premier conseiller, rapporteur, Mme. Noha KEBDANI et Mme. Noura FILALI, conseillères ; Sur la base du rapport particulier, relatif à ladite mission, délibéré par la formation présidée par M. Abdelhafid BENTAHAR, président de la Cour régionale des comptes de la région de Rabat- Salé-Kénitra, et composée de M. Moussa HANAN et M. Mohamed Abdelmouhcine HANINE, conseillers maîtres, Mme Fatiha BENTISS, première conseillère ainsi que M. Tarik AMHOUD, premier conseiller, rapporteur ; Et après avoir communiqué le rapport particulier de la mission, pour commentaires, à M. le Ministre de l’Intérieur, M. le Ministre de l'Economie, des Finances et de la Réforme de l’Administration, M. le Wali de la région de Rabat-Salé-Kénitra et M. le Trésorier régional de la région de Rabat-Salé-Kénitra en date du 06 juillet 2020 ; Le présent rapport a été préparé pour la publication par le Comité des programmes et des rapports de la Cour des comptes et délibéré à cette fin par la formation composée de : - M. -

Moroccan Aerospace Industry the Most Competitive Base at the Gate of Europe , a Success Story the Chairman S Word
MOROCCAN AEROSPACE INDUSTRY THE MOST COMPETITIVE BASE AT THE GATE OF EUROPE , A SUCCESS STORY THE CHAIRMAN S WORD Hamid Benbrahim El-Andaloussi GIMAS Chairman The history of Moroccan Aerospace industry dates back to the 1950’s with ex- Among the main reasons that position Morocco among the most competitive aerospace industries is pertise being developed in the feld of aircraft maintenance for civil and military the proximity to Europe, only 14 Kms from Spain, which in logistic terms means 2 days by truck from aviation. In 1951, today Airbus created Maroc Aviation subsidiary, operating at this Casablanca to Toulouse and only one day to Spain, 2-3 hours by fight to major capitals in Europe with time in the military business with Morocco, and became in 1993 a Sogerma plant a well-developed air hub in Med V International Airport of Casablanca. The political stability of this 4 centuries-old monarchy and the history that links Morocco to Europe, along with its demography developing new activities in the manufacturing of seats, harnesses and metallic as- composed in majority of youth, are other factors that motivate the investor’s decision. sembly of parts. The creation of Royal Air Maroc in 1957, considered today among the major regional airline companies in Africa, has fostered the trend of developing In the mid 2000’s, regarding the potential Morocco represents for investors in the industrial feld, the MRO capabilities for its own feet. In 1999, Royal Air Maroc and Snecma Safran Government launched the National Pact for Industrial Emergence, erecting aerospace industry among Group create a Joint Venture – SMES - for engine maintenance and repair, which the “Global Industries” to develop along with the automotive, electronic, and IPO/BPO sectors. -

Cahier Des Prescriptions Spéciales
ROYAUME DU MAROC ** MINISTÈRE DU TOURISME, DE L’ARTISANAT,DU TRANSPORT AÉRIEN ET DE L’ECONOMIE SOCIALE APPEL D’OFFRES OUVERT SUR OFFRES DE PRIX (SEANCE PUBLIQUE) N° 03/MOURAFAKA/2020 DU 27/10/2020 A 10H30 RELATIF A LA REALISATION DE L’ACCOMPAGNEMENT DES COOPERATIVES BENEFICIAIRES DU PROGRAMME MOURAFAKA D’APPUI POST CREATION DES COOPERATIVES (3ème Tranche), en 15 lots : - Lot n° 1 : Provinces et préfectures de : Oujda Angad, Jerada, Berkane, Figuig, Nador, Taourirt et Driouch, - Lot n° 2 : Provinces et préfectures de : El houceima, Guercif, Taounate et Taza - Lot n° 3 : Provinces et préfectures de : Casablanca, Mediouna, Nouasseur et Mohammedia, - Lot n° 4 : Provinces et préfectures de : Safi, Eljadida, Sidi Bennour et Youssoufia - Lot n° 5 : Provinces et préfectures de : Beni Mellal, Azilal et Fquih ben saleh, - Lot n° 6 : Provinces et préfectures de : Marrakech, Chichaoua, Al Haouz, El Kelaa des Sraghna, Essaouira et Rehmna - Lot n° 7 : Provinces et préfectures de : Laayoune, Boujdour et Tarfaya - Lot n° 8 : Provinces et préfectures de : Oueserd et Dakhla - Lot n° 9 : Provinces et préfectures de : Guelmim, Tan Tan et Es-Semara et Assa Zag - Lot n° 10 : Provinces et préfectures de : Settat, Ben Slimane et Khouribga - Lot n° 11 : Provinces et préfectures de : Fès, Sefrou, Boulemane et Moulay Yaakoub - Lot n° 12 : Provinces et préfectures de : Meknès, Ifrane, Errachidia, Midelt et khénifra - Lot n° 13 : Provinces et préfectures de : Tanger- Assilah, Tétouan, Chefchaouen, Larache, M’diq et Ouezzane - Lot n° 14 : Provinces et préfectures de : Rabat, salé, Khémisset, Kénitra, Sidi slimane, et Sidi Kacem - Lot n° 15 : Provinces et préfectures de : Agadir Ida-Outanane , Chtouka-Aït Baha, Tiznit, Tinghir, Ouarzazate, Sidi Ifni et Taroudant. -
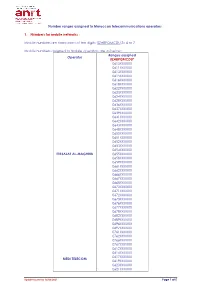
Number Ranges Assigned to Moroccan Telecommunications Operators
Number ranges assigned to Moroccan telecommunications operators 1. Numbers for mobile networks : Mobile numbers are composed of ten digits: 0ZABPQMCDU Z= 6 or 7. Mobile numbers assigned to mobile operators are as below: Ranges assigned Operator 0ZABPQMCDU* 0610XXXXXX 0611XXXXXX 0613XXXXXX 0615XXXXXX 0616XXXXXX 0618XXXXXX 0622XXXXXX 0623XXXXXX 0624XXXXXX 0628XXXXXX 0636XXXXXX 0637XXXXXX 0639XXXXXX 0641XXXXXX 0642XXXXXX 0643XXXXXX 0648XXXXXX 0650XXXXXX 0651XXXXXX 0652XXXXXX 0653XXXXXX 0654XXXXXX ITISSALAT AL-MAGHRIB 0655XXXXXX 0658XXXXXX 0659XXXXXX 0661XXXXXX 0662XXXXXX 0666XXXXXX 0667XXXXXX 0668XXXXXX 0670XXXXXX 0671XXXXXX 0672XXXXXX 0673XXXXXX 0676XXXXXX 0677XXXXXX 0678XXXXXX 0682XXXXXX 0689XXXXXX 0696XXXXXX 0697XXXXXX 0761XXXXXX 0762XXXXXX 0766XXXXXX 0767XXXXXX 0612XXXXXX 0614XXXXXX 0617XXXXXX MEDI TELECOM 0619XXXXXX 0620XXXXXX 0621XXXXXX Update issued on 14/06/2021 Page 1 of 5 0625XXXXXX 0631XXXXXX 0632XXXXXX 0644XXXXXX 0645XXXXXX 0649XXXXXX 0656XXXXXX 0657XXXXXX 0660XXXXXX 0663XXXXXX 0664XXXXXX 0665XXXXXX 0669XXXXXX 0674XXXXXX 0675XXXXXX 0679XXXXXX 0684XXXXXX 0688XXXXXX 0691XXXXXX 0693XXXXXX 0694XXXXXX 0770XXXXXX 0771XXXXXX 0772XXXXXX 0773XXXXXX 0774XXXXXX 0775XXXXXX 0777XXXXXX 0526XXXXXX 0527XXXXXX 0533XXXXXX 0534XXXXXX 0540XXXXXX 0546XXXXXX 0547XXXXXX 0550XXXXXX 0553XXXXXX 060XXXXXXX 0626XXXXXX 0627XXXXXX 0629XXXXXX 0630XXXXXX 0633XXXXXX 0634XXXXXX Wana Corporate 0635XXXXXX 0638XXXXXX 0640XXXXXX 0646XXXXXX 0647XXXXXX 0680XXXXXX 0681XXXXXX 0687XXXXXX 0690XXXXXX 0695XXXXXX 0698XXXXXX 0699XXXXXX 0700XXXXXX 0701XXXXXX 0702XXXXXX 0703XXXXXX -

Sr 1 Barid ADRESSE VILLE Timing BC TEMARA PPAL Angle Hassan II
Sr 1 Barid ADRESSE VILLE Timing 1 BC TEMARA PPAL Angle Hassan II et Av Prince Heritier Sidi Mohamed 12000 TEMARA TEMARA 08:00 - 20:00 2 BC TEMARA MASSIRA Hay El Firdaous Massira I 12002 TEMARA TEMARA 08:00 - 20:00 3 BC CASA HAY HASSANI N°100 Derb El Houria, rue Ibn Al Khattib. Hay Hassani 20200 CASABLANCA CASABLANCA 08:00 - 20:00 4 BC FES PPAL Avenue Hassan II Angle Mohamed V Fès Dar Dbibagh Fès Dar Dbibagh 30000 FES FES 08:00 - 20:00 5 BC FES BENDABABE Place 11 Janvier Jnane Lahrichi 30100 FES FES 08:00 - 20:00 6 BC OUJDA PPAL Bd Mohamed V 60000 OUJDA OUJDA 08:00 - 20:00 7 BC NADOR PPAL Kaid Ahmed Rifi Quartier Administratif 62000 NADOR NADOR 08:00 - 20:00 8 BC BENI MELLAL PPAL Avenue Mohamed V Immeuble de la Poste Beni mellal 23000 Beni Mellal BENI MELLAL 08:00 - 20:00 9 BC CASA OULFA Bd Oum Rabia. Hay El Oulfa Hay El Oulfa 20202 CASABLANCA CASABLANCA 08:00 - 20:00 10 BC TADLA BOUDRAA Avenue 2 Aout 23350 Kasba Tadla KASBAT TADLA 08:00 - 20:00 11 BC CASA MAARIF Angle Bd Bir Anzarane et Rue El Khalil Maarif 20100 CASABLANCA CASABLANCA 08:00 - 20:00 12 BC FKIH BEN SALAH PPAL Bd Mohamed V Quartier Administratif 23200 Fkih Ben Salah FKIH BEN SALEH 08:00 - 20:00 13 BC CASA IBN TACHAFINE Angle boulevard ibn tachfine et rue du capitaine bertrandon CASABLANCA 08:00 - 20:00 14 BC EL JADIDA PPAL Bd Mohamed V Rue William Redman 24000 El Jadida EL JADIDA 08:00 - 20:00 15 BC AGADIR PPAL Boulevard Moulay Abdellah Ville Nouvelle 80001 Agadir AGADIR 08:00 - 20:00 16 BC BENSLIMANE PPAL Bd. -

Etat Aa Requãªte
LISTE DES ETABLISSEMENTS DE LAIT ET PRODUITS LAITIERS AGREES OU AUTORISES Situation au 30/06/2021 1- ETABLISSEMENTS AGREES : ETABLISSEMENTS DE PREPARATION ET DE Nombre : 174 TRANSFORMATION Nom de l'établissement Activités de Numéro ADRESSE PROVINCE DR-ONSSA Etat l'établissement d'agrément AGRO JUICE PROCESSING CONDITIONNEMENT, LPL.13.4.14 LOT NIYA, ROUTE MEKNES Fès - Meknès Agrément TRAITEMENT ET BOUFEKRANE maintenu FABRICATION DES PRODUITS LAITIERS AGROCREAM CONDITIONNEMENT, LPL.5.31.13 LOTISSEMENT AL CASABLANCA Casablanca- Settat Agrément TRAITEMENT ET BATOUL, LOT 44, Z. suspendu FABRICATION DES I. LISSASFA PRODUITS LAITIERS AGROFINI CONDITIONNEMENT, LPL.1.3.13 LOT N°20 Q.I. AMAL RABAT Rabat - Salé- Kénitra Agrément TRAITEMENT ET 6, HAY EL FATH maintenu FABRICATION DES C.Y.M. PRODUITS LAITIERS AGRO-FOOD INDUSTRIE CONDITIONNEMENT, LPL.19.2.13 102, QUARTIER MARRAKECH Marrakech - Safi Agrément TRAITEMENT ET INDUSTRIEL SIDI maintenu FABRICATION DES GHANEM, 40110 PRODUITS LAITIERS AGROWAY CONDITIONNEMENT, LPL.5.133.18 Lotissement El CASABLANCA Casablanca- Settat Agrément TRAITEMENT ET Hamra II, étage 3, maintenu FABRICATION DES rue 3-N°25,lot PRODUITS LAITIERS 48/50-Préfecture Ain chock, Casablanca AHL OUED ZA CONDITIONNEMENT, LPL.47.01.13 ZONE INDUSTRIELLE TAOURIRT L'oriental Agrément TRAITEMENT ET N°170/2 maintenu FABRICATION DES PRODUITS LAITIERS AJBAN DAKHLA CONDITIONNEMENT, LPL.74.2.15 CENTRE DES DAKHLA Guelmim-ouadNoun- Agrément TRAITEMENT ET TRAVAUX 39-09, Laâyoune - Sakia maintenu FABRICATION DES TAWARTA, CR D’EL Hamra et Dakhla- PRODUITS LAITIERS ARGOUB Oued Eddahab AJBANE CHEFCHAOUEN CONDITIONNEMENT, LPL.38.1.13 KM 60 ROUTE CHEFCHAOUEN Tanger – Tétouan – Al Agrément TRAITEMENT ET TETOUAN- Hoceima suspendu FABRICATION DES OUEZZANE, AMLAY, PRODUITS LAITIERS C.R. -

Telecharger Fichier
Tableau de l'Ordre National des Ingénieurs Géomètres Topographes -2019- Région de Rabat-Salé-Kénitra Secteur Privé Nom Prénom Adresse Professionnelle Ville Téléphone GSM Fax Email Angle rue Hamman Fatwaqui et LOUALI Mohamed rue Haj Marzouk Azaoui Lot El Al Hoceima 0539 98 05 81 0661 77 78 59 0539 98 05 81 [email protected] Masnaoui Société de Topographie Moderne topomod2014@gm AZARKAN Farid "TOPO-MOD" Sarl, n°107, Al Hoceima 0539 98 05 06 0659 72 87 12 0539 98 05 06 ail.com avenue M'barek El Bekkay Société "YASSINE TOPO" SARL AU, Lotissement Al Khozama, [email protected] BOUGHABA Yassin Al Hoceima 0539 98 11 81 0613 20 41 41 Imm.14, Appt 5; BP 559, poste m principale, 32000 Société "MESSAOUDI TOPO" Sarl EL , 02 angle rue Homman El messaouditopo@hot Abdelaziz Al Hoceima 0539 80 65 77 0667 33 25 24 MESSAOUDI Fatouaki et rue Haj Marzouk El mail.com Azzouzi Société des Etudes Topographiques, Ingénierie et essaid.bajja@gmail. BAJJA Essaid Conseil " ETOPIC" Sarl au, Al- Asilah 0661 46 74 10 com Zalka rue Hassan Ben Al Mehdi, n°14 Société AL BIRUNI TOPOGRAPHY hamman.abdelilah@ HAMMAN Abdelilah Sarl au, Avenue MACHICHI Chefchaouen 0661 33 67 71 gmail.com quartier administratif Société "SOCIETE EXPERT TOPOGRAPHIE ET GEOMATIQUE" Sarl au, Route [email protected] JOUAN Taoufiq Imzouren 0666 28 97 36 nationale n°2, lotissement m Azzaytoun n°20, Appt 2ème étage ACHEAIBI Abdellatif 12, rue Mamora Imm 54 Kénitra mehdi.akabli@gmail AKEBLI Mehdi 9, rue Ghandi appt n°3 Kénitra 0537 37 21 32 0661 84 23 03 .com 0661 61 49 ASSAIDI Houcine 2 rue la Reine Elisabeth Appt 4 Kénitra 0537 37 17 99 37/0661 61 61 0537 37 17 99 [email protected] 49 BABA [email protected] Haddou 9, rue Ahmed Chaouki bureau 3 Kénitra 0537 36 42 16 0661 25 94 77 0537 36 42 16 HADDOU m belamkissia@yahoo. -

Royaume Du Maroc
اﳌﻤﻠﻜﺔ اﳌﻐﺮﺑﻴﺔ ROYAUME DU MAROC وزارة اﻟﺘﺠﻬﻴﺰ ,MINISTERE DE L’EQUIPEMENT واﻟﻨﻘﻞ واﻟﻠﻮﺟﺴﺘﻴﻚ DU TRANSPORT, DE LA LOGISTIQUE واﳌﺎء ET DE L’EAU BULLETIN DE VIABILITE ROUTIERE DU 18/03/2018 A 18H30 CHUTES DE NEIGE Synthèse des routes coupées et rétablies du 26/02/2018 au 18/03/2018 à 18H30 Routes coupées Routes rétablies Total Routes Nationales 0 2 2 Routes Régionales 0 2 2 Routes Provinciales 0 2 2 Total 0 6 6 CHUTES DE NEIGE SECTION DE ROUTES COUPEES Point Province Route Liaison Observations Kilométrique NEANT SECTION DE ROUTES RETABLIES Point Province Route Liaison Observation Kilométrique Marrakech - Al Haouz RN9 335 - 394 Libre Ouarzazate Ifrane RN13 Azrou - Timehdit 290 - 324 Libre Midelt RN13 Timehdit - Midelt 324 - 363 Libre Boulemane - Boulemane RR503 102 - 146 Libre Boulaajoul Ifrane RR707 Ifrane - Boulemane 32 - 62 Libre El Haouz RP2030 Tchdirt - Imlil 44 Libre Guercif RP5427 Tamjilt - Bouiblane 123 - 146 Libre ﻣﺪﯾﺮﯾﺔ اﻟﻄﺮق/ﺣﻲ اﻟﺮﯾﺎض، اﻟﺮﺑﺎط ﻣﻌﺎھﺪ، ص.ب Direction des Routes/Hay Riyad, Rabat-instituts, B.P 6226 6226 اﻟﮭﺎﺗﻒ : Tél : +212 5 38 00 56 00 +212 5 38 00 56 00 اﻟﻔﺎﻛﺲ : Fax : +212 5 37 71 32 59 /61 +212 5 37 71 32 59 /61 www.equipement.gov.ma اﳌﻤﻠﻜﺔ اﳌﻐﺮﺑﻴﺔ ROYAUME DU MAROC وزارة اﻟﺘﺠﻬﻴﺰ ,MINISTERE DE L’EQUIPEMENT واﻟﻨﻘﻞ واﻟﻠﻮﺟﺴﺘﻴﻚ DU TRANSPORT, DE LA LOGISTIQUE واﳌﺎء ET DE L’EAU CRUES Synthèse des routes coupées et rétablies du 26/02/2018 au 18/03/2018 à 18H30 Routes coupées Routes rétablies Total Routes Nationales 0 3 3 Routes Régionales 0 11 11 Routes Provinciales 1 32 33 Routes non classées 0 1 1 Total 1 47 48 SECTION DE ROUTES COUPEES Point Province Route Liaison Franchissement Obs. -

Royal Jelly ◼ Wax ◼ Apitoxine (Bee Sting) ◼ Bees (Homeopathy) Bee Products – Food Or Medicines
Therapeutic properties of Moroccan bee products Pr Badiaa LYOUSSI University Sidi Mohamed ben Abdallah Fez, Morocco rats Food as Medicine ? Prevention is better than Cure The Primary Law of Healing ″Let thy food be thy medicine‶ Hippocrates ( 460 – 370 BC) Apitherapy – general concepts: The use of beehive products for nutrition, Quality health and quality of life Concentration improvement, prevention Dose / Time and treatment of different pathologies SYNERGY Of the bee products Modern Apitherapy All beehive products have a medical use : ◼ Honey and Comb honey ◼ Pollen and Beebread ◼ Propolis ◼ Royal Jelly ◼ Wax ◼ Apitoxine (bee sting) ◼ Bees (homeopathy) Bee products – food or medicines Product Nutritional value Therapeutic importance Pollen FOOD Medicament Honey FOOD Medicament Royal jelly Food Medicament PROPOLIS None MEDICAMENT Venom None Medicament Some honeys from Morocco Plant Origin Indication Crataegus Ifrane cardiotonic Camomille Gharb antidepressant Siliqua (Carroube) Moyen Atlas astringent Eucalyptus Gharb antiseptic Euphorbes Béni mellal immunity Arbutus unedo Meknes diuretic, hypoglycemic Jujube Khénifra aphrodisiac Lavande Oulmès sedative Capparis spinosa Tifelt weight loss, hypoglycemic Nigelle Gharb allergies Oranger Gharb Sedative Romarin (Azir) Midelt hepatic Sauge Midelt menopause Ruta chalepensis Moyen Atlas Anti inflammatory Thym Sousse Antiseptic Bupleurum (Zandaz) Immouzzer Antidiabetic, Depurative Euphorbia resinifera Region : North Africa Country : Morocco Vernacular name : zaggûm, zaqqûm, zakkûm, banan el-ârd