Control Biológico De Insectos Plagas
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Priscila Jane Romano De Oliveira Gonçalves Caracterização E
Priscila Jane Romano de Oliveira Gonçalves Caracterização e avaliação do papel do gene wcbE de Burkholderia seminalis linhagem TC3.4.2R3 na interação microbiana. Tese apresentada ao Programa de Pós- Graduação em Microbiologia do Instituto de Ciências Biomédicas da Universidade de São Paulo, para obtenção do título de Doutora em Microbiologia. Área de concentração: Microbiologia Orientador: Prof. Dr. Welington Luiz de Araújo Versão original. São Paulo 2017 Priscila Jane Romano de Oliveira Gonçalves Characterization and evaluation of the role of wcbE gene from Burkholderia seminalis strain TC3.4.2R3 in microbial interaction. Thesis presented to the Microbiology Department of Instituto de Ciências Biomédicas from Universidade de São Paulo, as requirement for the degree of Doctor of Philosophy in Microbiology. Concentration area: Microbiology Supervisor: Prof. Dr. Welington Luiz de Araújo Original version. São Paulo 2017 RESUMO GONÇALVES, P. J. R. O. Caracterização e avaliação do papel do gene wcbE de Burkholderia seminalis linhagem TC3.4.2R3 na interação microbiana. 2017. 149 f. Tese (Doutorado em Microbiologia) – Instituto de Ciências Biomédicas, Universidade de São Paulo, São Paulo, 2017. Burkholderia seminalis tem sido encontrada como um micro-organismo não patogênico, promotor de crescimento vegetal, nodulador de raízes, biorremediador, agente de biocontrole e, também, como organismo patogênico em algumas plantas e pacientes com fibrose cística. O gene wcbE codifica uma glicosiltransferase e pertence ao cluster wcb, que está relacionado à síntese de cápsula e interações ambientais. O objetivo deste trabalho foi investigar o papel do gene wcbE e da temperatura nas interações microbianas de B. seminalis TC3.4.2R3. A produção de biofilme, EPS e compostos antifúngicos foi maior a 28 ºC. -
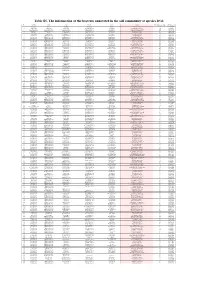
Table S5. the Information of the Bacteria Annotated in the Soil Community at Species Level
Table S5. The information of the bacteria annotated in the soil community at species level No. Phylum Class Order Family Genus Species The number of contigs Abundance(%) 1 Firmicutes Bacilli Bacillales Bacillaceae Bacillus Bacillus cereus 1749 5.145782459 2 Bacteroidetes Cytophagia Cytophagales Hymenobacteraceae Hymenobacter Hymenobacter sedentarius 1538 4.52499338 3 Gemmatimonadetes Gemmatimonadetes Gemmatimonadales Gemmatimonadaceae Gemmatirosa Gemmatirosa kalamazoonesis 1020 3.000970902 4 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas indica 797 2.344876284 5 Firmicutes Bacilli Lactobacillales Streptococcaceae Lactococcus Lactococcus piscium 542 1.594633558 6 Actinobacteria Thermoleophilia Solirubrobacterales Conexibacteraceae Conexibacter Conexibacter woesei 471 1.385742446 7 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas taxi 430 1.265115184 8 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas wittichii 388 1.141545794 9 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas sp. FARSPH 298 0.876754244 10 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sorangium cellulosum 260 0.764953367 11 Proteobacteria Deltaproteobacteria Myxococcales Polyangiaceae Sorangium Sphingomonas sp. Cra20 260 0.764953367 12 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas panacis 252 0.741416341 -

Characterisation of the Type VI Secretion System in Pantoea Ananatis
Characterisation of the type VI secretion system in Pantoea ananatis BY Shyntum Divine Yufetar Submitted in partial fulfilment of the requirements for the degree Doctor of Philosophy In the Faculty of Natural and Agricultural Sciences, Department of Microbiology and Plant Pathology, University of Pretoria, Pretoria, South Africa February 2014 Approved by supervisory committee Teresa A. Coutinho, Ph.D. Lucy N. Moleleki, Ph.D. Stephanus A. Venter, Ph.D. Ian K. Toth, Ph.D. i DECLARATION I declare that the thesis “Characterisation of the type VI secretion system in Pantoea ananatis”, which I hereby submit for the Doctor of Philosophy degree at the University of Pretoria, is my own work and has not previously been submitted by me for a degree at this or any other tertiary institution. SIGNATURE:………………………………………….. DATE:......……….. Shyntum Divine Yufetar i ACKNOWLEDGEMENTS I am deeply grateful to God for having taken me this far in my life. I would want to acknowledge the invaluable supervision of Prof. TA Coutinho, Dr. Lucy Moleleki, Prof. SN Venter and Dr. Ian Toth who guided me professionally. Many thanks also to Prof. Jacques Theron for your invaluable technical assistance, most of all thank you for helping me think outside the box. Many thanks to my siblings and parents for being there for me all these years. Thanks also to Mr John Menjo and his wife Ruth Menjo for providing me an escape from the rigors of academic work during the weekends and holidays. Special thanks to Ms Vimbai Siziba for all her support, you stood by me, listened and supported me through what I consider the hardest part of my PhD studies. -

UNIVERSITY of CALIFORNIA Santa Barbara Delivery and Activity Of
UNIVERSITY OF CALIFORNIA Santa Barbara Delivery and activity of toxic effector domains from contact-dependent growth inhibition systems in Escherichia coli A dissertation submitted in partial satisfaction of the requirements for the degree Doctor of Philosophy in Molecular, Cellular, and Developmental Biology by Julia Laura Elizabeth Willett Committee in charge: Professor Christopher S. Hayes, Chair Professor Anthony de Tomaso Professor David Low Professor Denise Montell June 2016 The dissertation of Julia Laura Elizabeth Willett is approved. _____________________________________________ Anthony de Tomaso _____________________________________________ David Low _____________________________________________ Denise Montell _____________________________________________ Christopher S. Hayes, Committee Chair February 2016 Delivery and activity of toxic effector domains from contact-dependent growth inhibition systems in Escherichia coli Copyright © 2016 by Julia Laura Elizabeth Willett iii To Jason iv ACKNOWLEDGEMENTS I would first and foremost like to thank Chris for being a great advisor and for allowing me to investigate a variety of engrossing research questions throughout my graduate work in his lab. I’m appreciative of all the opportunities that I have had to grow as a scientist and writer, present my research at conferences, and interact with incredible seminar speakers and colleagues. His enthusiasm for science and research is contagious. A number of collaborations made this work possible. I’m extremely grateful for our close (both literally and figuratively) collaboration with David Low and his research group, particularly former members Stephanie Aoki, Sanna Koskiniemi, Travis Smith, and Julia Webb. David is a tremendous scientist with whom scientific conversations are always inspiring. I am also grateful for our collaboration with Robert Morse and Celia Goulding at UC Irvine, as their crystallography expertise has provided invaluable insight into the structural world of CDI. -

Epidemiology and Comparative Analysis of Yersinia in Ireland Author(S) Ringwood, Tamara Publication Date 2013 Original Citation Ringwood, T
UCC Library and UCC researchers have made this item openly available. Please let us know how this has helped you. Thanks! Title Epidemiology and comparative analysis of Yersinia in Ireland Author(s) Ringwood, Tamara Publication date 2013 Original citation Ringwood, T. 2013. Epidemiology and comparative analysis of Yersinia in Ireland. PhD Thesis, University College Cork. Type of publication Doctoral thesis Rights © 2013, Tamara Ringwood http://creativecommons.org/licenses/by-nc-nd/3.0/ Item downloaded http://hdl.handle.net/10468/1294 from Downloaded on 2021-10-07T12:07:10Z Epidemiology and Comparative Analysis of Yersinia in Ireland by Tamara Ringwood A thesis presented for the Degree of Doctor of Philosophy National University of Ireland, Cork University College Cork Coláiste na hOllscoile Corcaigh Department of Microbiology Head of Department: Prof. Gerald F. Fitzgerald Supervisor: Prof. Michael B. Prentice April 2013 Contents List of Tables .............................................................................................................................................. iv List of figures ............................................................................................................................................. vi Declaration ............................................................................................................................................... viii Acknowledgements ................................................................................................................................ -

NZMS Annual Conference 2017
NZMS Annual Conference 2017 20-23 November, AUT, Auckland PROGRAMME & ABSTRACTS MAJOR SPONSORS: WELCOME Welcome to the 2017 annual meeting of the New Zealand Microbiological Society. This year the theme of the NZ Microbiological Society (NZMS) conference is, “Our well-being and our microbes”. We are highlighting the dependence of our economy on maintaining and developing healthy microbial interactions while minimising diseases of concern for humans, livestock and plants. This conference covers the diverse field of microbiology and its disciplines including agricultural, environmental, food, medical and biotechnology sectors that rely on microbial knowledge, management and products. As our biggest city, Auckland and the surrounding regions has something for everyone, from hot springs to harbours, whale-watching to wine-tasting, mountains to museums and we look forward to hosting your stay here. CONFERENCE COMMITTEE Conference Chairs Gavin Lear (University of Auckland) | [email protected] Brent Seale (Auckland University of Technology) | [email protected] Organising Committee Steve Flint (Massey University) Kim Handley (University of Auckland) Heather Hendrickson (Massey University) Syrie Hermans – Student Representative (University of Auckland) Thomas Proft (University of Auckland) Mike Taylor (University of Auckland) Bevan Weir (Landcare Research) Weiqin Zhuang (University of Auckland) Rosemary Hancock (événements Limited) Conference Manager | [email protected] Lauren Williams (Auckland University of Technology) Event Co-ordinator WHILE AT THE CONFERENCE… o Registration desk contact phone number: Rosemary, ph 021 217 8298 o Please wear your name label to all conference sessions and social functions. These badges identify you as a NZMS conference participant. The venue is a public space and you may be asked to leave the catering areas if we cannot identify you! o Please take note of the location of the exits in all conference rooms and in your accommodation. -

International Journal of Systematic and Evolutionary Microbiology (2016), 66, 5575–5599 DOI 10.1099/Ijsem.0.001485
International Journal of Systematic and Evolutionary Microbiology (2016), 66, 5575–5599 DOI 10.1099/ijsem.0.001485 Genome-based phylogeny and taxonomy of the ‘Enterobacteriales’: proposal for Enterobacterales ord. nov. divided into the families Enterobacteriaceae, Erwiniaceae fam. nov., Pectobacteriaceae fam. nov., Yersiniaceae fam. nov., Hafniaceae fam. nov., Morganellaceae fam. nov., and Budviciaceae fam. nov. Mobolaji Adeolu,† Seema Alnajar,† Sohail Naushad and Radhey S. Gupta Correspondence Department of Biochemistry and Biomedical Sciences, McMaster University, Hamilton, Ontario, Radhey S. Gupta L8N 3Z5, Canada [email protected] Understanding of the phylogeny and interrelationships of the genera within the order ‘Enterobacteriales’ has proven difficult using the 16S rRNA gene and other single-gene or limited multi-gene approaches. In this work, we have completed comprehensive comparative genomic analyses of the members of the order ‘Enterobacteriales’ which includes phylogenetic reconstructions based on 1548 core proteins, 53 ribosomal proteins and four multilocus sequence analysis proteins, as well as examining the overall genome similarity amongst the members of this order. The results of these analyses all support the existence of seven distinct monophyletic groups of genera within the order ‘Enterobacteriales’. In parallel, our analyses of protein sequences from the ‘Enterobacteriales’ genomes have identified numerous molecular characteristics in the forms of conserved signature insertions/deletions, which are specifically shared by the members of the identified clades and independently support their monophyly and distinctness. Many of these groupings, either in part or in whole, have been recognized in previous evolutionary studies, but have not been consistently resolved as monophyletic entities in 16S rRNA gene trees. The work presented here represents the first comprehensive, genome- scale taxonomic analysis of the entirety of the order ‘Enterobacteriales’. -

Microbial Biopesticides in Agroecosystems
agronomy Review Microbial Biopesticides in Agroecosystems Luca Ruiu 1,2 1 Dipartimento di Agraria, University of Sassari, 07100 Sassari, Italy; [email protected]; Tel.: +39-079-229-326 2 Bioecopest Srl, Technology Park of Sardinia, 07041 Alghero (SS), Italy Received: 11 September 2018; Accepted: 22 October 2018; Published: 23 October 2018 Abstract: Microbial biopesticides include several microorganisms like bacteria, fungi, baculoviruses, and nematode-associated bacteria acting against invertebrate pests in agro-ecosystems. The biopesticide sector is experiencing a significant growth and many discoveries are being developed into new biopesticidal products that are fueling a growing global market offer. Following a few decades of successful use of the entomopathogenic bacterium Bacillus thuringiensis and a few other microbial species, recent academic and industrial efforts have led to the discovery of new microbial species and strains, and of their specific toxins and virulence factors. Many of these have, therefore, been developed into commercial products. Bacterial entomopathogens include several Bacillaceae, Serratia, Pseudomonas, Yersinia, Burkholderia, Chromobacterium, Streptomyces, and Saccharopolyspora species, while fungi comprise different strains of Beauveria bassiana, B. brongniartii, Metarhizium anisopliae, Verticillium, Lecanicillium, Hirsutella, Paecilomyces, and Isaria species. Baculoviruses are species-specific and refer to niche products active against chewing insects, especially Lepidopteran caterpillars. Entomopathogenic -

Add, Stir and Reduce' Mcnally, Alan; Thomson, Nicholas R; Reuter, Sandra; Wren, Brendan W
University of Birmingham 'Add, stir and reduce' McNally, Alan; Thomson, Nicholas R; Reuter, Sandra; Wren, Brendan W DOI: 10.1038/nrmicro.2015.29 License: Creative Commons: Attribution-NonCommercial-NoDerivs (CC BY-NC-ND) Document Version Peer reviewed version Citation for published version (Harvard): McNally, A, Thomson, NR, Reuter, S & Wren, BW 2016, ''Add, stir and reduce': Yersinia spp. as model bacteria for pathogen evolution', Nature Reviews Microbiology, vol. 14, no. 3, pp. 177-190. https://doi.org/10.1038/nrmicro.2015.29 Link to publication on Research at Birmingham portal Publisher Rights Statement: Checked 05/10/2016 General rights Unless a licence is specified above, all rights (including copyright and moral rights) in this document are retained by the authors and/or the copyright holders. The express permission of the copyright holder must be obtained for any use of this material other than for purposes permitted by law. •Users may freely distribute the URL that is used to identify this publication. •Users may download and/or print one copy of the publication from the University of Birmingham research portal for the purpose of private study or non-commercial research. •User may use extracts from the document in line with the concept of ‘fair dealing’ under the Copyright, Designs and Patents Act 1988 (?) •Users may not further distribute the material nor use it for the purposes of commercial gain. Where a licence is displayed above, please note the terms and conditions of the licence govern your use of this document. When citing, please reference the published version. Take down policy While the University of Birmingham exercises care and attention in making items available there are rare occasions when an item has been uploaded in error or has been deemed to be commercially or otherwise sensitive. -

Spore Surface Proteins of Brevibacillus Laterosporus Are Involved in Insect
www.nature.com/scientificreports OPEN Spore surface proteins of Brevibacillus laterosporus are involved in insect pathogenesis Received: 17 November 2016 Maria Giovanna Marche*, Maria Elena Mura*, Giovanni Falchi & Luca Ruiu Accepted: 30 January 2017 Outer spore envelope proteins of pathogenic bacteria often present specific virulence factors and tools Published: 03 March 2017 to evade the defence system of their hosts. Brevibacillus laterosporus, a pathogen of invertebrates and an antimicrobial-producing species, is characterised by a unique spore coat and canoe-shaped parasporal body (SC-CSPB) complex surrounding the core spore. In the present study, we identified and characterised major proteins of the SC-CSPB complex of B. laterosporus, and we investigated their entomopathogenic role. Employing a proteomic approach and a B. laterosporus-house fly study model, we found four highly conserved proteins (ExsC, CHRD, CpbA and CpbB) that function as insect virulence factors. CpbA was associated with a significantly higher mortality of flies and greater relative gene expression levels during sporulation, compared to the other SC-CSPB proteins. Taken together, we suggest that spore surface proteins are a part of a complex set of toxins and virulence factors that B. laterosporus employs in its pathogenicity against flies. The primary function of bacterial cell envelopes is to provide structural integrity and protection to the protoplast. Despite significant differences among diverse species, their composition normally includes envelope polymers and surface layer proteins that bacteria typically use to interact with the external environment1. In endospore forming species (i.e. Bacillus spp., Clostridium spp.), the spore is encased in a protein coat that can be additionally surrounded by outermost structures like the exosporium that protects the spores and interacts with the environ- ment2. -

Parallel Independent Evolution of Pathogenicity Within the Genus Yersinia
Parallel independent evolution of pathogenicity within the genus Yersinia Sandra Reutera,b,1, Thomas R. Connorb,c,1, Lars Barquistb, Danielle Walkerb, Theresa Feltwellb, Simon R. Harrisb, Maria Fookesb, Miquette E. Halla, Nicola K. Pettyb,d, Thilo M. Fuchse, Jukka Coranderf, Muriel Dufourg, Tamara Ringwoodh, Cyril Savini, Christiane Bouchierj, Liliane Martini, Minna Miettinenf, Mikhail Shubinf, Julia M. Riehmk, Riikka Laukkanen-Niniosl, Leila M. Sihvonenm, Anja Siitonenm, Mikael Skurnikn, Juliana Pfrimer Falcãoo, Hiroshi Fukushimap, Holger C. Scholzk, Michael B. Prenticeh, Brendan W. Wrenq, Julian Parkhillb, Elisabeth Carnieli, Mark Achtmanr,s, Alan McNallya, and Nicholas R. Thomsonb,q,2 aPathogen Research Group, Nottingham Trent University, Nottingham NG11 8NS, United Kingdom; bPathogen Genomics, Wellcome Trust Sanger Institute, Cambridge CB10 1SA, United Kingdom; cCardiff University School of Biosciences, Cardiff University, Cardiff CF10 3AX, Wales, United Kingdom; dThe ithree institute, University of Technology, Sydney, NSW 2007, Australia; eZentralinstitut für Ernährungs- und Lebensmittelforschung, Technische Universität München, D-85350 Freising, Germany; fDepartment of Mathematics and Statistics, and lDepartment of Food Hygiene and Environmental Health, Faculty of Veterinary Medicine, University of Helsinki, FIN-00014 Helsinki, Finland; gInstitute of Environmental Science and Research, Wallaceville, Upper Hutt 5140, New Zealand; hDepartment of Microbiology and rEnvironmental Research Institute, University College Cork, Cork, Ireland; iYersinia Research Unit, jGenomics Platform, Institut Pasteur, 75724 Paris, France; kDepartment of Bacteriology, Bundeswehr Institute of Microbiology, D-80937 Munich, Germany; mBacteriology Unit, National Institute for Health and Welfare (THL), FIN-00271 Helsinki, Finland; nDepartment of Bacteriology and Immunology, Haartman Institute, University of Helsinki and Helsinki University Central Hospital Laboratory Diagnostics, FIN-00014 Helsinki, Finland; oBrazilian Reference Center on Yersinia spp. -

Isolation and Spread of Enteropathogenic Yersinia Spp. Throughout the Pork Production Chain
Isolation and spread of enteropathogenic Yersinia spp. throughout the pork production chain Inge Van Damme Dissertation submitted in fulfilment of the requirements for the degree of Doctor in Veterinary Sciences (PhD) 2013 Promotors: Prof. Dr. Lieven De Zutter Department of Veterinary Public Health and Food Safety Faculty of Veterinary Medicine Ghent University Prof. Dr. Dirk Berkvens Department of Biomedical Sciences Prince Leopold Institute of Tropical Medicine Members of the reading and examination committee Chairman Prof. Dr. Frank Gasthuys, dean Members of the reading committee Prof. Dr. Fredriksson-Ahomaa Dr. Martine Denis Prof. Dr. Marc Heyndrickx Members of the examination committee Dr. Nadine Botteldoorn Prof. Dr. Dominiek Maes ISBN: 978-90-5864-352-0 To cite this thesis Van Damme I. (2013). Isolation and spread of enteropathogenic Yersinia spp. throughout the pork production chain. Thesis submitted in fulfilment of the requirements for the degree of Doctor in Veterinary Sciences (PhD), Faculty of Veterinary Medicine, Ghent University. The author and promoters give the permission to consult and to copy parts of this work for personal use only. Any other use is subject to the Laws of Copyright. Permission to reproduce any material contained in this work should be obtained from the author. Table of contents List of abbreviations ......................................................................................................................... 5 General introduction ................................................................................................................