Ministério Do Meio Ambiente
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Instituto Nacional De Pesquisas Da Amazônia – Inpa
INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA – INPA UNIVERSIDADE FEDERAL DO AMAZONAS – UFAM Sistemática e Filogeografia de Pimelodus blochii (Siluriformes: Pimelodidae) da Amazônia MARCELO SALLES ROCHA Dissertação apresentada ao Programa de Pós-graduação em Biologia Tropical e Recursos Naturais do convênio INPA/UFAM, como parte dos requisitos para obtenção do título de Mestre em CIÊNCIAS BIOLÓGICAS, área de concentração em Biologia de Água Doce e Pesca Interior. Manaus – AM 2006 INSTITUTO NACIONAL DE PESQUISAS DA AMAZÔNIA – INPA UNIVERSIDADE FEDERAL DO AMAZONAS – UFAM Sistemática e Filogeografia de Pimelodus blochii (Siluriformes: Pimelodidae) da Amazônia MARCELO SALLES ROCHA Orientadora: Dra. Lúcia H. Rapp Py-Daniel Dissertação apresentada ao Programa de Pós-graduação em Biologia Tropical e Recursos Naturais do convênio INPA/UFAM, como parte dos requisitos para obtenção do título de Mestre em CIÊNCIAS BIOLÓGICAS, área de concentração em Biologia de Água Doce e Pesca Interior. Financiamento: PROBIO/MMA/Banco Mundial/CNPQ e PPI 1- 3050 Manaus – AM 2006 FICHA CATALOGRÁFICA Rocha, Marcelo Salles Sistemática e filogeografia de Pimelodus blochii (Siluriformes: Pimelodidae) da Amazônia Manaus:INPA/UFAM, 2006 IX + 82p. Dissertação de Mestrado Palavras-Chave: 1.Siluriformes 2.Pimelodus 3.Sistemática 4.Taxonomia 5.DNA mitocondrial 5. Filogeografia Sinopse Neste trabalho foram evidenciadas através da análise morfológica seis novas espécies de Pimelodus, mostrando que os exemplares brasileiros identificados como Pimelodus blochii são morfologicamente diferentes de P. blochii do Suriname. Na análise molecular foi realizada uma análise filogenética com o objetivo de verificar o monofiletismo do complexo P. blochii, utilizando também exemplares do complexo P. albofasciatus. Ficou evidenciado o não-monofiletismo do complexo P. blochii. -

Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 Version Available for Download From
Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 version Available for download from http://www.ramsar.org/ris/key_ris_index.htm. Categories approved by Recommendation 4.7 (1990), as amended by Resolution VIII.13 of the 8th Conference of the Contracting Parties (2002) and Resolutions IX.1 Annex B, IX.6, IX.21 and IX. 22 of the 9th Conference of the Contracting Parties (2005). Notes for compilers: 1. The RIS should be completed in accordance with the attached Explanatory Notes and Guidelines for completing the Information Sheet on Ramsar Wetlands. Compilers are strongly advised to read this guidance before filling in the RIS. 2. Further information and guidance in support of Ramsar site designations are provided in the Strategic Framework and guidelines for the future development of the List of Wetlands of International Importance (Ramsar Wise Use Handbook 14, 3rd edition). A 4th edition of the Handbook is in preparation and will be available in 2009. 3. Once completed, the RIS (and accompanying map(s)) should be submitted to the Ramsar Secretariat. Compilers should provide an electronic (MS Word) copy of the RIS and, where possible, digital copies of all maps. 1. Name and address of the compiler of this form: FOR OFFICE USE ONLY. DD MM YY Beatriz de Aquino Ribeiro - Bióloga - Analista Ambiental / [email protected], (95) Designation date Site Reference Number 99136-0940. Antonio Lisboa - Geógrafo - MSc. Biogeografia - Analista Ambiental / [email protected], (95) 99137-1192. Instituto Chico Mendes de Conservação da Biodiversidade - ICMBio Rua Alfredo Cruz, 283, Centro, Boa Vista -RR. CEP: 69.301-140 2. -

Diversidade De Ictiofauna Em Lagoas Costeiras Na Costa Atlântica Da América Do Sul: Fatores Históricos, Contemporâneos E Mudanças Climáticas
UNIVERSIDADE FEDERAL DO RIO GRANDE DO SUL INSTITUTO DE BIOCIÊNCIAS PROGRAMA DE PÓS-GRADUAÇÃO EM ECOLOGIA Tese de Doutorado Diversidade de ictiofauna em lagoas costeiras na costa atlântica da América do Sul: fatores históricos, contemporâneos e mudanças climáticas Taís de Fátima Ramos Guimarães Porto Alegre, novembro de 2019 i CIP - Catalogação na Publicação Guimarães, Taís de Fátima Ramos Diversidade de ictiofauna em lagoas costeiras na costa atlântica da América do Sul: fatores históricos, contemporâneos e mudanças climáticas / Taís de Fátima Ramos Guimarães. -- 2019. 143 f. Orientadora: Sandra Maria Hartz. Coorientadora: Ana Cristina Petry. Tese (Doutorado) -- Universidade Federal do Rio Grande do Sul, Instituto de Biociências, Programa de Pós-Graduação em Ecologia, Porto Alegre, BR-RS, 2019. 1. Ictiofauna de lagoas costeiras. 2. Efeitos históricos e contemporâneos sobre a ictiofauna. 3. Impacto da elevação do nível do mar sobre a ictiofauna de lagoas. I. Hartz, Sandra Maria, orient. II. Petry, Ana Cristina, coorient. III. Título. Elaborada pelo Sistema de Geração Automática de Ficha Catalográfica da UFRGS com os dados fornecidos pelo(a) autor(a). Diversidade de ictiofauna em lagoas costeiras na costa atlântica da América do Sul: fatores históricos, contemporâneos e mudanças climáticas Taís de Fátima Ramos Guimarães Tese de Doutorado apresentada ao Programa de Pós-Graduação em Ecologia, do Instituto de Biociências da Universidade Federal do Rio Grande do Sul, como parte dos requisitos para obtenção do título de Doutor em Ciências com ênfase em Ecologia. Orientador: Prof. Dra. Sandra Maria Hartz - UFRGS Corientador: Prof. Dra. Ana Cristina Petry - UFRJ Comissão examinadora: Prof. Dra. Sandra C. Müller - UFRGS Prof. Dra. -

A New Species of Characidium (Characiformes: Crenuchidae) From
Neotropical Ichthyology, 17(2): e180121, 2019 Journal homepage: www.scielo.br/ni DOI: 10.1590/1982-0224-20180121 Published online: 18 July 2019 (ISSN 1982-0224) Copyright © 2019 Sociedade Brasileira de Ictiologia Printed: 30 June 2019 (ISSN 1679-6225) Original article A new species of Characidium (Characiformes: Crenuchidae) from coastal basins in the Atlantic Rainforest of eastern Brazil, with phylogenetic and phylogeographic insights into the Characidium alipioi species group Evandro Malanski1,2,5, Luisa Maria Sarmento-Soares1,3,6, Ana Cecilia Gomes Silva-Malanski2,5, Maridiesse Morais Lopes3, Leonardo Ferreira da Silva Ingenito1,4 and Paulo Andreas Buckup2 A new species of Characidium from southeastern Brazil is described based on morphological and molecular evidence from specimens collected between the rio Jucuruçu and rio Doce basins. The new species belongs to a group of species within Characidium with an unscaled area in the isthmus and is distinguished from these species, except C. alipioi, C. fasciatum, C. hasemani, and C. kamakan, by the greater distance (greater than 10% SL) and presence of 5-7 scales between the anus and the anal fin, and presence of 14 series of scales around the caudal peduncle. The species is distinguished fromC. alipioi by having 4 series of scales above the lateral line (vs. 5 series) and greater distance between the anus and the anal fin; fromC. fasciatum and C. kamakan, by the smaller body depth at the dorsal-fin origin, at the anal-fin origin, and at the caudal peduncle; from C. hasemani, by the short distances between the tip of the snout and the pelvic fin, the tip of the snout and the anal fin, and the tip of the snout and the tip of anal fin. -

Baixar Baixar
INSTITUTO ESTADUAL DE FLORESTAS — MG DIRETORIA DE BIODIVERSIDADE GERÊNCIA DE PROJETOS E PESQUISAS MG.BIOTA Belo Horizonte v.2, n.6 fev./mar. 2010 SUMÁRIO Editorial ......................................................................................................................... 3 Apresentação ................................................................................................................ 4 A ictiofauna da bacia do Alto Paraná (rio Grande e rio Paranaíba) Gilmar Bastos Santos ......................................................................................................... 5 Agradecimentos ............................................................................................................ 25 Aspectos da conservação da fauna de peixes da bacia do rio São Francisco em Minas Gerais Carlos Bernardo Mascarenhas Alves e Cecília Gontijo Leal ......................................................... 26 Agradecimentos ............................................................................................................ 44 Em Destaque Alexandre W. S.Hilsdorf, Flavio C. T. Lima e Danilo Caneppele .................................................... 51 EDITORIAL Deve-se novamente ressaltar que Minas Gerais, com seus 587.000 Km², abriga o mais importante e estratégico sistema de bacias hidrográficas do Brasil, excetuando-se o da bacia Amazônica. Além disso, o Estado possui 500.000 hectares de "espelhos de água" nos reservatórios de usinas hidrelétricas, lagos e lagoas. Os recursos hídricos mineiros, por seus -

Check List 5(3): 673–691, 2009
Check List 5(3): 673–691, 2009. ISSN: 1809-127X LISTS OF SPECIES Fishes from the upper Yuruá river, Amazon basin, Peru Tiago P. Carvalho 1 S. June Tang 1 Julia I. Fredieu 1 Roberto Quispe 2 Isabel Corahua 2 Hernan Ortega 2 1 James S. Albert 1 University of Louisiana at Lafayette, Department of Biology. Lafayette, LA 70504, USA. E-mail: [email protected] 2 Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos. Av. Arenales 1256, Lima 11, Peru. Abstract We report results of an ichthyological survey of the upper Rio Yuruá in southeastern Peru. Collections were made at low water (July-August, 2008) near the headwaters of the Brazilian Rio Juruá. This is the first of four expeditions to the Fitzcarrald Arch - an upland associated with the Miocene-Pliocene rise of the Peruvian Andes - with the goal of comparing the ichthyofauna across the headwaters of the largest tributary basins in the western Amazon (Ucayali, Juruá, Purús and Madeira). We recorded a total of 117 species in 28 families and 10 orders, with all species accompanied by tissue samples preserved in 100% ethanol for subsequent DNA analysis, and high-resolution digital images of voucher specimens with live color to facilitate accurate identification. From interviews with local fishers and comparisons with other ichthyological surveys of the region we estimate the actual diversity of fishes in the upper Juruá to exceed 200 species. Introduction The Yuruá river rises in the department of Ucayali The freshwater f sh fauna of tropical South in Peru and runs into Brazilian territory, where it America is among the richest vertebrate faunas is known as Juruá river. -

Redalyc.Checklist of the Freshwater Fishes of Colombia
Biota Colombiana ISSN: 0124-5376 [email protected] Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Colombia Maldonado-Ocampo, Javier A.; Vari, Richard P.; Saulo Usma, José Checklist of the Freshwater Fishes of Colombia Biota Colombiana, vol. 9, núm. 2, 2008, pp. 143-237 Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Bogotá, Colombia Available in: http://www.redalyc.org/articulo.oa?id=49120960001 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Biota Colombiana 9 (2) 143 - 237, 2008 Checklist of the Freshwater Fishes of Colombia Javier A. Maldonado-Ocampo1; Richard P. Vari2; José Saulo Usma3 1 Investigador Asociado, curador encargado colección de peces de agua dulce, Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Claustro de San Agustín, Villa de Leyva, Boyacá, Colombia. Dirección actual: Universidade Federal do Rio de Janeiro, Museu Nacional, Departamento de Vertebrados, Quinta da Boa Vista, 20940- 040 Rio de Janeiro, RJ, Brasil. [email protected] 2 Division of Fishes, Department of Vertebrate Zoology, MRC--159, National Museum of Natural History, PO Box 37012, Smithsonian Institution, Washington, D.C. 20013—7012. [email protected] 3 Coordinador Programa Ecosistemas de Agua Dulce WWF Colombia. Calle 61 No 3 A 26, Bogotá D.C., Colombia. [email protected] Abstract Data derived from the literature supplemented by examination of specimens in collections show that 1435 species of native fishes live in the freshwaters of Colombia. -
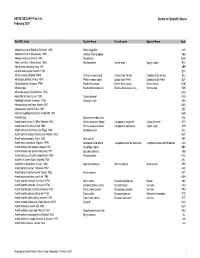
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Felipe Skóra Neto
UNIVERSIDADE FEDERAL DO PARANÁ FELIPE SKÓRA NETO OBRAS DE INFRAESTRUTURA HIDROLÓGICA E INVASÕES DE PEIXES DE ÁGUA DOCE NA REGIÃO NEOTROPICAL: IMPLICAÇÕES PARA HOMOGENEIZAÇÃO BIÓTICA E HIPÓTESE DE NATURALIZAÇÃO DE DARWIN CURITIBA 2013 FELIPE SKÓRA NETO OBRAS DE INFRAESTRUTURA HIDROLÓGICA E INVASÕES DE PEIXES DE ÁGUA DOCE NA REGIÃO NEOTROPICAL: IMPLICAÇÕES PARA HOMOGENEIZAÇÃO BIÓTICA E HIPÓTESE DE NATURALIZAÇÃO DE DARWIN Dissertação apresentada como requisito parcial à obtenção do grau de Mestre em Ecologia e Conservação, no Curso de Pós- Graduação em Ecologia e Conservação, Setor de Ciências Biológicas, Universidade Federal do Paraná. Orientador: Jean Ricardo Simões Vitule Co-orientador: Vinícius Abilhoa CURITIBA 2013 Dedico este trabalho a todas as pessoas que foram meu suporte, meu refúgio e minha fortaleza ao longo dos períodos da minha vida. Aos meus pais Eugênio e Nilte, por sempre acreditarem no meu sonho de ser cientista e me darem total apoio para seguir uma carreira que poucas pessoas desejam trilhar. Além de todo o suporte intelectual e espiritual e financeiro para chegar até aqui, caminhando pelas próprias pernas. Aos meus avós: Cândida e Felippe, pela doçura e horas de paciência que me acolherem em seus braços durante a minha infância, pelas horas que dispenderem ao ficarem lendo livros comigo e por sempre serem meu refúgio. Você foi cedo demais, queria que estivesse aqui para ver esta conquista e principalmente ver o meu maior prêmio, que é minha filha. Saudades. A minha esposa Carine, que tem em comum a mesma profissão o que permitiu que entendesse as longas horas sentadas a frente de livros e do computador, a sua confiança e carinho nas minhas horas de cansaço, você é meu suporte e meu refúgio. -

Metazoan Parasites of Calophysus Macropterus (Siluriformes
Journal of Natural History ISSN: 0022-2933 (Print) 1464-5262 (Online) Journal homepage: https://www.tandfonline.com/loi/tnah20 Metazoan parasites of Calophysus macropterus (Siluriformes: Pimelodidae) in the Acre and Iaco rivers in the western Amazon region of Brazil: diversity, similarity and seasonal variation Luciano Pereira Negreiros, Felipe Bisaggio Pereira & Marcos Tavares-Dias To cite this article: Luciano Pereira Negreiros, Felipe Bisaggio Pereira & Marcos Tavares-Dias (2019) Metazoan parasites of Calophysusmacropterus (Siluriformes: Pimelodidae) in the Acre and Iaco rivers in the western Amazon region of Brazil: diversity, similarity and seasonal variation, Journal of Natural History, 53:23-24, 1465-1479, DOI: 10.1080/00222933.2019.1657195 To link to this article: https://doi.org/10.1080/00222933.2019.1657195 Published online: 05 Sep 2019. Submit your article to this journal View related articles View Crossmark data Full Terms & Conditions of access and use can be found at https://www.tandfonline.com/action/journalInformation?journalCode=tnah20 JOURNAL OF NATURAL HISTORY 2019, VOL. 53, NOS. 23–24, 1465–1479 https://doi.org/10.1080/00222933.2019.1657195 Metazoan parasites of Calophysus macropterus (Siluriformes: Pimelodidae) in the Acre and Iaco rivers in the western Amazon region of Brazil: diversity, similarity and seasonal variation Luciano Pereira Negreirosa, Felipe Bisaggio Pereirab and Marcos Tavares-Dias a,c aPostgraduate Network for Amazon Biodiversity and Biotechnology (PPG-BIONORTE), Federal University of Amapá, Macapá, Brazil; bPostgraduate Program on Animal Biology, Biosciences Institute (INBIO), Federal University of Mato Grosso do Sul (UFMS), Campo Grande, Brazil; cEmbrapa Amapá, Macapá, Brazil ABSTRACT ARTICLE HISTORY The diversity, similarity and seasonal variation of metazoan parasite Received 19 November 2018 communities in Calophysus macropterus in the Acre and Iaco rivers, in Accepted 8 August 2019 the western Amazon (Brazil), was investigated. -

Redalyc.Peces De La Zona Hidrogeográfica De La Amazonia
Biota Colombiana ISSN: 0124-5376 [email protected] Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Colombia Bogotá-Gregory, Juan David; Maldonado-Ocampo, Javier Alejandro Peces de la zona hidrogeográfica de la Amazonia, Colombia Biota Colombiana, vol. 7, núm. 1, 2006, pp. 55-94 Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Bogotá, Colombia Disponible en: http://www.redalyc.org/articulo.oa?id=49170105 Cómo citar el artículo Número completo Sistema de Información Científica Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto Biota Colombiana 7 (1) 55 - 94, 2006 Peces de la zona hidrogeográfica de la Amazonia, Colombia Juan David Bogotá-Gregory1 y Javier Alejandro Maldonado-Ocampo2 1 Investigador colección de peces, Instituto de Investigación en Recursos Biológicos Alexander von Humboldt, Claustro de San Agustín, Villa de Leyva, Boyacá, Colombia. [email protected] 2 Grupo de Exploración y Monitoreo Ambiental –GEMA-, Programa de Inventarios de Biodiversidad, Instituto de Investigación en Recursos Biológicos Alexander von Humboldt, Claustro de San Agustín, Villa de Leyva, Boyacá, Colombia. [email protected]. Palabras Clave: Peces, Amazonia, Amazonas, Colombia Introducción La cuenca del Amazonas cubre alrededor de 6.8 especies siempre ha estado subvalorada. Mojica (1999) millones de km2 en la cual el río Amazonas, su mayor registra un total de 264 spp., recientemente Bogotá-Gregory tributario, tiene una longitud aproximada de 6000 – 7800 km. & Maldonado-Ocampo (2005) incrementan el número de Gran parte de la cuenca Amazónica recibe de 1500 – 2500 especies a 583 spp. -

Long-Whiskered Catfishes Spec
FAMILY Pimelodidae Bonaparte, 1835 - long-whiskered catfishes [=Pimelodini, Sorubinae, Anodontes, Hypophthalmini, Ariobagri, Callophysinae, Luciopimelodinae, Pinirampidae, Brachyplatystomatini] GENUS Aguarunichthys Stewart, 1986 - long-whiskered catfishes Species Aguarunichthys inpai Zuanon et al., 1993 - Solimoes long-whiskered catfish Species Aguarunichthys tocantinsensis Zuanon et al., 1993 - Zuanon's Tocantins long-whiskered catfish Species Aguarunichthys torosus Stewart, 1986 - Cenepa long-whiskered catfish GENUS Bagropsis Lutken, 1874 - long-whiskered catfishes Species Bagropsis reinhardti Lütken, 1874 - Reinhardt's bagropsis GENUS Bergiaria Eigenmann & Norris, 1901 - long-whiskered catfishes [=Bergiella] Species Bergiaria platana (Steindachner, 1908) - Steindachner's bergiaria Species Bergiaria westermanni (Lütken, 1874) - Lutken's bergiaria GENUS Brachyplatystoma Bleeker, 1862 - long-whiskered catfishes, goliath catfishes [=Ginesia, Goslinia, Malacobagrus, Merodontotus, Priamutana, Piratinga, Taenionema] Species Brachyplatystoma capapretum Lundberg & Akama, 2005 - Tefe long-whiskered catfish Species Brachyplatystoma filamentosum (Lichtenstein, 1819) - lau-lau, kumakuma [=affine, gigas, goeldii, piraaiba] Species Brachyplatystoma juruense (Boulenger, 1898) - Dourade zebra, zebra catfish [=cunaguaro] Species Brachyplatystoma platynemum Boulenger, 1898 - slobbering catfish [=steerei] Species Brachyplatystoma rousseauxii (Castelnau, 1855) - dourada [=goliath, paraense] Species Brachyplatystoma vaillantii (Valenciennes, in Cuvier &