FERNANDA MARIA CORDEIRO DE OLIVEIRA.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Three New Species and Growth Patterns in Hechtia (Bromeliaceae: Hechtioideae)
Phytotaxa 178 (2): 113–127 ISSN 1179-3155 (print edition) www.mapress.com/phytotaxa/ PHYTOTAXA Copyright © 2014 Magnolia Press Article ISSN 1179-3163 (online edition) http://dx.doi.org/10.11646/phytotaxa.178.2.3 Three new species and growth patterns in Hechtia (Bromeliaceae: Hechtioideae) IVÓN RAMÍREZ MORILLO1,3, CARLOS F. JIMÉNEZ1, GERMÁN CARNEVALI FERNÁNDEZ-CONCHA1 & JUAN P. PINZÓN2 1Centro de Investigación Científica de Yucatán, A. C., Unidad de Recursos Naturales-Herbario CICY, Calle 43 # 130. Colonia Chuburná de Hidalgo, Mérida, Yucatán 97200, México. 2Universidad Autónoma de Yucatán, Campus de Ciencias Biológicas y Agropecuarias, Departamento de Botánica, Carretera Mérida- Xmatkuil, Km. 15.5 Apdo. Postal: 4-116 Itzimná, Mérida, Yucatán 97100, México. 3E.-mail [email protected] (Author for correspondence) Abstract Three new species of Hechtia from the Mexican State of Oaxaca are herein proposed as new: Hechtia flexilifolia, H. hua- melulaensis, and H. nivea, from the physiogeographical provinces of Mixteca Alta, Costas del Sur, and Sierras Centrales de Oaxaca respectively. All three species are described and illustrated. Iconography provided features plants in habitat and under cultivation. An assessment of their conservation status sensu IUCN criteria is presented as well. We also discuss and illustrate the three growth patterns identified at this time in the genus. Keywords: Diversity, endemism, growth patterns, IUCN, Oaxaca, physiogeographical regions Introduction Oaxaca ranks third in vascular plant diversity among Mexican states only after Chiapas and Guerrero, with 251 families, comprising 1,824 genera and 8,431 species (García-Mendoza 2004). Among them, angiosperms are the most numerous with 7,752 species, whereas Bromeliaceae is the seventh most diverse family of monocots. -

Vascular Epiphytes of Reserva Ecológica De Guapiaçu
Cachoeiras de Macacu, Atlantic Forest - Rio de Janeiro, Brazil 1 Vascular epiphytes of Reserva Ecológica de Guapiaçu Nadjara de Medeiros Corrêa 1; Mariana Moreira da Silva Murakami 1; Laura do Nascimento Martins 1,2; Ana Carolina Rodrigues da Cruz 1,3 & André Felippe Nunes-Freitas 1 1 Universidade Federal Rural do Rio de Janeiro; 2 Instituto Nacional de Pesquisas da Amazônia; 3 Museu Nacional, Universidade Federal do Rio de Janeiro Photo By: Corrêa N. M.; Cruz, A.C.R.;MurakamiM.M. Produced by: Corrêa N. M. & Juliana Philipp, Keller Science Action Center, Field Museum @Nadjara de Medeiros Corrêa [[email protected]], Mariana Moreira da Silva Murakami, Laura do Nascimento Martins, Ana Carolina Rodrigues da Cruz and André Felippe Nunes-Freitas ©Nadjara de Medeiros Corrêa Support from CAPES; FAPERJ and UFRRJ. [fieldguides.fieldmuseum.org] [1208] version 1 11/2019 1 Anthurium minarum 2 Anthurium scandens 3 Anthurium scandens 4 Anthurium scandens 5 Anthurium solitarium Sakur. & Mayo (Aubl.) Engl. (Aubl.) Engl. (Aubl.) Engl. Schott ARACEAE ARACEAE ARACEAE ARACEAE ARACEAE 6 Anthurium solitarium 7 Monstera adansonii 8 Philodendron cordatum 9 Philodendron cordatum 10 Asplenium serratum L. Schott Schott Schott Schott ASPLENIACEAE ARACEAE ARACEAE ARACEAE ARACEAE 11 Asplenium serratum L. 12 Begonia hirtella Link 13 Begonia hirtella Link 14 Begonia integerrima ASPLENIACEAE BEGONIACEAE BEGONIACEAE Spreng. BEGONIACEAE Cachoeiras de Macacu, Atlantic Forest - Rio de Janeiro, Brazil Vascular epiphytes of Reserva Ecológica de Guapiaçu 2 Nadjara de Medeiros Corrêa 1; Mariana Moreira da Silva Murakami 1; Laura do Nascimento Martins 1,2; Ana Carolina Rodrigues da Cruz 1,3 & André Felippe Nunes-Freitas 1 1 Universidade Federal Rural do Rio de Janeiro; 2 Instituto Nacional de Pesquisas da Amazônia; 3 Museu Nacional, Universidade Federal do Rio de Janeiro Photo By: Corrêa N. -

Network Scan Data
Selbyana 15: 132-149 CHECKLIST OF VENEZUELAN BROMELIACEAE WITH NOTES ON SPECIES DISTRIBUTION BY STATE AND LEVELS OF ENDEMISM BRUCE K. HOLST Missouri Botanical Garden, P.O. Box 299, St. Louis, Missouri 63166-0299, USA ABSTRACf. A checklist of the 24 genera and 364 native species ofBromeliaceae known from Venezuela is presented, including their occurrence by state and indications of which are endemic to the country. A comparison of the number of genera and species known from Mesoamerica (southern Mexico to Panama), Colombia, Venezuela, the Guianas (Guyana, Suriname, French Guiana), Ecuador, and Peru is presented, as well as a summary of the number of species and endemic species in each Venezuelan state. RESUMEN. Se presenta un listado de los 24 generos y 364 especies nativas de Bromeliaceae que se conocen de Venezuela, junto con sus distribuciones por estado y una indicaci6n cuales son endemicas a Venezuela. Se presenta tambien una comparaci6n del numero de los generos y especies de Mesoamerica (sur de Mexico a Panama), Colombia, Venezuela, las Guayanas (Guyana, Suriname, Guyana Francesa), Ecuador, y Peru, y un resumen del numero de especies y numero de especies endemicas de cada estado de Venezuela. INTRODUCTION Bromeliaceae (Smith 1971), and Revision of the Guayana Highland Bromeliaceae (Smith 1986). The checklist ofVenezuelan Bromeliaceae pre Several additional country records were reported sented below (Appendix 1) adds three genera in works by Smith and Read (1982), Luther (Brewcaria, Neoregelia, and Steyerbromelia) and (1984), Morillo (1986), and Oliva-Esteva and 71 species to the totals for the country since the Steyermark (1987). Author abbreviations used last summary of Venezuelan bromeliads in the in the checklist follow Brummit and Powell Flora de Venezuela series which contained 293 (1992). -

Bromeliaceae) Como Subsídio Para Conservação E Reintrodução De Populações Extintas Na Natureza
Biologia reprodutiva e diversidade genética de Dyckia distachya Hassler (Bromeliaceae) como subsídio para conservação e reintrodução de populações extintas na natureza Manuela Boleman Wiesbauer i Universidade Federal de Santa Catarina Centro de Ciências Agrárias Programa de Pós-Graduação em Recursos Genéticos Vegetais Biologia reprodutiva e diversidade genética de Dyckia distachya Hassler (Bromeliaceae) como subsídio para conservação e reintrodução de populações extintas na natureza Manuela Boleman Wiesbauer Orientador: Ademir Reis Co-orientador: Maurício Sedrez dos Reis Dissertação apresentada ao Programa de Pós-Graduação em Recursos Genéticos Vegetais da Universidade Federal de Santa Catarina, como requisito para a obtenção do título de Mestre em Recursos Genéticos Vegetais Florianópolis Santa Catarina – Brasil 2008 ii Catalogação na fonte pela Biblioteca Universitária da Universidade Federal de Santa Catarina W649b Wiesbauer, Manuela Boleman . Biologia reprodutiva e diversidade genética de Dyckia distachya Hassler (Bromeliaceae) como subsídio para conservação e reintrodução de populações extintas na natureza [dissertação] / Manuela Boleman Wiesbauer ; orientador, Ademir Reis. - Florianópolis, SC, 2008. 94 f.: il., grafs., tabs., mapas Dissertação (mestrado) - Universidade Federal de Santa Catarina, Centro de Ciências Agrárias. Programa de Pós-Graduação em Recursos Genéticos Vegetais. Inclui referências 1. Recursos genéticos vegetais. 2. Endogamia. 3. Planta reófita. 4. Espécie ameaçada de extinção. 5. Auto - Incompatibilidade. I. Reis, Ademir. II. Universidade Federal de Santa Catarina. Programa de Pós-Graduação em Recursos Genéticos Vegetais. III. Título. CDU 631 iii iv v DEDICATÓRIA Dedico esta dissertação a todos aqueles envolvidos com esta longa história chamada Dyckia distachya . Dedico primeiramente aos amantes da Botânica que curiosos descreveram a espécie, coletaram. Imagine naquelas épocas... sem herbários on line . -

The Florida East Coast Bromeliad Society June 2014
1 The Florida East Coast Bromeliad Society June 2014 The Florida East Coast Bromeliad Society Next meeting Sunday, June 8th, 2014 1:30pm. Colony in the Wood – club house 4000 S. Clyde Morris Blvd., Port Orange 32129 June 2014 Summertime is the Right Time… President – Jay Thurrott 386/761-4804 Vice President – Bill Hazard 386/882-3850 Secretary – Jillian Ragia 386/801-2500 Treasurer – Eve Krauth 386/763-2084 ________________________________________________________________________________ When is a good time to separate bromeliad to do it, but somehow Tree managed to pups? When should we repot existing prepare and orchestrate placement of many bromeliads – either to a larger pot size or just of the refreshments for the meeting while to replace the “worn-out” potting mix? When visiting with family for Mothers Day at the are the oak tree leaves finally going to stop same time as the meeting. That’s an example falling into my bromeliads so I can clean all of ‘multi-tasking’ at its best and our sincerest of the fallen debris out of the leaf axils? That thanks go Tree and Bill for their hard work in time is here! It’s summertime and if you plan hosting our May FECBS meeting! Everyone your workdays in the garden so that you can “ooh’d” and “aaaah’d” over the use of avoid the mid-day heat of Florida’s summer, bromeliads in the landscaping and many you can accomplish a lot in the garden. went home with plants that Bill had so Summer in Northeast Florida is when our generously donated for the raffle. -

GENOME EVOLUTION in MONOCOTS a Dissertation
GENOME EVOLUTION IN MONOCOTS A Dissertation Presented to The Faculty of the Graduate School At the University of Missouri In Partial Fulfillment Of the Requirements for the Degree Doctor of Philosophy By Kate L. Hertweck Dr. J. Chris Pires, Dissertation Advisor JULY 2011 The undersigned, appointed by the dean of the Graduate School, have examined the dissertation entitled GENOME EVOLUTION IN MONOCOTS Presented by Kate L. Hertweck A candidate for the degree of Doctor of Philosophy And hereby certify that, in their opinion, it is worthy of acceptance. Dr. J. Chris Pires Dr. Lori Eggert Dr. Candace Galen Dr. Rose‐Marie Muzika ACKNOWLEDGEMENTS I am indebted to many people for their assistance during the course of my graduate education. I would not have derived such a keen understanding of the learning process without the tutelage of Dr. Sandi Abell. Members of the Pires lab provided prolific support in improving lab techniques, computational analysis, greenhouse maintenance, and writing support. Team Monocot, including Dr. Mike Kinney, Dr. Roxi Steele, and Erica Wheeler were particularly helpful, but other lab members working on Brassicaceae (Dr. Zhiyong Xiong, Dr. Maqsood Rehman, Pat Edger, Tatiana Arias, Dustin Mayfield) all provided vital support as well. I am also grateful for the support of a high school student, Cady Anderson, and an undergraduate, Tori Docktor, for their assistance in laboratory procedures. Many people, scientist and otherwise, helped with field collections: Dr. Travis Columbus, Hester Bell, Doug and Judy McGoon, Julie Ketner, Katy Klymus, and William Alexander. Many thanks to Barb Sonderman for taking care of my greenhouse collection of many odd plants brought back from the field. -

Mexican Bromeliad Weevil (Suggested Common Name), Metamasius Callizona (Chevrolat) (Insecta: Coleoptera: Curculionidae)1 Barba Larson and J
EENY161 Mexican Bromeliad Weevil (suggested common name), Metamasius callizona (Chevrolat) (Insecta: Coleoptera: Curculionidae)1 Barba Larson and J. Howard Frank2 Barber, the smallest of the three and native to Florida, Cuba, and the Dominican Republic, has been collected in Florida infrequently. Unlike Metamasius callizona, its presence does not threaten populations of native bromeli- ads in Florida’s natural areas. The third species, Metamasius hempipterus sericeus (Olivier), was first reported in Florida in Miami-Dade County in 1984 and has since become an important pest of sugarcane, bananas, and ornamental palms. Figure 1. Tillandsia utriculata (L.), a bromeliad species endangered in Florida due to attack by Metamasius callizona (Chevrolat), in the Fakahatchee Strand State Preserve, Collier County, 1993. Credits: H. Nadel, University of Florida Introduction and History Metamasius callizona (Chevrolat) has no accepted common name, but it has been referred to as the “Evil Weevil” by bromeliad enthusiasts throughout Florida, as a result of the destruction it has caused to native populations of bromeli- ads in the southern portion of the state. A member of the Figure 2. Guzmania monostachia (L.), one of Florida’s rare and weevil family Curculionidae, it is one of three species of the endangered species of bromeliads, in the Fakahatchee Strand State genus Metamasius present in Florida. Metamasius mosieri Preserve, Collier County, 1999. Credits: J.H. Frank, University of Florida 1. This document is EENY161, one of a series of the Entomology and Nematology Department, UF/IFAS Extension. Original publication date October 2000. Revised October 2000, April 2009, February 2016, April 2016, and February 2019. Visit the EDIS website at https://edis.ifas.ufl.edu. -

Floristic Composition of a Neotropical Inselberg from Espírito Santo State, Brazil: an Important Area for Conservation
13 1 2043 the journal of biodiversity data 11 February 2017 Check List LISTS OF SPECIES Check List 13(1): 2043, 11 February 2017 doi: https://doi.org/10.15560/13.1.2043 ISSN 1809-127X © 2017 Check List and Authors Floristic composition of a Neotropical inselberg from Espírito Santo state, Brazil: an important area for conservation Dayvid Rodrigues Couto1, 6, Talitha Mayumi Francisco2, Vitor da Cunha Manhães1, Henrique Machado Dias4 & Miriam Cristina Alvarez Pereira5 1 Universidade Federal do Rio de Janeiro, Museu Nacional, Programa de Pós-Graduação em Botânica, Quinta da Boa Vista, CEP 20940-040, Rio de Janeiro, RJ, Brazil 2 Universidade Estadual do Norte Fluminense Darcy Ribeiro, Laboratório de Ciências Ambientais, Programa de Pós-Graduação em Ecologia e Recursos Naturais, Av. Alberto Lamego, 2000, CEP 29013-600, Campos dos Goytacazes, RJ, Brazil 4 Universidade Federal do Espírito Santo (CCA/UFES), Centro de Ciências Agrárias, Departamento de Ciências Florestais e da Madeira, Av. Governador Lindemberg, 316, CEP 28550-000, Jerônimo Monteiro, ES, Brazil 5 Universidade Federal do Espírito Santo (CCA/UFES), Centro de Ciências Agrárias, Alto Guararema, s/no, CEP 29500-000, Alegre, ES, Brazil 6 Corresponding author. E-mail: [email protected] Abstract: Our study on granitic and gneissic rock outcrops environmental filters (e.g., total or partial absence of soil, on Pedra dos Pontões in Espírito Santo state contributes to low water retention, nutrient scarcity, difficulty in affixing the knowledge of the vascular flora of inselbergs in south- roots, exposure to wind and heat) that allow these areas eastern Brazil. We registered 211 species distributed among to support a highly specialized flora with sometimes high 51 families and 130 genera. -

Water Relations of Bromeliaceae in Their Evolutionary Context
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by Apollo Botanical Journal of the Linnean Society, 2016, 181, 415–440. With 2 figures Think tank: water relations of Bromeliaceae in their evolutionary context JAMIE MALES* Department of Plant Sciences, University of Cambridge, Downing Street, Cambridge CB2 3EA, UK Received 31 July 2015; revised 28 February 2016; accepted for publication 1 March 2016 Water relations represent a pivotal nexus in plant biology due to the multiplicity of functions affected by water status. Hydraulic properties of plant parts are therefore likely to be relevant to evolutionary trends in many taxa. Bromeliaceae encompass a wealth of morphological, physiological and ecological variations and the geographical and bioclimatic range of the family is also extensive. The diversification of bromeliad lineages is known to be correlated with the origins of a suite of key innovations, many of which relate directly or indirectly to water relations. However, little information is known regarding the role of change in morphoanatomical and hydraulic traits in the evolutionary origins of the classical ecophysiological functional types in Bromeliaceae or how this role relates to the diversification of specific lineages. In this paper, I present a synthesis of the current knowledge on bromeliad water relations and a qualitative model of the evolution of relevant traits in the context of the functional types. I use this model to introduce a manifesto for a new research programme on the integrative biology and evolution of bromeliad water-use strategies. The need for a wide-ranging survey of morphoanatomical and hydraulic traits across Bromeliaceae is stressed, as this would provide extensive insight into structure– function relationships of relevance to the evolutionary history of bromeliads and, more generally, to the evolutionary physiology of flowering plants. -

An Alphabetical List of Bromeliad Binomials
AN ALPHABETICAL LIST OF BROMELIAD BINOMIALS Compiled by HARRY E. LUTHER The Marie Selby Botanical Gardens Sarasota, Florida, USA ELEVENTH EDITION Published by the Bromeliad Society International June 2008 ii INTRODUCTION TO EDITION XI This list is presented as a spelling guide for validly published taxa accepted at the Bromeliad Identification Center. The list contains the following information: 1) Genus number (the left-hand number) based on the systematic sequence published in the Smith & Downs monograph: Bromeliaceae (Flora Neotropica, number 14, parts 1-3; 1974, 1977, 1979). Whole numbers are as published in the monograph. 2) Species number (the second number) according to its systematic position in the monograph. Note: Taxa not included in the monograph or that have been reclassified have been assigned numbers to reflect their systematic position within the Smith & Downs framework (e.g., taxon 14.1 is related to taxon 14). The utility of this method is that one may assume for example that Tillandsia comarapaensis (150.2) is related to T. didisticha (150) and therefore may have certain horticultural qualities in common with that species. 3) Genus and species names follow the respective numbers. 4) Subspecific taxa (subspecies, varieties, forms) names are indented below the species names. Note: Variety "a" (the type variety) is not listed unless it contains a form (see Aechmea caudata ). Similarly, the type form is not listed. 5) Author name follows the specific and subspecific names. These names are included for the convenience of specialist users of the list. This list does not contain publication data or synonymy, as it is not our intent for it to be a technical nomenclatural guide. -

Nematoides Associados a Fitotelma De Bromélias No Ecossistema De Restinga: Fatores Que Afetam a Estrutura Das Comunidades
NEMATOIDES ASSOCIADOS A FITOTELMA DE BROMÉLIAS NO ECOSSISTEMA DE RESTINGA: FATORES QUE AFETAM A ESTRUTURA DAS COMUNIDADES ALEXANDRE MACEDO ALMEIDA CAMPOS DOS GOYTACAZES - RJ JUNHO 2017 NEMATOIDES ASSOCIADOS A FITOTELMA DE BROMÉLIAS NO ECOSSISTEMA DE RESTINGA: FATORES QUE AFETAM A ESTRUTURA DAS COMUNIDADES ALEXANDRE MACEDO ALMEIDA Tese apresentada ao Centro de Ciências e Tecnologias Agropecuárias da Universidade Estadual do Norte Fluminense Darcy Ribeiro, como parte das exigências para obtenção do título de Doutor em Produção Vegetal Orientador: Prof. Ricardo Moreira de Souza CAMPOS DOS GOYTACAZES-RJ JUNHO 2017 NEMATOIDES ASSOCIADOS A FITOTELMA DE BROMÉLIAS NO ECOSSISTEMA DE RESTINGA: FATORES QUE AFETAM A ESTRUTURA DAS COMUNIDADES ALEXANDRE MACEDO ALMEIDA Tese apresentada ao Centro de Ciências e Tecnologias Agropecuárias da Universidade Estadual do Norte Fluminense Darcy Ribeiro, como parte das exigências para obtenção do título de Doutor em Produção Vegetal Aprovada em: 30 de junho de 2017. Comissão examinadora: ________________________________________________ Prof. Vicente Martins Gomes (D.Sc. Produção Vegetal) - IFF ________________________________________________ Prof. Claudia de Melo Dolinski (Ph.D. Fitopatologia) - UENF ______________________________________________ Vicente Mussi-Dias (D.Sc. Produção Vegetal) - UENF _________________________________________________ Prof. Ricardo Moreira de Souza (Ph.D. Fitopatologia) - UENF Orientador ii DEDICATÓRIA A DEUS, Que me deu força, determinação e perseverança para prosseguir com meus trabalhos -
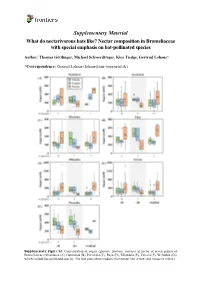
Supplementary Material What Do Nectarivorous Bats Like? Nectar Composition in Bromeliaceae with Special Emphasis on Bat-Pollinated Species
Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S1: Concentration of sugars (glucose, fructose, sucrose) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)) which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S2: Concentration of amino acids (ala, arg, asn, asp, gaba, gln, glu, gly, his, iso, leu, lys, met, phe, pro, ser, thr, trp, tyr, val) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S3: Cation concentrations (Ca2+, K+, Na+, Mg2+) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box).