Final Trabajo Indd.Indd
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Some Aspects of the Biology of Three Northwestern Atlantic Chitons
University of New Hampshire University of New Hampshire Scholars' Repository Doctoral Dissertations Student Scholarship Spring 1978 SOME ASPECTS OF THE BIOLOGY OF THREE NORTHWESTERN ATLANTIC CHITONS: TONICELLA RUBRA, TONICELLA MARMOREA, AND ISCHNOCHITON ALBUS (MOLLUSCA: POLYPLACOPHORA) PAUL DAVID LANGER University of New Hampshire, Durham Follow this and additional works at: https://scholars.unh.edu/dissertation Recommended Citation LANGER, PAUL DAVID, "SOME ASPECTS OF THE BIOLOGY OF THREE NORTHWESTERN ATLANTIC CHITONS: TONICELLA RUBRA, TONICELLA MARMOREA, AND ISCHNOCHITON ALBUS (MOLLUSCA: POLYPLACOPHORA)" (1978). Doctoral Dissertations. 2329. https://scholars.unh.edu/dissertation/2329 This Dissertation is brought to you for free and open access by the Student Scholarship at University of New Hampshire Scholars' Repository. It has been accepted for inclusion in Doctoral Dissertations by an authorized administrator of University of New Hampshire Scholars' Repository. For more information, please contact [email protected]. INFORMATION TO USERS This material was produced from a microfilm copy of the original document. While the most advanced technological means to photograph and reproduce this document have been used, the quality is heavily dependent upon the quality of the original submitted. The following explanation of techniques is provided to help you understand markings or patterns which may appear on this reproduction. 1.The sign or "target" for pages apparently lacking from the document photographed is "Missing Page(s)". If it was possible to obtain the missing page(s) or section, they are spliced into the film along with adjacent pages. This may have necessitated cutting thru an image and duplicating adjacent pages to insure you complete continuity. 2. When an image on the film is obliterated with a large round black mark, it is an indication that the photographer suspected that the copy may have moved during exposure and thus cause a blurred image. -
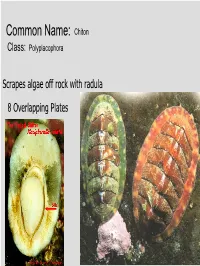
Common Name: Chiton Class: Polyplacophora
Common Name: Chiton Class: Polyplacophora Scrapes algae off rock with radula 8 Overlapping Plates Phylum? Mollusca Class? Gastropoda Common name? Brown sea hare Class? Scaphopoda Common name? Tooth shell or tusk shell Mud Tentacle Foot Class? Gastropoda Common name? Limpet Phylum? Mollusca Class? Bivalvia Class? Gastropoda Common name? Brown sea hare Phylum? Mollusca Class? Gastropoda Common name? Nudibranch Class? Cephalopoda Cuttlefish Octopus Squid Nautilus Phylum? Mollusca Class? Gastropoda Most Bivalves are Filter Feeders A B E D C • A: Mantle • B: Gill • C: Mantle • D: Foot • E: Posterior adductor muscle I.D. Green: Foot I.D. Red Gills Three Body Regions 1. Head – Foot 2. Visceral Mass 3. Mantle A B C D • A: Radula • B: Mantle • C: Mouth • D: Foot What are these? Snail Radulas Dorsal HingeA Growth line UmboB (Anterior) Ventral ByssalC threads Mussel – View of Outer Shell • A: Hinge • B: Umbo • C: Byssal threads Internal Anatomy of the Bay Mussel A B C D • A: Labial palps • B: Mantle • C: Foot • D: Byssal threads NacreousB layer Posterior adductorC PeriostracumA muscle SiphonD Mantle Byssal threads E Internal Anatomy of the Bay Mussel • A: Periostracum • B: Nacreous layer • C: Posterior adductor muscle • D: Siphon • E: Mantle Byssal gland Mantle Gill Foot Labial palp Mantle Byssal threads Gill Byssal gland Mantle Foot Incurrent siphon Byssal Labial palp threads C D B A E • A: Foot • B: Gills • C: Posterior adductor muscle • D: Excurrent siphon • E: Incurrent siphon Heart G F H E D A B C • A: Foot • B: Gills • C: Mantle • D: Excurrent siphon • E: Incurrent siphon • F: Posterior adductor muscle • G: Labial palps • H: Anterior adductor muscle Siphon or 1. -

Inventario De Invertebrados De La Zona Rocosa Intermareal De Montepío, Veracruz, México
Revista Mexicana de Biodiversidad 85: 349-362, 2014 Revista Mexicana de Biodiversidad 85: 349-362, 2014 DOI: 10.7550/rmb.42628 DOI: 10.7550/rmb.42628349 Inventario de invertebrados de la zona rocosa intermareal de Montepío, Veracruz, México Inventory of invertebrates from the rocky intertidal shore at Montepío, Veracruz, Mexico Aurora Vassallo, Yasmín Dávila, Nelia Luviano, Sara Deneb-Amozurrutia, Xochitl Guadalupe Vital, Carlos Andrés Conejeros, Leopoldo Vázquez y Fernando Álvarez Colección Nacional de Crustáceos, Instituto de Biología, Universidad Nacional Autónoma de México. Apartado postal 70-153, 04510 México, D. F., México. [email protected] Resumen. Se presenta el registro de las especies de invertebrados marinos que habitan la costa rocosa intermareal de Montepío, Veracruz, identificados hasta ahora. La información se obtuvo de las colectas realizadas en los últimos 10 años por parte de la Colección Nacional de Crustáceos y los registros adicionales se obtuvieron de la información publicada. El listado de especies incluye las formas de vida en relación con el sustrato, criptofauna o epifauna, así como su tipo de distribución en las 2 principales regiones zoogeográficas marinas para el golfo de México: Carolineana y Caribeña; se incluyen también las especies que sólo se encuentran en el golfo de México. El listado incluye 195 especies pertenecientes a 9 grupos, de los cuales Crustacea es el más diverso con 73 especies, seguido por Mollusca con 69 y Echinodermata con 18; los grupos con menor riqueza específica fueron: Chelicerata con 2 especies y Platyhelminthes y Sipuncula con una sola especie cada grupo. Del total de especies 74 son nuevos registros de localidad y 7 nuevos registros para Veracruz. -

Crepidula Fornicata
NOBANIS - Marine invasive species in Nordic waters - Fact Sheet Crepidula fornicata Author of this species fact sheet: Kathe R. Jensen, Zoological Museum, Natural History Museum of Denmark, Universiteteparken 15, 2100 København Ø, Denmark. Phone: +45 353-21083, E-mail: [email protected] Bibliographical reference – how to cite this fact sheet: Jensen, Kathe R. (2010): NOBANIS – Invasive Alien Species Fact Sheet – Crepidula fornicata – From: Identification key to marine invasive species in Nordic waters – NOBANIS www.nobanis.org, Date of access x/x/201x. Species description Species name Crepidula fornicata, Linnaeus, 1758 – Slipper limpet Synonyms Patella fornicata Linnaeus, 1758; Crepidula densata Conrad, 1871; Crepidula virginica Conrad, 1871; Crepidula maculata Rigacci, 1866; Crepidula mexicana Rigacci, 1866; Crepidula violacea Rigacci, 1866; Crepidula roseae Petuch, 1991; Crypta nautarum Mörch, 1877; Crepidula nautiloides auct. NON Lesson, 1834 (ISSG Database; Minchin, 2008). Common names Tøffelsnegl (DK, NO), Slipper limpet, American slipper limpet, Common slipper snail (UK, USA), Østerspest (NO), Ostronpest (SE), Amerikanische Pantoffelschnecke (DE), La crépidule (FR), Muiltje (NL), Seba (E). Identification Crepidula fornicata usually sit in stacks on a hard substrate, e.g., a shell of other molluscs, boulders or rocky outcroppings. Up to 13 animals have been reported in one stack, but usually 4-6 animals are seen in a stack. Individual shells are up to about 60 mm in length, cap-shaped, distinctly longer than wide. The “spire” is almost invisible, slightly skewed to the right posterior end of the shell. Shell height is highly variable. Inside the body whorl is a characteristic calcareous shell-plate (septum) behind which the visceral mass is protected. -

Benthic Invertebrate Community Monitoring and Indicator Development for Barnegat Bay-Little Egg Harbor Estuary
July 15, 2013 Final Report Project SR12-002: Benthic Invertebrate Community Monitoring and Indicator Development for Barnegat Bay-Little Egg Harbor Estuary Gary L. Taghon, Rutgers University, Project Manager [email protected] Judith P. Grassle, Rutgers University, Co-Manager [email protected] Charlotte M. Fuller, Rutgers University, Co-Manager [email protected] Rosemarie F. Petrecca, Rutgers University, Co-Manager and Quality Assurance Officer [email protected] Patricia Ramey, Senckenberg Research Institute and Natural History Museum, Frankfurt Germany, Co-Manager [email protected] Thomas Belton, NJDEP Project Manager and NJDEP Research Coordinator [email protected] Marc Ferko, NJDEP Quality Assurance Officer [email protected] Bob Schuster, NJDEP Bureau of Marine Water Monitoring [email protected] Introduction The Barnegat Bay ecosystem is potentially under stress from human impacts, which have increased over the past several decades. Benthic macroinvertebrates are commonly included in studies to monitor the effects of human and natural stresses on marine and estuarine ecosystems. There are several reasons for this. Macroinvertebrates (here defined as animals retained on a 0.5-mm mesh sieve) are abundant in most coastal and estuarine sediments, typically on the order of 103 to 104 per meter squared. Benthic communities are typically composed of many taxa from different phyla, and quantitative measures of community diversity (e.g., Rosenberg et al. 2004) and the relative abundance of animals with different feeding behaviors (e.g., Weisberg et al. 1997, Pelletier et al. 2010), can be used to evaluate ecosystem health. Because most benthic invertebrates are sedentary as adults, they function as integrators, over periods of months to years, of the properties of their environment. -

Marine Invertebrate Field Guide
Marine Invertebrate Field Guide Contents ANEMONES ....................................................................................................................................................................................... 2 AGGREGATING ANEMONE (ANTHOPLEURA ELEGANTISSIMA) ............................................................................................................................... 2 BROODING ANEMONE (EPIACTIS PROLIFERA) ................................................................................................................................................... 2 CHRISTMAS ANEMONE (URTICINA CRASSICORNIS) ............................................................................................................................................ 3 PLUMOSE ANEMONE (METRIDIUM SENILE) ..................................................................................................................................................... 3 BARNACLES ....................................................................................................................................................................................... 4 ACORN BARNACLE (BALANUS GLANDULA) ....................................................................................................................................................... 4 HAYSTACK BARNACLE (SEMIBALANUS CARIOSUS) .............................................................................................................................................. 4 CHITONS ........................................................................................................................................................................................... -

Marine Ecology Progress Series 464:135
Vol. 464: 135–151, 2012 MARINE ECOLOGY PROGRESS SERIES Published September 19 doi: 10.3354/meps09872 Mar Ecol Prog Ser Physical and biological factors affect the vertical distribution of larvae of benthic gastropods in a shallow embayment Michelle J. Lloyd1,*, Anna Metaxas1, Brad deYoung2 1Department of Oceanography, Dalhousie University, Halifax, Nova Scotia, Canada B3H 4R2 2Department of Physics and Physical Oceanography, Memorial University, St. John’s, Newfoundland, Canada A1B 3X7 ABSTRACT: Marine gastropods form a diverse taxonomic group, yet little is known about the factors that affect their larval distribution and abundance. We investigated the larval vertical dis- tribution and abundance of 9 meroplanktonic gastropod taxa (Margarites spp., Crepidula spp., Astyris lunata, Diaphana minuta, Littorinimorpha, Arrhoges occidentalis, Ilyanassa spp., Bittiolum alternatum and Nudibranchia), with similar morphology and swimming abilities, but different adult habitats and life-history strategies. We explored the role of physical (temperature, salinity, density, current velocities) and biological (fluorescence) factors, as well as periodic cycles (lunar phase, tidal state, diel period) in regulating larval vertical distribution. Using a pump, we collected plankton samples at 6 depths (3, 6, 9, 12, 18 and 24 m) at each tidal state, every 2 h over a 36 and a 26 h period, during a spring and neap tide, respectively, in St. George’s Bay, Nova Scotia. Con- currently, we measured temperature, salinity, density, fluorescence (as a proxy for chlorophyll, i.e. phytoplankton density), and current velocity. Larval abundance was most strongly related to tem- perature, except for Littorinimorpha and Crepidula spp., for which it was most strongly related to fluorescence. Margarites spp., A. -

The Malacological Society of London
ACKNOWLEDGMENTS This meeting was made possible due to generous contributions from the following individuals and organizations: Unitas Malacologica The program committee: The American Malacological Society Lynn Bonomo, Samantha Donohoo, The Western Society of Malacologists Kelly Larkin, Emily Otstott, Lisa Paggeot David and Dixie Lindberg California Academy of Sciences Andrew Jepsen, Nick Colin The Company of Biologists. Robert Sussman, Allan Tina The American Genetics Association. Meg Burke, Katherine Piatek The Malacological Society of London The organizing committee: Pat Krug, David Lindberg, Julia Sigwart and Ellen Strong THE MALACOLOGICAL SOCIETY OF LONDON 1 SCHEDULE SUNDAY 11 AUGUST, 2019 (Asilomar Conference Center, Pacific Grove, CA) 2:00-6:00 pm Registration - Merrill Hall 10:30 am-12:00 pm Unitas Malacologica Council Meeting - Merrill Hall 1:30-3:30 pm Western Society of Malacologists Council Meeting Merrill Hall 3:30-5:30 American Malacological Society Council Meeting Merrill Hall MONDAY 12 AUGUST, 2019 (Asilomar Conference Center, Pacific Grove, CA) 7:30-8:30 am Breakfast - Crocker Dining Hall 8:30-11:30 Registration - Merrill Hall 8:30 am Welcome and Opening Session –Terry Gosliner - Merrill Hall Plenary Session: The Future of Molluscan Research - Merrill Hall 9:00 am - Genomics and the Future of Tropical Marine Ecosystems - Mónica Medina, Pennsylvania State University 9:45 am - Our New Understanding of Dead-shell Assemblages: A Powerful Tool for Deciphering Human Impacts - Sue Kidwell, University of Chicago 2 10:30-10:45 -

Hidrobiológica 2020, 30 (1): 73-92
Hidrobiológica 2020, 30 (1): 73-92 OPEN ACCESS HIDROBIOLÓGICA Research Article http:/hidrobiologica.izt.uam.mx April, 2020 ISSN: 2448-7333 Macroinvertebrados bentónicos asociados a Thalassia testudinum (HYDROCHARITACEAE), en el nororiente de Venezuela Benthic macroinvertebrates associated with Thalassia testudinum (HYDROCHARITACEAE), in northeastern Venezuela Erickxander Jiménez-Ramos1,2 y Vanessa Acosta-Balbás1,3 Recibido: 12 de enero de 2020. Aceptado: 04 de febrero de 2020. Publicado: abril de 2020. RESUMEN Antecedentes. Las praderas de Thalassia testudinum constituyen un ecosistema productivo y biodiver- so, especialmente en la región del Caribe, donde los estudios se han enfocado principalmente en evaluar organismos de interés comercial. Objetivo. Identificar la fauna macrobentónica asociada a praderas deT. testudinum y describir sus cambios espacio-temporales en relación a los parámetros físico-biológicos y ca- racterísticas granulométricas del sedimento. Materiales y métodos. Los muestreos se efectuaron bimestral- 1 Laboratorio de Ecología, Departamento mente (enero-noviembre de 2017), en el eje costero del complejo lagunar Chacopata-Bocaripo. Se tomaron de Biología, Escuela de Ciencias, Univer- registros de temperatura, salinidad, clorofilaa y seston total, así como las características granulométricas y sidad de Oriente (UDO). Cerro Colorado, niveles de materia orgánica del sedimento. Los organismos recolectados fueron identificados, cuantificados Cumaná, Estado Sucre, 6101. Venezuela. y pesados. Resultados. Los parámetros ambientales no mostraron variaciones espacio-temporales. En el sedimento predominaron arenas finas, muy finas y limosas, sin variabilidad espacial y con cambios tempo- rales a partir de mayo hasta noviembre. La materia orgánica fue mayor al 7%, con tendencia al aumento en 2 Coordinación de Proyectos de Investiga- el tiempo e igual comportamiento en todas las estaciones. -

Download Preprint
1 Mobilising molluscan models and genomes in biology 2 Angus Davison1 and Maurine Neiman2 3 1. School of Life Sciences, University Park, University of Nottingham, NG7 2RD, UK 4 2. Department of Biology, University of Iowa, Iowa City, IA, USA and Department of Gender, 5 Women's, and Sexuality Studies, University of Iowa, Iowa, City, IA, USA 6 Abstract 7 Molluscs are amongst the most ancient, diverse, and important of all animal taxa. Even so, 8 no individual mollusc species has emerged as a broadly applied model system in biology. 9 We here make the case that both perceptual and methodological barriers have played a role 10 in the relative neglect of molluscs as research organisms. We then summarize the current 11 application and potential of molluscs and their genomes to address important questions in 12 animal biology, and the state of the field when it comes to the availability of resources such 13 as genome assemblies, cell lines, and other key elements necessary to mobilising the 14 development of molluscan model systems. We conclude by contending that a cohesive 15 research community that works together to elevate multiple molluscan systems to ‘model’ 16 status will create new opportunities in addressing basic and applied biological problems, 17 including general features of animal evolution. 18 Introduction 19 Molluscs are globally important as sources of food, calcium and pearls, and as vectors of 20 human disease. From an evolutionary perspective, molluscs are notable for their remarkable 21 diversity: originating over 500 million years ago, there are over 70,000 extant mollusc 22 species [1], with molluscs present in virtually every ecosystem. -

(Approx) Mixed Micro Shells (22G Bags) Philippines € 10,00 £8,64 $11,69 Each 22G Bag Provides Hours of Fun; Some Interesting Foraminifera Also Included
Special Price £ US$ Family Genus, species Country Quality Size Remarks w/o Photo Date added Category characteristic (€) (approx) (approx) Mixed micro shells (22g bags) Philippines € 10,00 £8,64 $11,69 Each 22g bag provides hours of fun; some interesting Foraminifera also included. 17/06/21 Mixed micro shells Ischnochitonidae Callistochiton pulchrior Panama F+++ 89mm € 1,80 £1,55 $2,10 21/12/16 Polyplacophora Ischnochitonidae Chaetopleura lurida Panama F+++ 2022mm € 3,00 £2,59 $3,51 Hairy girdles, beautifully preserved. Web 24/12/16 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 30mm+ € 4,00 £3,45 $4,68 30/04/21 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 27.9mm € 2,80 £2,42 $3,27 30/04/21 Polyplacophora Ischnochitonidae Stenoplax limaciformis Panama F+++ 16mm+ € 6,50 £5,61 $7,60 Uncommon. 24/12/16 Polyplacophora Chitonidae Acanthopleura gemmata Philippines F+++ 25mm+ € 2,50 £2,16 $2,92 Hairy margins, beautifully preserved. 04/08/17 Polyplacophora Chitonidae Acanthopleura gemmata Australia F+++ 25mm+ € 2,60 £2,25 $3,04 02/06/18 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 41mm+ € 4,00 £3,45 $4,68 West Indian 'fuzzy' chiton. Web 24/12/16 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 32mm+ € 3,00 £2,59 $3,51 West Indian 'fuzzy' chiton. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 44mm+ € 5,00 £4,32 $5,85 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F++ 35mm € 2,50 £2,16 $2,92 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 29mm+ € 3,00 £2,59 $3,51 Caribbean. -

Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora)
Gulf of Mexico Science Volume 34 Article 4 Number 1 Number 1/2 (Combined Issue) 2018 Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Laguna Madre, Tamaulipas, Mexico: Spatial and Temporal Distribution Martha Reguero Universidad Nacional Autónoma de México Andrea Raz-Guzmán Universidad Nacional Autónoma de México DOI: 10.18785/goms.3401.04 Follow this and additional works at: https://aquila.usm.edu/goms Recommended Citation Reguero, M. and A. Raz-Guzmán. 2018. Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Laguna Madre, Tamaulipas, Mexico: Spatial and Temporal Distribution. Gulf of Mexico Science 34 (1). Retrieved from https://aquila.usm.edu/goms/vol34/iss1/4 This Article is brought to you for free and open access by The Aquila Digital Community. It has been accepted for inclusion in Gulf of Mexico Science by an authorized editor of The Aquila Digital Community. For more information, please contact [email protected]. Reguero and Raz-Guzmán: Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Lagu Gulf of Mexico Science, 2018(1), pp. 32–55 Molluscs (Mollusca: Gastropoda, Bivalvia, Polyplacophora) of Laguna Madre, Tamaulipas, Mexico: Spatial and Temporal Distribution MARTHA REGUERO AND ANDREA RAZ-GUZMA´ N Molluscs were collected in Laguna Madre from seagrass beds, macroalgae, and bare substrates with a Renfro beam net and an otter trawl. The species list includes 96 species and 48 families. Six species are dominant (Bittiolum varium, Costoanachis semiplicata, Brachidontes exustus, Crassostrea virginica, Chione cancellata, and Mulinia lateralis) and 25 are commercially important (e.g., Strombus alatus, Busycoarctum coarctatum, Triplofusus giganteus, Anadara transversa, Noetia ponderosa, Brachidontes exustus, Crassostrea virginica, Argopecten irradians, Argopecten gibbus, Chione cancellata, Mercenaria campechiensis, and Rangia flexuosa).