Juliana Lima Lázaro
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Marine and Brackish Water Mollusca of the State of Mississippi
Gulf and Caribbean Research Volume 1 Issue 1 January 1961 The Marine and Brackish Water Mollusca of the State of Mississippi Donald R. Moore Gulf Coast Research Laboratory Follow this and additional works at: https://aquila.usm.edu/gcr Recommended Citation Moore, D. R. 1961. The Marine and Brackish Water Mollusca of the State of Mississippi. Gulf Research Reports 1 (1): 1-58. Retrieved from https://aquila.usm.edu/gcr/vol1/iss1/1 DOI: https://doi.org/10.18785/grr.0101.01 This Article is brought to you for free and open access by The Aquila Digital Community. It has been accepted for inclusion in Gulf and Caribbean Research by an authorized editor of The Aquila Digital Community. For more information, please contact [email protected]. Gulf Research Reports Volume 1, Number 1 Ocean Springs, Mississippi April, 1961 A JOURNAL DEVOTED PRIMARILY TO PUBLICATION OF THE DATA OF THE MARINE SCIENCES, CHIEFLY OF THE GULF OF MEXICO AND ADJACENT WATERS. GORDON GUNTER, Editor Published by the GULF COAST RESEARCH LABORATORY Ocean Springs, Mississippi SHAUGHNESSY PRINTING CO.. EILOXI, MISS. 0 U c x 41 f 4 21 3 a THE MARINE AND BRACKISH WATER MOLLUSCA of the STATE OF MISSISSIPPI Donald R. Moore GULF COAST RESEARCH LABORATORY and DEPARTMENT OF BIOLOGY, MISSISSIPPI SOUTHERN COLLEGE I -1- TABLE OF CONTENTS Introduction ............................................... Page 3 Historical Account ........................................ Page 3 Procedure of Work ....................................... Page 4 Description of the Mississippi Coast ....................... Page 5 The Physical Environment ................................ Page '7 List of Mississippi Marine and Brackish Water Mollusca . Page 11 Discussion of Species ...................................... Page 17 Supplementary Note ..................................... -
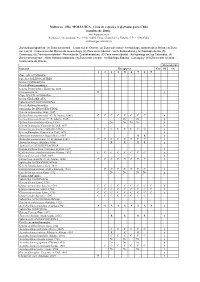
Moluscos - Filo MOLLUSCA
Moluscos - Filo MOLLUSCA. Lista de especies registradas para Cuba (octubre de 2006). José Espinosa Sáez Instituto de Oceanología, Ave 1ª No. 18406, Playa, Ciudad de La Habana, C.P. 11200, Cuba [email protected] Zonas biogeográficas: (1) Zona suroriental – Costa sur de Oriente, (2) Zona surcentral - Archipiélago Jardines de la Reina, (3) Zona sur central - Costa al sur del Macizo de Guamuhaya, (4) Zona suroccidental - Golfo de Batabanó y Archipiélago de los, (5) Canarreos, (6) Zona suroccidental - Península de Guanahacabibes, (7) Zona noroccidental - Archipiélago de Los Colorados, (8) Zona noroccidental - Norte Habana-Matanzas, (9) Zona norte-central - Archipiélago Sabana - Camagüey, (10) Zona norte-oriental - Costa norte de Oriente Abreviaturas Especies Bioegiones Cu Pl Oc 1 2 3 4 5 6 7 8 9 Clase APLACOPHORA Subclase SOLENOGASTRES Orden CAVIBELONIA Familia Proneomeniidae Género Proneomenia Hubrecht, 1880 Proneomenia sp . R x Clase POLYPLACOPHORA Orden NEOLORICATA Suborden ISCHNOCHITONINA Familia Ischnochitonidae Subfamilia ISCHNOCHITONINAE Género Ischnochiton Gray, 1847 Ischnochiton erythronotus (C. B. Adams, 1845) C C C C C C C C x Ischnochiton papillosus (C. B. Adams, 1845) Nc Nc x Ischnochiton striolatus (Gray, 1828) Nc Nc Nc Nc x Género Ischnoplax Carpenter in Dall, 1879 x Ischnoplax pectinatus (Sowerby, 1832) C C C C C C C C x Género Stenoplax Carpenter in Dall, 1879 x Stenoplax bahamensis Kaas y Belle, 1987 R R x Stenoplax purpurascens (C. B. Adams, 1845) C C C C C C C C x Stenoplax boogii (Haddon, 1886) R R R R x Subfamilia CALLISTOPLACINAE Género Callistochiton Carpenter in Dall, 1879 x Callistochiton shuttleworthianus Pilsbry, 1893 C C C C C C C C x Género Ceratozona Dall, 1882 x Ceratozona squalida (C. -

Sociedad Malacológica De Chile
AMICI MOLLUSCARUM Número 20(1), año 2012 Sociedad Malacológica de Chile AMICI MOLLUSCARUM Número 20(1)20(1),, año 2012012222 Amici Molluscarum es una revista de publicación anual bilingüe, editada por la Sociedad Malacológica de Chile (SMACH) desde el año 1992, siendo la continuación del boletín Comunicaciones , publicado entre 1979 y 1986. Cuenta con el patrocinio del Museo Nacional de Historia Natural de Chile (MNHNCL). Tiene el propósito de publicar artículos científicos originales, así como también comunicaciones breves (notas científicas), fichas de especies, comentarios de libros y revisiones en todos los ámbitos de la malacología. ISSN 07180718----97619761 (versión en línea) Los textos e ilustraciones contenidos en esta revista pueden reproducirse, siempre que se mencione su origen, indicando el nombre del autor o su procedencia, y se agregue el volumen y año de publicación. Imagen de la cubierta: Vista interna y externa de valva derecha de un ejemplar de Diplodon chilensis (D. Jackson y D. Jackson) Imagen de la contracubierta: Vista ventral y dorsal de Aylacostoma chloroticum (R.E. Vogler). Amici Molluscarum http://www.amicimolluscarum.com Sociedad Malacológica de Chile (SMACH) http://www.smach.cl AMICI MOLLUSCARUM Sociedad Malacológica de Chile (SMACH) Comité editorial Editor jefe Gonzalo Collado Universidad de Chile, Santiago, Chile Editor de producción Cristian Aldea Fundación CEQUA, Punta Arenas, Chile Editores asociados Omar Ávila-Poveda Universidad del Mar, Oaxaca, México Roberto Cipriani California State University, Fullerton, -

Diversity and Community Composition of Marine Mollusks Fauna on a Mainland Island of the Coast of Paraná, Southern Brazil
Pesquisa e Ensino em Ciências ISSN 2526-8236 (online edition) Exatas e da Natureza Pesquisa e Ensino em Ciências 2(1): 48–59 (2018) ARTICLE Research and Teaching in Exatas e da Natureza © 2018 UFCG / CFP / UACEN Exact and Natural Sciences Diversity and community composition of marine mollusks fauna on a mainland island of the coast of Paraná, southern Brazil Marcos de Vasconcellos Gernet1, Eduardo Colley2, Elizângela da Veiga Santos1,3 & Carlos João Birckolz1 (1) Universidade Federal do Paraná, Laboratório de Ecologia Aplicada e Bioinvasões, Rua Rio Grande do Norte 145, Mirassol 83255-000, Pontal do Paraná, Paraná, Brazil. E-mail: [email protected], [email protected] (2) Universidade de São Paulo, Museu de Zoologia, Avenida Nazaré 481, Ipiranga 04263-000, São Paulo, São Paulo, Brazil. E-mail: [email protected] (3) Universidade Federal do Paraná, Setor Litoral, Rua Jaguariaíva, 512, Caiobá 83260-000, Matinhos, Paraná, Brazil. E-mail: [email protected] Gernet M.V., Colley E., Santos E.V. & Birckolz C.J. (2018) Diversity and community composition of marine mollusks fauna on a mainland island of the coast of Paraná, southern Brazil. Pesquisa e Ensino em Ciências Exatas e da Natureza, 2(1): 48–59. http://dx.doi.org/10.29215/pecen.v2i1.580 Diversidade e composição da comunidade de moluscos marinhos de uma ilha continental do litoral do Paraná, sul do Brasil Resumo: A Ilha do Farol é uma ilha continental, no estado do Paraná, sul do Brasil. Devido à sua posição em relação ao continente, três ambientes distintos são observados nela: área de costão rochoso exposto ao mar aberto (A); área estuarina (B); área de praia arenosa (C). -

Checklist of Species Within the CCBNEP Study Area: References, Habitats, Distribution, and Abundance
Current Status and Historical Trends of the Estuarine Living Resources within the Corpus Christi Bay National Estuary Program Study Area Volume 4 of 4 Checklist of Species Within the CCBNEP Study Area: References, Habitats, Distribution, and Abundance Corpus Christi Bay National Estuary Program CCBNEP-06D • January 1996 This project has been funded in part by the United States Environmental Protection Agency under assistance agreement #CE-9963-01-2 to the Texas Natural Resource Conservation Commission. The contents of this document do not necessarily represent the views of the United States Environmental Protection Agency or the Texas Natural Resource Conservation Commission, nor do the contents of this document necessarily constitute the views or policy of the Corpus Christi Bay National Estuary Program Management Conference or its members. The information presented is intended to provide background information, including the professional opinion of the authors, for the Management Conference deliberations while drafting official policy in the Comprehensive Conservation and Management Plan (CCMP). The mention of trade names or commercial products does not in any way constitute an endorsement or recommendation for use. Volume 4 Checklist of Species within Corpus Christi Bay National Estuary Program Study Area: References, Habitats, Distribution, and Abundance John W. Tunnell, Jr. and Sandra A. Alvarado, Editors Center for Coastal Studies Texas A&M University - Corpus Christi 6300 Ocean Dr. Corpus Christi, Texas 78412 Current Status and Historical Trends of Estuarine Living Resources of the Corpus Christi Bay National Estuary Program Study Area January 1996 Policy Committee Commissioner John Baker Ms. Jane Saginaw Policy Committee Chair Policy Committee Vice-Chair Texas Natural Resource Regional Administrator, EPA Region 6 Conservation Commission Mr. -

Olivella Dama (Mawe)
ZOBODAT - www.zobodat.at Zoologisch-Botanische Datenbank/Zoological-Botanical Database Digitale Literatur/Digital Literature Zeitschrift/Journal: Spixiana, Zeitschrift für Zoologie Jahr/Year: 1981 Band/Volume: 004 Autor(en)/Author(s): Fechter Rosina [Ina] Artikel/Article: Olivella dama (Mawe) - ein panamaisches Element in der Indo- Pazifischen Faunenregion? (Mollusca, Gastropoda) 103-109 ©Zoologische Staatssammlung München;download: http://www.biodiversitylibrary.org/; www.biologiezentrum.at Spixiana ©Zoologische Staatssammlung München;download: http://www.biodiversitylibrary.org/; www.biologiezentrum.at Auch die Fundorte der Belegstücke aus der Zoologischen Staatssammlung München stammen ausschließlich aus diesem Gebiet: Pto. Penasco, Guaymas, San Felipe/Mexiko. Eine bemerkenswerte Notiz allerdings findet man im Martini-Chemnitz (1878); hier steht unter Vaterland: „Mazatlan (Carpenter), die anderen Fundorte Sud-Sea (Mawe), Ostindien (Duclos) sind sicher unrichtig" (Zitat). Diese Notiz bezieht sich auf die fol- genden beiden Werke: Die erstmahge Nominierung der Art von Mawe in Wood (1828), die stets als Originalbeschreibung zitiert wird, bringt lediglich die Angaben Voluta dama, fawn-spotted, habitat S. Sea und eine Abbildung auf Tafel 4. Ausführlicher ist dann die Art in der O/z^z^eZ/i^-Monographie von Duclos (1844-48) beschrieben; als Fund- ort für die in seiner Sammlung befindlichen Exemplare gibt er Ostindien an. Das würde also bedeuten, daß O. dama durchaus schon Anfang des vorigen Jahrhunderts im Indo- pazifik festgestellt worden war. Warum billigte man diesen Angaben jedoch damals keine Glaubwürdigkeit zu (siehe Martini-Chemnitz)? Geschah es aus der Überlegung heraus, daß die Art nach bestimmten Erwägungen in diesem Gebiet einfach nicht vorkommen kann und hat man daher diese nicht ins Konzept passenden Fundorte negiert, denn direkt widerlegt wurden sie nicht. -

Juliana Lima Lázaro
UNIVERSIDADE FEDERAL DA BAHIA ESCOLA POLITÉCNICA ANÁLISE DA ESTRUTURA QUALI-QUANTITATIVA ZOOBENTÔNICA DO MESOLITORAL DA BAÍA DE TODOS OS SANTOS (BA) E RELAÇÕES COM A CONTAMINAÇÃO QUÍMICA DOS SEDIMENTOS Juliana Lima Lázaro Dissertação apresentada a Escola Politécnica da Universidade Federal da Bahia como requisito parcial para a obtenção do título de Mestre em Meio Ambiente, Águas e Saneamento. Orientadora: Drª. Marlene Campos Peso de Aguiar SALVADOR 2013 UNIVERSIDADE FEDERAL DA BAHIA ESCOLA POLITÉCNICA ANÁLISE DA ESTRUTURA QUALI-QUANTITATIVA ZOOBENTÔNICA DO MESOLITORAL DA BAÍA DE TODOS OS SANTOS (BA) E RELAÇÕES COM A CONTAMINAÇÃO QUÍMICA DOS SEDIEMENTOS Juliana Lima Lázaro Dissertação apresentada a Escola Politécnica da Universidade Federal da Bahia como requisito parcial para a obtenção do título de Mestre em Meio Ambiente, Águas e Saneamento. Orientadora: Drª. Marlene Campos Peso de Aguiar SALVADOR 2013 Dedicatória Dedico aos meus pais que sempre me mostraram o valor do estudo. E aos meus grandes incentivos, Tiago, Pedro e Maria Clara. Agradecimentos Agradeço à Marlene Campos Peso de Aguiar pela dedicação e orientação ao longo destes anos de trabalho e aprendizado. À Fábio Suzart de Albuquerque pela generosidade de predispor dedicar seu tempo para ajudar ao próximo. À Ana Clara Jesus. Leda Maria Santa-Isabel, Rita Assis, professor Dr. Francisco Kelmo, Júlio César Fernandez, Tereza Cristina Almeida e Luciana Martins pela atenção dedicada. À Walter de Souza Andrade, você é realmente um amigo McGyver. Aos companheiros do LAMEB, André, Cássio Lins, Daniel, Celiane, Kamila, pela amizade que fez o trabalho ser mais divertido. À professora Maria da Graças Andrade Korn e aos seus parceiros do Grupo de Pesquisa em Química Analítica do Instituto de Química da UFBA pelas análises realizadas, fundamentais para a obtenção dos resultados encontrados. -

STUDIES on OLIVIDAE by Eveline and Ernesto Marcus
STUDIES ON OLIVIDAE by Eveline and Ernesto Marcus (with 11 plates) CONTENTS 1. Introduction ........................................................................................... 100 2. Classification of the material ....................................................... 101 3. Notes on living snails ......................................................................... 103 4. External features ............................................................................... 107 5. Mantle appendages ............................................................................. 109 6. Pedal glands O livella ................................................................................................... I l l O liva ......................................................................................................... 113 Lintricula .............................................................. 114 7. Central nervous system O livella ................................................................................................... 115 O liva ....................................................................................................... 118 Lintricula ............................................................................................... 119 8. Alimentary tract O livella ................................................................................................... 120 O liva ........................................................................................................ 120 Lintricula and Olivancillaria -

Labomar Programa De Pós-Graduação Em Ciências Marinhas Tropicais
UNIVERSIDADE FEDERAL DO CEARÁ INSTITUTO DE CIÊNCIAS DO MAR - LABOMAR PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS MARINHAS TROPICAIS CRISTIANE XEREZ BARROSO Gastrópodes prosobrânquios marinhos de fundos rasos do Brasil: composição e padrões biogeográficos FORTALEZA 2014 2 CRISTIANE XEREZ BARROSO Gastrópodes prosobrânquios marinhos de fundos rasos do Brasil: composição e padrões biogeográficos Tese submetida à Coordenação do Curso de Pós- Graduação em Ciências Marinhas Tropicais, da Universidade Federal do Ceará, como requisito parcial para a obtenção do grau de Doutor em Ciências Marinhas. Orientadora: Profa. Dra. Helena Matthews- Cascon Coorientador: Prof. Dr. Tito Monteiro da Cruz Lotufo FORTALEZA 2014 Dados Internacionais de Catalogação na Publicação Universidade Federal do Ceará Biblioteca Rui Simões de Menezes B285g Barroso, Cristiane Xerez. Gastrópodes prosobrânquios marinhos de fundos rasos do Brasil: composição e padrões biogeográficos / Cristiane Xerez Barroso. – 2014. 148 f.: il. color., enc. ; 30 cm. Tese (doutorado) – Universidade Federal do Ceará, Instituto de Ciências do Mar, Programa de Pós-Graduação em Ciências Marinhas Tropicais, Fortaleza, 2014. Área de Concentração: Utilização e Manejo de Ecossistemas Marinhos e Estuarinos. Orientação: Profª. Drª. Helena Matthews-Cascon. Co-Orientação: Profº. Drº. Tito Monteiro da Cruz Lotufo 1. Gastropoda. 2. Biogeografia – Atlântico Ocidental. I. Título. CDD 594.3 3 CRISTIANE XEREZ BARROSO Gastrópodes prosobrânquios marinhos de fundos rasos do Brasil: composição e padrões biogeográficos Tese submetida à Coordenação do Curso de Pós-Graduação em Ciências Marinhas Tropicais, da Universidade Federal do Ceará, como requisito parcial para a obtenção do grau de Doutor em Ciências Marinhas. Aprovada em: 06 de maio de 2014. BANCA EXAMINADORA _____________________________________________ Profa. Dra. Helena Matthews-Cascon (Orientadora) Universidade Federal do Ceará _____________________________________________ Prof. -

FMRI TR-3 Text
ISSN 1092-194X FLORIDA MARINE RESEARCH INSTITUTE TECHNICALTECHNICAL REPORTSREPORTS Checklists of Selected Shallow-Water Marine Invertebrates of Florida David K. Camp, William G. Lyons, and Thomas H. Perkins Florida Department of Environmental Protection FMRI Technical Report TR-3 1998 Lawton Chiles Governor of Florida Florida Department of Environmental Protection Virginia B. Wetherell Secretary The Florida Marine Research Institute (FMRI) is a bureau of the Florida Department of Envi- ronmental Protection (FDEP).The FDEP’s mission is to “protect,conserve, and manage Florida’s environment and natural resources.” The FMRI conducts applied research pertinent to manag- ing marine-fishery resources and marine species of special concern in Florida. Programs at the FMRI focus on resource-management topics such as managing gamefish and shellfish populations, restoring depleted fish stocks and the habitats that support them, pro- tecting coral reefs, preventing and mitigating oil-spill damage, protecting endangered and threatened species, and managing coastal-resource information. The FMRI publishes three series: Memoirs of the Hourglass Cruises, Florida Marine Research Publi- cations, and FMRI Technical Reports. FMRI Technical Reports contain information relevant to imme- diate resource-management needs. Kenneth D. Haddad, Chief of Research Institute Editors Theresa M. Bert, David K. Camp, Paul R. Carlson, Mark M. Leiby, William G. Lyons, Anne B. Meylan, Robert G. Muller, Ruth O. Reese, Carmelo R. Tomas James F. Quinn, Jr., Science Editor Judith G. Leiby, Copy Editor Llyn C. French, Art Editor Checklists of Selected Shallow-Water Marine Invertebrates of Florida David K. Camp William G. Lyons Thomas H. Perkins Florida Department of Environmental Protection Florida Marine Research Institute 100 Eighth Avenue Southeast St. -

Bulletins of American Paleontology
HARVARD UNIVERSITY Library of the Museum of Comparative Zoology iki^ Buflki VOLUME 92, NUMBER 327 APRIL 24, 1987 The Fauna and Paleoecology of the Late Pleistocene Marine Sediments of Southeastern Virginia by R. S. Spencer and L. D. Campbell MCZ LIBRARY MAY 1 5 1987 HARVARD UNIVERSITY Paleontological Research Institution 1259 Trumansburg Road Ithaca, New York, 14850 U.S.A. PALEONTOLOGICAL RESEARCH INSTITUTION Officers President William P. S. Ventress Vice-President James E. Sorauf Secretary Henry W. Theisen Acting Treasurer James C. Showacre Assistant Treasurer John L. Cisne Director Peter R. Hoover Legal Counsel Henry W. Theisen Trustees Bruce M. Bell (to 6/30/87) Cathryn Newton (to 6/30/88) Richard E. Byrd (to 6/30/89) William A. Oliver, Jr. (to 6/30/89) John L. Cisne (to 6/30/88) Edward B. Picou, Jr. (to 6/30/89) J. Thomas Dutro, Jr. (to 6/30/87) James E. Sorauf (to 6/30/88) Harry A. Leffingwell (to 6/30/87) Henry W. Theisen (to 6/30/89) Robert M. Linsley (to 6/30/89) Raymond Van Houtte (to 6/30/88) A. McCuNE (to 6/30/87) William P. S. Ventress (to 6/30/87) A. D. Warren, Jr. (to 6/30/88) BULLETINS OF AMERICAN PALEONTOLOGY and PALAEONTOGRAPHICA AMERICANA Peter R. Hoover Editor Reviewers for this issue Thomas M. Cronin Lauck Ward A list of titles in both series, and available numbers and volumes may be had on request. Volumes 1-23 o^ Bulletins ofAmerican Paleontology have been reprinted by Kraus Reprint Corporation, Route 100, Millwood, New York 10546 USA. -

Worldwide Mollusc Species Data Base Family: OLIVELLIDAE
WMSDB - Worldwide Mollusc Species Data Base Family: OLIVELLIDAE Author: Claudio Galli - [email protected] (updated 07/set/2015) Class: GASTROPODA --- Clade: CAENOGASTROPODA-HYPSOGASTROPODA-NEOGASTROPODA-OLIVOIDEA ------ Family: OLIVELLIDAE Troschel, 1869 (Sea) - Alphabetic order - when first name is in bold the species has images Taxa=189, Genus=1, Subgenus=13, Species=119, Subspecies=4, Synonyms=51, Images=110 acteocina , Olivella acteocina A.A. Olsson, 1956 adelae , Olivella adelae A.A. Olsson, 1956 - syn of: Olivella lactea (F.P. Marrat, 1871) adiorygma , Olivella adiorygma J.C. Verco, 1909 - syn of: Cupidoliva adiorygma (J.C. Verco, 1909) affinis , Olivella affinis F.P. Marrat, 1871 - syn of: Olivella semistriata (J.E. Gray, 1839) alba , Olivella alba (F.P. Marrat, 1871) alba , Olivella alba F.P. Marrat, 1871 - syn of: Olivella alba (F.P. Marrat, 1871) albina, Olivella albina G. Paulmier, 2015 alectona , Olivella alectona (P.L. Duclos, 1835) altatae , Olivella altatae J.Q. Burch & G.B. Campbell, 1963 amblia , Olivella amblia (R.B. Watson, 1882) amoni , Olivella amoni G.H.W. Sterba & F.Jr. Lorenz, 2005 - syn of: Janaoliva amoni (G.H.W. Sterba & F.Jr. Lorenz, 2005) anazora , Olivella anazora (P.L. Duclos, 1835) ankeli , Olivella ankeli J.M. Díaz & K. Götting, 1990 apicalis , Olivella apicalis E.A. Kay, 1979 - syn of: Ancillina apicalis (E.A. Kay, 1979) arionata , Olivella arionata R.S. Absalão, 2000 aureobalteata , Olivella aureobalteata J.T. Kuroda & T. Habe, 1971 aureocincta , Olivella aureocincta P.P. Carpenter, 1857 australis , Olivella australis J.E. Tenison-Woods, 1878 - syn of: Parviterebra brazieri (G.F. Angas, 1875) baetica , Olivella baetica P.P. Carpenter, 1864 barbenthos , Olivella barbenthos P.