MEMOIRE Présenté Par Thème
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Analisi Archeozoologica Della Fauna Proveniente Dallo Scavo Di Fonteblanda (Grosseto), 1993
ANALISI ARCHEOZOOLOGICA DELLA FAUNA PROVENIENTE DALLO SCAVO DI FONTEBLANDA (GROSSETO), 1993 (Con la tav. XXIII f.t.) Lo scavo, condotto in più fasi e ubicato nell’area portuale di Talamone (GR), tra la località di Fonteblanda e quella di La Puntata1 ha restituito, durante la campagna del 1993, un buon numero di reperti osteologici animali, attribuibili, in base alla presenza e alla concomitanza di resti archeologici in prevalenza ceramici, al VI secolo a.C. Il materiale proviene, nella sua interezza, da una discarica, anch’essa scavata a più riprese, ed è stato suddiviso in due principali unità stratigrafiche: US 101 e US 103, le quali a loro volta presentano una diversificazione del materiale in base al loro ritrovamen to in relazione all’Ambiente XY, ovvero US 101 Ambiente XY e US 103 Ambiente XY. Tuttavia, nonostante l’accurata distinzione stratigrafica, per quanto concerne Io studio archeozoologico, i reperti possono essere tutti inquadrati nell’unico contesto della sud detta discarica trovata in prossimità di una strada che passava di fronte all’Ambiente XY e, su di essi, è stato possibile compiere uno studio globale, calcolando il numero minimo d’individui (NMI, cioè il più piccolo numero di individui necessario per contare tutti gli elementi scheletrici di una determinata specie, il quale annulla, in parte, gli effetti della frammentazione rendendo migliore la visione di insieme), l’altezza al garrese (solo per alcuni esemplari), l’analisi dell’età di morte (condotta in base all’usura dentaria e alla tipologia delle saldature delle estremità alle diafisi) e dei tagli di macellazione, scarnifi cazione e disarticolazione, chiaro simbolo di uso alimentare delle specie di macrofauna rinvenute* 2. -

Reconnaître Les Principaux Bivalves Fouisseurs Ou Foreurs Au Moyen De Leurs Siphons
Reconnaître les principaux bivalves fouisseurs ou foreurs au moyen de leurs siphons. 56 espèces Clé de détermination des 20 taxons les plus gros Yves MÜLLER Yves Müller Mai 2016 Reconnaître les principaux bivalves fouisseurs ou foreurs au moyen de leurs siphons. Dans la quasi-totalité des ouvrages traitant des mollusques lamellibranches (ou mollusques bivalves), ce sont les coquilles qui sont décrites (la conchyologie) avec principalement la description des charnières pour la classification. Pour les parties molles (la malacologie) ce sont les branchies qui sont utilisées. Ce qui n’est pas très accessible au plongeur même photographe ! Selon Martoja (1995) 75 % des espèces de bivalves vivent dans les fonds meubles. Certaines espèces trahissent leur présence par leurs siphons qui affleurent à la surface du sédiment, mais il est difficile, au cours d’une plongée, d’identifier les bivalves enfouis dans le sédiment. D’autres espèces de bivalves vivent dans des substrats durs (bois, roche). Ils forent alors une loge dans ce substrat et en général seuls les siphons sont visibles. Le même problème se pose, à quelle espèce appartiennent les siphons ? Selon Bouchet et al. (1978 :92): « Les siphons constituent un moyen de détermination des bivalves aussi fiable que la coquille et la charnière ». Des auteurs anciens comme Deshayes (1844-1848), Forbes et Hanley (1850-1853), Jeffreys (1863, 1865) et Meyer & Möbius (1872) et quelques autres plus récents comme Owen (1953 ; 1959), Purchon (1955a, b), Holme (1959) et Amouroux (1980) ont décrit les siphons de plusieurs espèces. La plupart des espèces de bivalves mesurent entre un et plusieurs centimètres mais les siphons sont pour la plupart courts ou très fins et rétractiles au moindre danger, donc difficilement observables en plongée. -

M.Sc. THESIS JANUARY 2015 INVESTIGATION of ISTANBUL's
ISTANBUL TECHNICAL UNIVERSITY ENERGY INSTITUTE INVESTIGATION OF ISTANBUL’S NEOLITHIC AGE ANIMAL FINDINGS BY NEUTRON ACTIVATION ANALYSIS M.Sc. THESIS Ayşe Tuba ÖNGÜL Nuclear Researches Division Radiation Science and Technology Programme JANUARY 2015 ISTANBUL TECHNICAL UNIVERSITY ENERGY INSTITUTE INVESTIGATION OF ISTANBUL’S NEOLITHIC AGE ANIMAL FINDINGS BY NEUTRON ACTIVATION ANALYSIS M.Sc. THESIS Ayşe Tuba ÖNGÜL (302111001) Nuclear Researches Division Radiation Science and Technology Programme Thesis Advisor: Assist. Prof. Dr. Sevilay HACIYAKUPOĞLU JANUARY 2015 Ayşe Tuba Öngül, a M.Sc. student of ITU Institute of Energy student ID 302111001, successfully defended the thesis entitled “INVESTIGATION OF ISTANBUL’S NEOLITHIC AGE ANIMAL FINDINGS BY NEUTRON ACTIVATION ANALYSIS”, which she prepared after fulfilling the requirements specified in the associated legislations, before the jury whose signatures are below. Thesis Advisor : Assist. Prof. Dr. Sevilay HACIYAKUPOĞLU .................. İstanbul Technical University Jury Members : Prof. Dr. Sema AKYIL ERENTÜRK .............................. İstanbul Technical University Prof. Dr. Murat BELİVERMİŞ .............................. Istanbul University Date of Submission : 17 December 2014 Date of Defense : 20 January 2015 iii iv I dedicate this thesis to my parents, Zuhal and Metin ÖNGÜL. I hope that this achievement will complete the dream that you had for me all those many years ago when you chose to give me the best education you could. And to my dear fiancee Mustafa DURAN, for his unlimited patience and support. v vi FOREWORD I would like to express the deepest appreciation to my supervisor, Assist. Prof. Dr. Sevilay HACIYAKUPOGLU from the Istanbul Technical University. I am extremely grateful and indebted her. This thesis would not have been possible without her expert, sincere and valuable guidance and encouragement extended to me in every step of the time. -
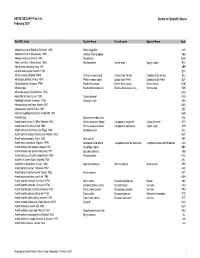
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

The Shore Fauna of Brighton, East Sussex (Eastern English Channel): Records 1981-1985 (Updated Classification and Nomenclature)
The shore fauna of Brighton, East Sussex (eastern English Channel): records 1981-1985 (updated classification and nomenclature) DAVID VENTHAM FLS [email protected] January 2021 Offshore view of Roedean School and the sampling area of the shore. Photo: Dr Gerald Legg Published by Sussex Biodiversity Record Centre, 2021 © David Ventham & SxBRC 2 CONTENTS INTRODUCTION…………………………………………………………………..………………………..……7 METHODS………………………………………………………………………………………………………...7 BRIGHTON TIDAL DATA……………………………………………………………………………………….8 DESCRIPTIONS OF THE REGULAR MONITORING SITES………………………………………………….9 The Roedean site…………………………………………………………………………………………………...9 Physical description………………………………………………………………………………………….…...9 Zonation…………………………………………………………………………………………………….…...10 The Kemp Town site……………………………………………………………………………………………...11 Physical description……………………………………………………………………………………….…….11 Zonation…………………………………………………………………………………………………….…...12 SYSTEMATIC LIST……………………………………………………………………………………………..15 Phylum Porifera…………………………………………………………………………………………………..15 Class Calcarea…………………………………………………………………………………………………15 Subclass Calcaronea…………………………………………………………………………………..……...15 Class Demospongiae………………………………………………………………………………………….16 Subclass Heteroscleromorpha……………………………………………………………………………..…16 Phylum Cnidaria………………………………………………………………………………………………….18 Class Scyphozoa………………………………………………………………………………………………18 Class Hydrozoa………………………………………………………………………………………………..18 Class Anthozoa……………………………………………………………………………………………......25 Subclass Hexacorallia……………………………………………………………………………….………..25 -

De Recente Europese Cardiidae Tekst En Foto’S Ron Voskuil
De Recente Europese Cardiidae Tekst en foto’s Ron Voskuil Afb. 1 Een overzicht van de grote europese Cardiidae-soorten. Voor verklaring zie p. 248. vila marina zeebiologische dokumentatie juli-aug. 1989 tweekleppigen 247 St. Jacut de la Mer, N. Bretagne, Frankrijk. Dood aangespoeld. 17 juni 1986 - Coll. RV No. 99 3. Acanthocardia tuberculata (L., 1758) Estepona, Z.O. Spanje. 1977 - Coll. RV No. .8 3 4. Acanthocardia spinosa (Lightfoot, 1786) Grado. N.O. Italië-Coll. RV No. 131 5. Acanthocardia paucicostata (Sowerby, 1841) Fuengirola, Z.O. Spanje - Coll. RV No. 480 6. Laevicardium oblongum (Gmelin, 1791) Santa Margherita Ligure, N. W. Italië, 50 me ter diep - Coll. RV No. 448 7. Laevicardium crassum (Gmelin, 1791) Erquy, N. Bretagne, Frankrijk, visserij, 18 juni 1986 - Coll. RV No. 98 8. Cardium indicum Lamarck, 1819 Dakar, Senegal - Coll. RV No. 38 9. Clinocardium ciliatum (Fabricius, 1780) Gufunes, W. IJsland. 3 meter diep. oktober 1. Acanthocardia aculeata (L., 1767) 1978 Coll. RV No. 452 GetrawldnabijMalilla, Marokko. 1987-Coll. 10. Serripes groenlandicus (Bruguière, 1789) RV No. 310 Gufunes, W. IJsland. In zand in ondiep wa 2. Acanthocardia echinata (L., 1758) ter. ju n i 1974 - Coll. RV No. 455 INLEIDING de commerciële waarde van enkele soorten en op het fenomeen albinisme, dat bij twee Europe Weinig mensen met interesse in de mariene bio se soorten waargenomen kan worden. logie zullen niet vertrouwd zijn met minstens één vertegenwoordiger van deze familie in Europa. Bijna overal behoren soorten van deze familie tot ALGEMENE KENMERKEN de meest algemene tweekleppigen. Wie van u kent niet de massa’s kokkel-kleppen op de De Cardiidae bestaan uit soorten die, hoewel vrij Nederlandse stranden. -

In Neendakara Fishing Harbour, Kollam
International Journal of Science and Research (IJSR) ISSN (Online): 2319-7064 Index Copernicus Value (2013): 6.14 | Impact Factor (2013): 4.438 Trawl Bycatch Diversity of Bivalves (Mollusca: Bivalvia) in Neendakara Fishing Harbour, Kollam 1 2 Souji.S , Tresa Radhakrishnan 1Department of Aquatic Biology and Fisheries, University of Kerala, India 2Thiruvananthapuram-695581, Kariyavattom, Kerala, India Abstract: In India, the fishery exploits species that widely vary in their life history traits and habitats. About 800 species of elasmobranches, teleosts, crustaceans, molluscs and echinoderms are taken by the trawls, and at least 300 species are the target species to the fishery (Vivekanandan, 2013). In the Neendakara harbour, molluscan species are the dominant species landed as by catch during the study period. From the collected samples, the bivalve species were sorted and recorded. Bivalves are the most diverse group of marine invertebrates and they include morphologically diverse group of organisms. The diversity of bivalves landed at the Neendakara fishing harbour, one of the major fish landing centers at Kollam, Kerala is included in this paper. The study period was for one year from August 2013 to May 2014. Altogether 46 species of bivalves were recorded during the study period. These 46 species belong to 13 orders, 16 families and 27 genera. The species composition data showed that the species of the family Arcidae have maximum species composition (21%), followed by family Glycymeridae, Pinnidae, Pectinidae, Dimyidae however, had less species composition (less than 1%). The collection represented the economically important species such as Perna viridis, Perna perna, Anadara indica, Anadara inequialis and Anadara gibbosa. -

Tesi Doctoral 2015
TESI DOCTORAL 2015 EL REGISTRE PALEONTOLÒGIC DELS DIPÒSITS LITORALS QUATERNARIS A L’ILLA DE MALLORCA (ILLES BALEARS, MEDITERRÀNIA OCCIDENTAL) Damián Vicens Xamena 13. Dipòsits litorals i registre paleontològic del Pleistocè superior al litoral SW de la serra de Tramuntana 13.1. Introducció Aquesta zona, situada al SW de la serra de Tramuntana, va des del cap de cala Figuera fins a Sant Telm, i es caracteritza per presentar un litoral molt variat, així hi ha cales amb platges d’arena, costes rocoses baixes, i costes rocoses altes. Essent les darreres les més abundants. Referent als materials que afloren al litoral també són molt variats, i la majoria són materials plegats del Mesozoic, encara que hi ha materials del Miocè, Pliocè i Pleistocè adossats als material més antics. Del Quaternari hi ha bons afloraments que van del Pleistocè inferior fins al Pleistocè superior i Holocè. 13.2. Antecedents històrics Aquesta zona compta amb treballs de pioners del Quaternari mallorquí. Hermite (1879) i Fallot (1922) citen el jaciment pleistocè de Camp de Mar, emperò el primer treball seriós d’un jaciment és el realitzat per Bauzà (1946a) que tracta del jaciment citat. Uns quants anys més tard, és estudiat per Muntaner (1955a), i aprofita al mateix treball per a presentar l’estudi i descripció del jaciment de Peguera. El 1960, Cuerda (1960) comunica la presència d’un dipòsit del Neotirrenià a Santa Ponça. El jaciment de Peguera ha estat el més citat o el que més s’ha dibuixat a diferents treballs del Quaternari mallorquí. Així Solé-Sabarís (1962) presenta un tall d’aquest indret i de Camp de Mar, i amb posterioritat, Cuerda (1975) presenta un tall de Peguera i el descriu; Crabtree et al. -

Update of the Marine Bivalvia Mollusca Checklist in Greek Waters
J. Mar. Biol. Ass. U.K. (2005), 85, 4798/1^6 Printed in the United Kingdom Update of the marine Bivalvia Mollusca checklist in Greek waters O P Argyro Zenetos*$, Evi Vardala-Theodorou and Catherine Alexandrakis *Hellenic Centre for Marine Research, Anavissos 19013, Attica, Greece. O Goulandris Natural History Museum, 14562, Ki¢ssia, Athens, Greece. P 28 Jacob Drive, Whitby ON, Canada L1P 1B1. $Corresponding author, e-mail: [email protected] Species of marine bivalve molluscs identi¢ed in the last nine years in the Greek waters have been used to update the checklist published in 1996 (Fauna Graeciae VII ) by inserting necessary changes and adding new records. The updated version includes 13 new species among which 3 are exotics (non-Mediterranean species), 5 rare, 2 new deep sea and 1 previously considered a fossil species. Also, as a result of new resources, the distributions of preexisting native molluscs have been updated to include new habitat areas. The nomenclature is also up to date based on the CLEMAM Database. Thus 5 species are now excluded either because they are junior synonyms of pre-existing valid species (2) or because of old spurious records (3 species). Additions and corrections of the 1996 checklist have resulted in a total of 308 bivalves in Greek waters. INTRODUCTION areas where more detailed studies have been completed (e.g. Evvoikos Gulf and Saronikos Gulf ). Research over the last two decades in the Eastern The nomenclature followed in this study is that of Mediterranean has revealed new geographic areas, new Sabelli et al. (1990) updated by the use of the CLEMAM bathymetric zones and new species. -

Instruction Manual Version 8
International bottom trawl survey in the Mediterranean Instruction manual Version 8 2016 MEDITS-Handbook. Version n. 8, 2016, MEDITS Working Group : 177 pp. 2 The MEDITS programme is conducted within the Data Collection Framework (DCF) in compliance with the Regulations of the European Council n. 199/2008, the European Commission Regulation n. 665/2008 the Commission Decisions n. 949/2008 and n. 93/2010. The financial support is from the European Commission (DG MARE) and Member States. This document does not necessarily reflect the views of the European Commission as well as of the involved Member States of the European Union. In no way it anticipates any future opinion of these bodies. Permission to copy, or reproduce the contents of this report is granted subject to citation of the source of this material. MEDITS Survey – Instruction Manual - Version 8 3 Preamble The MEDITS project started in 1994 within the cooperation between several research Institutes from the four Mediterranean Member States of the European Union. The target was to conduct a common bottom trawl survey in the Mediterranean in which all the participants use the same gear, the same sampling protocol and the same methodology. A first manual with the major specifications was prepared at the start of the project. The manual was revised in 1995, following the 1994 survey and taking into account the methodological improvements acquired during the first survey. Along the years, several improvements were introduced. A new version of the manual was issued each time it was felt necessary to make improvements to the previous protocol. In any case, each time the MEDITS Co-ordination Committee ensured that amendments did not disrupt the consistency of the series. -

Dr. Sc. Radosna Mužinić 1916-2004 4 ACTA ADRIATICA, 45(1): 3-8, 2004
ISSN: 0001-5113 ACTA ADRIAT., Editorial note AADRAY 45 (1): 3-8, 2004 This volume is dedicated to Dr. RADOSNA MUŽINIĆ, fishery biologist, who devoted the whole life to fishery research for benefit of the Croatian fishery and this Institute. Dr. sc. Radosna Mužinić 1916-2004 4 ACTA ADRIATICA, 45(1): 3-8, 2004 Dr sc. RADOSNA MUŽINIĆ died at the age of 87 on 5 April 2004. She was an internationally renowned and highly respected Fisheries scientist and Ichthyologist as well as leading scientist in small pelagic fish studies in Croatia. Dr. Mužinić was born on 15 November 1916 in Metković. She has obtained her degree in bio- logy in 1940, while in 1953 she got her PhD degree. She became scientific counsellor in 1967. From 1946 up to her retirement, Dr. Mužinić has worked in the Institute of Oceanography and Fisheries. She has continued to work for IOF until the end of 1990 as outside collaborator. During 1956 she worked in the Great Britain sponsored by the British Council at Fisheries Laboratory in Lowestoft and Marine Laboratory in Aberdeen. The scientific work of Dr. Radosna Mužinić is of a great importance not only for the Croatian, but also for the international scientific community. Her research referred to biology and ecology of commercially interesting Adriatic fish species, especially sardine, sprat, anchovy, Atlantic mackerel, Spanish mackerel, horse mackerel, red mullet, hake and grey mullet, and to some extent even the North Sea herring. The main field of her research was focused on sardine. The scientific work of Dr. Radosna Mužinić covered different issues such as sub-population of sardine in the Adriatic (taking into account importance of this matter for better fishery management), biology of sardine and surmullet as well as ecology of sardine. -

Catalogue of the Primary Types of Marine Molluscan Taxa Described by Tommaso Allery Di Maria, Marquis of Monterosato, Deposited in the Museo Civico Di Zoologia, Roma
Zootaxa 4477 (1): 001–138 ISSN 1175-5326 (print edition) http://www.mapress.com/j/zt/ Monograph ZOOTAXA Copyright © 2018 Magnolia Press ISSN 1175-5334 (online edition) https://doi.org/10.11646/zootaxa.4477.1.1 http://zoobank.org/urn:lsid:zoobank.org:pub:5A6191BD-03BA-4374-B779-B3E73652BC7C ZOOTAXA 4477 Catalogue of the primary types of marine molluscan taxa described by Tommaso Allery Di Maria, Marquis of Monterosato, deposited in the Museo Civico di Zoologia, Roma MASSIMO APPOLLONI1, CARLO SMRIGLIO2, BRUNO AMATI3, LORENZO LUGLIÈ4, ITALO NOFRONI5, LIONELLO P. TRINGALI6, PAOLO MARIOTTINI2 & MARCO OLIVERIO4,7 1Museo Civico di Zoologia, Via Ulisse Aldrovandi 18, I–00197 Roma, Italy, E–mail: [email protected] 2Dipartimento di Scienze, Università “Roma Tre”, Viale Marconi, 446, I–00146 Roma, Italy. E-mail: [email protected]; [email protected] 3Largo Giuseppe Veratti, 37/D, I–00146 Roma, Italy. E-mail: [email protected] 4Dipartimento di Biologia e Biotecnologie ‘Charles Darwin’, Sapienza University of Rome, Viale dell’Università 32, I–00185 Roma, Italy. E-mail: [email protected] 5Via Benedetto Croce, 97, I–00142 Roma, Italy. E-mail: [email protected] 6Via E.L. Cerva 100, I–00143 Roma, Italy. E-mail: [email protected] 7Corresponding author. E-mail: [email protected] Magnolia Press Auckland, New Zealand Accepted by T. Duda: 13 Jun. 2018; published: 14 Sept. 2018 MASSIMO APPOLLONI, CARLO SMRIGLIO, BRUNO AMATI, LORENZO LUGLIÈ, ITALO NOFRONI, LIONELLO P. TRINGALI, PAOLO MARIOTTINI & MARCO OLIVERIO Catalogue of the primary types of marine molluscan taxa described by Tommaso Allery Di Maria, Mar- quis of Monterosato, deposited in the Museo Civico di Zoologia, Roma (Zootaxa 4477) 138 pp.; 30 cm.