Panthera Onca
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

RFP Number and Title: P2013000012, "Biopark Asian Jungle Ropes & Zip Line Course"
` City of Albuquerque Request for Proposals Solicitation Number: P2013000012 BioPark Asian Jungle Ropes & Zip Line Course Deadline for Receipt of Offers October 26, 2012: 4:00 p.m. (Mountain Time) The City eProcurement System will not allow proposals to be submitted after this date and time. Pre-proposal Conference: October 9, 2012 2:30 PM Albuquerque BioPark 903 Tenth Street Albuquerque, NM 87102 Library City of Albuquerque P2013000012, " BioPark Asian Jungle Ropes & Zip Line Course” 1 Department of Finance and Administrative Services Purchasing Division TABLE OF CONTENTS Page Introduction 3 Part 1 Instructions to Offerors 4 Part 2 Proposal Format 13 Part 3 Scope of Services 15 Part 4 Evaluation of Offers 16 Part 5 Local Preference Instructions 18 Local Preference Form 19 Part 6 Draft Agreement 22 Appendix A Revenue Proposal Forms 28 Appendix B Bond Forms 29 P2013000012, " BioPark Asian Jungle Ropes & Zip Line Course” 2 INTRODUCTION Purpose and Intent The Albuquerque Biological Park (BioPark) is soliciting proposals from qualified firms interested in providing an Asian Jungle Experience using a combination of rope courses and zip lines on a 2 acre parcel of land located at the Rio Grande Zoo, 903 10th St. Albuquerque NM 87102. The Albuquerque Biological Park is an accredited facility through the Association of Zoos and Aquariums (AZA) and seeks to maintain and continually improve upon the care and management of the animal and plant collection as well as providing an important recreational and educational venue to the citizens and visitors of the Albuquerque region. Background and General Information 1. The Albuquerque Biological Park is owned and operated by the City of Albuquerque. -

General Vertical Files Anderson Reading Room Center for Southwest Research Zimmerman Library
“A” – biographical Abiquiu, NM GUIDE TO THE GENERAL VERTICAL FILES ANDERSON READING ROOM CENTER FOR SOUTHWEST RESEARCH ZIMMERMAN LIBRARY (See UNM Archives Vertical Files http://rmoa.unm.edu/docviewer.php?docId=nmuunmverticalfiles.xml) FOLDER HEADINGS “A” – biographical Alpha folders contain clippings about various misc. individuals, artists, writers, etc, whose names begin with “A.” Alpha folders exist for most letters of the alphabet. Abbey, Edward – author Abeita, Jim – artist – Navajo Abell, Bertha M. – first Anglo born near Albuquerque Abeyta / Abeita – biographical information of people with this surname Abeyta, Tony – painter - Navajo Abiquiu, NM – General – Catholic – Christ in the Desert Monastery – Dam and Reservoir Abo Pass - history. See also Salinas National Monument Abousleman – biographical information of people with this surname Afghanistan War – NM – See also Iraq War Abousleman – biographical information of people with this surname Abrams, Jonathan – art collector Abreu, Margaret Silva – author: Hispanic, folklore, foods Abruzzo, Ben – balloonist. See also Ballooning, Albuquerque Balloon Fiesta Acequias – ditches (canoas, ground wáter, surface wáter, puming, water rights (See also Land Grants; Rio Grande Valley; Water; and Santa Fe - Acequia Madre) Acequias – Albuquerque, map 2005-2006 – ditch system in city Acequias – Colorado (San Luis) Ackerman, Mae N. – Masonic leader Acoma Pueblo - Sky City. See also Indian gaming. See also Pueblos – General; and Onate, Juan de Acuff, Mark – newspaper editor – NM Independent and -

Report No. 2002-02
REPORT TO THE UTAH LEGISLATURE Report No. 2002-02 A Performance Audit of Hogle Zoo April 2002 Audit Performed by: Audit Manager John Schaff Auditor Supervisor Janice Coleman Audit Staff Darren Marshall Wayne Kidd Aaron Eliason Consultants Stephen R. Wylie Horrocks Engineers 1 Table of Contents Page Digest ........................................................i Chapter I Introduction ...................................................1 Audit Scope and Objectives .....................................3 Chapter II Hogle Zoo Is Not Performing Well in the Market ........................5 Increasing Marketing Expenditures Have Not Halted Market Share Decline ..............................................8 Many Animal Exhibits Are Old and Dated .........................12 Chapter III Present Zoo Site Is Too Small .....................................17 Probable Bond Life Exceeds Site Capacity Life ......................17 Parking Capacity Does Not Allow One Million Visitors ...............18 Two Alternatives Should Be Explored .............................20 Chapter IV Construction of the Entryway Is a Concern ............................25 Construction of the Entryway Was a Questionable Financial Decision .....27 Construction of the Entryway Impedes Animal Exhibits ...............29 Chapter V Both Expenditures and Savings Increased upon Receipt of ZAP Funding ................................................31 Marketing, Animal Care, and Administration Received Largest Expenditure Increases .......................................31 The New -

An Adoption Donation of Only $35 Will Help a Zoo Animal of Your Choice Get the Specialized Care It Deserves. Choose from These Incredible Animals
Want to make a huge difference in the life of a Hogle Zoo animal? With our new Zoo A.D.O.P.T. program, now you can! An adoption donation of only $35 will help a zoo animal of your choice get the specialized care it deserves. Choose from these incredible animals: Polar Bear Grey Wolf Grizzly Bear Siamese Crocodile California Sea Lion Aldabra Tortoise African Elephant White-Handed Gibbon White Rhinoceros Ostriches Reticulated Giraffe Bald Eagle Amur Leopard Bornean Orangutan Amur Tiger Western Lowland Gorilla Snow Leopard Hoffman’s Sloth Want to give even more? That’s wonderful! We have five levels of support: LEVEL 1 2 3 4 5 LEVEL 1 2 3 4 5 Cost $35 $60 $85 $200 $500 Cost $35 $60 $85 $200 $500 Adoption Certificate x x x x x Invite to Adopter Event x x x Animal Fact Sheet x x x x x Recognition at Zoo x x x Adoption Magnet x x x x x Keeper Talk* x x Recognition on Website x x x x x Tickets to the Zoo 2 4 Animal Photo x x x x Enrichment Opportunity* x Animal Plush x x x x *Restrictions may apply For more information about how to adopt your animal, call our Zoo A.D.O.P.T. Ambassador at 801-584-1741 or email us at [email protected]. Current Zoo A.D.O.P.T.ers Joe and Laurie Vervaecke Features Utah’s Zoological Society Board Members What it Takes to Run the Zoo President 2 James E. Hogle Jr Vice President Paul M. -

Publication of the Utica Zoological Society Volume 4 Number 3
Publication of the Utica Zoological Society May/June 1996 Volume 4 Number 3 ~..,.- Spring has arrived ...~nally! It~~--~,._ sensitive. The babies have tender was a long, cold wmter, bu -::: ~-. v~ ~ . ink skin and are easily sunburned underneath several ~eet of snow, · - ~· - , e;' ' uring their first few weeks of life. plants and arumals are To prevent this mom will lead her beginning to feel the change of the whale . family, are usually baby to a mud hoie so they can cover seasons.For many species of wildlife, h~lthy and robust ~t birth. Th~y themselves with~ pr?,tective co~ting of spring is the time for giving birth. The qm~kly adapt t? their new aq~IC mud, sort of a rhino sunscreen . ycle of life is quite different for envrronment, With mother watching When they are born, African • mammals, birds, fish, amphibians and them very closely. The mother colobus monkeys are covered with reptiles. All mammals (with the guides her calfs movements, and curly white fur! The infants are passed exception of a few oddities such as the some mothers have even been back and forth among the troop's duck-billed platypus and the spiny observed disciplining the calves females, and it is believed that the all- ~teater) give birth to l.iv~ young, while when they misbehave! The calf white fur of the babies encourages this birds, fish and amp~tbians lay eg~s . nurses within an hour after it is behavior. Because they look different Snakes are an exception: some spectes . · b'rth t . born, and as often as four times from the adults, who are black With gtve 1 o 1IVe young, some 1ay eggs, . -
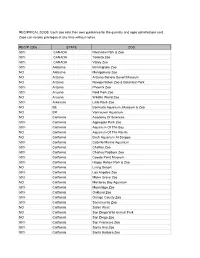
2006 Reciprocal List
RECIPRICAL ZOOS. Each zoo sets their own guidelines for the quantity and ages admitted per card. Zoos can revoke privileges at any time without notice. RECIP 2006 STATE ZOO 50% CANADA Riverview Park & Zoo 50% CANADA Toronto Zoo 50% CANADA Valley Zoo 50% Alabama Birmingham Zoo NO Alabama Montgomery Zoo NO Arizona Arizona-Sonora Desert Museum NO Arizona Navajo Nation Zoo & Botanical Park 50% Arizona Phoenix Zoo 50% Arizona Reid Park Zoo NO Arizona Wildlife World Zoo 50% Arkansas Little Rock Zoo NO BE Bermuda Aquarium, Museum & Zoo NO BR Vancouver Aquarium NO California Academy Of Sciences 50% California Applegate Park Zoo 50% California Aquarium Of The Bay NO California Aquarium Of The Pacific NO California Birch Aquarium At Scripps 50% California Cabrillo Marine Aquarium 50% California Chaffee Zoo 50% California Charles Paddock Zoo 50% California Coyote Point Museum 50% California Happy Hollow Park & Zoo NO California Living Desert 50% California Los Angeles Zoo 50% California Micke Grove Zoo NO California Monterey Bay Aquarium 50% California Moonridge Zoo 50% California Oakland Zoo 50% California Orange County Zoo 50% California Sacramento Zoo NO California Safari West NO California San Diego Wild Animal Park NO California San Diego Zoo 50% California San Francisco Zoo 50% California Santa Ana Zoo 50% California Santa Barbara Zoo NO California Seaworld San Diego 50% California Sequoia Park Zoo NO California Six Flags Marine World NO California Steinhart Aquarium NO CANADA Calgary Zoo 50% Colorado Butterfly Pavilion NO Colorado Cheyenne -

Kirtland Inn Guestbook
Dear Guest, Welcome to the Kirtland Inn, setting the standard for the USAF! On behalf of the staff, we sincerely hope your stay is pleasant and comfortable. Kirtland Inn and Kirtland Air Force Base are rich in history and tradition. Please take time out of your busy schedule to enjoy the sights and the surrounding area. We strive to provide outstanding guest service and accommodations to all of our patrons. Should you need anything special or if you have inadvertently forgotten a travel item, please ask any staff member for assistance. We will take care of your request as quickly as possible. If you need further information about Kirtland Air Force Base and the surrounding community, just ask. Continuous improvement is our goal. We welcome any comments or recommendations that you may have. Please complete the comment card located in your room or at the Reception Desks to let us know how we did. You can reach me at 846-9663 or any of our Guest Service Representatives by dialing 0. Again, welcome to Kirtland AFB and the Kirtland Inn! Steve Holland, CHA General Manager Email: [email protected] The appearance of local business names does NOT imply federal endorsements. All information to include addresses and telephone numbers are subject to change. Please call the business to confirm their operation hours. GENERAL INFORMATION This information is made available as a public service and does not imply Air Force endorsement of the company’s products or services. CALL 853-9111 FOR ANY ON BASE EMERCENCY Kirtland AFB Gate Information Gate Phone Eubank Gate 846-6231 Gibson Gate 846-7240 Maxwell Gate 846-7491 Truman Gate 846-7509 Wyoming Gate 846-6118 Receiving Mail During Your Stay Guests who require mail service while staying at the Kirtland Inn should use the base general delivery address: Your Name General Delivery 2050 2nd St SE Kirtland Air Force Base, NM 87117 *Upon arrival to Kirtland AFB, individuals utilizing general delivery mail service must come by the Postal Service Center, building 20204, to fill out a locator card with your new address. -

Additional Member Benefits Reciprocity
Additional Member Benefits Columbus Member Advantage Offer Ends: December 31, 2016 unless otherwise noted As a Columbus Zoo and Aquarium Member, you can now enjoy you can now enjoy Buy One, Get One Free admission to select Columbus museums and attractions through the Columbus Member Advantage program. No coupon is necessary. Simply show your valid Columbus Zoo Membership card each time you visit! Columbus Member Advantage partners for 2016 include: Columbus Museum of Art COSI Franklin Park Conservatory and Botanical Gardens (Valid August 1 - October 31, 2016) King Arts Complex Ohio History Center & Ohio Village Wexner Center for the Arts Important Terms & Restrictions: Receive up to two free general admissions of equal or lesser value per visit when purchasing two regular-priced general admission tickets. Tickets must be purchased from the admissions area of the facility you are visiting. Cannot be combined with other discounts or offers. Not valid on prior purchases. No rain checks or refunds. Some restrictions may apply. Offer expires December 31, 2016 unless otherwise noted. Nationwide Insurance As a Zoo member, you can save on your auto insurance with a special member-only discount from Nationwide. Find out how much you can save today by clicking here. Reciprocity Columbus Zoo Members Columbus Zoo members receive discounted admission to the AZA accredited Zoos in the list below. Columbus Zoo members must present their current membership card along with a photo ID for each adult listed on the membership to receive their discount. Each zoo maintains their own discount policies, and the Columbus Zoo strongly recommends calling ahead before visiting a reciprocal zoo. -

Education Programs
EDUCATION PROGRAMS 2017 hoglezoo.org Special Needs Camp & Classes Zoo Just for You “Zoo Just for You” programming has been developed for students with special needs. Live animals, photographs, skull models, pelts, animal figures and more are used to engage students and demonstrate concepts. Our program utilizes a sensory motor approach where students move between stations and are encouraged to touch, smell and feel all appropriate items. Registration closes one week prior to class date. www.hoglezoo.org/zoojustforyou Cost is $10 per student and includes accompanying caregiver. Magnificent Mammals On the Wing and in the Bush (ASD and developmental delays, ages 6-18) (Citizen science)(Blind/Low vision, ages 14-25) Do you have what it takes to be a mammal? You bet! From the North Pole to the South Pole, the rainforest Some mammals are larger than school buses, and to the desert, on land, in the sky and even underwater, others are smaller than your little finger, but they all birds are on the move! Discover some amazing bird have three things in common! Discover the three I.D.s species and how to identify them by sight or sound. of a mammal, and find out which ones break the Get the tools you need to become a citizen scientist rules. Class includes a short instructional time with and help track bird migration. Class includes a short pictures, animal artifacts, live animals, interactive play, instructional time with pictures, animal artifacts, live and guided short visit in the Zoo for the child and animals, interactive play, and a guided short visit in the accompanying adult. -

Entertain Them with DINOSAURS!
this year only, entertain them with DINOSAURS! Holding your family reunion or Friday, corporate event during ZOORASSIC PARK 2 June 26, 2015 this summer is an opportunity to enjoy all that Hogle- and Zoo more! has to offer 5 – 9 p.m. Olympus Hills Lanes Our catering department can provide everything from casual picnic fare to 4015 S. Wasatch Blvd. exquisite plated dinners in the beautiful SLC, UT 84124 Event Pavilion. The Utah Chapter American Association of Zoo You can even rent the Zoo after-hours! Keepers would like to invite you to join us at our annual Bowling For Rhinos fundraiser! Call our Group Sales department at Since 1992, we have raised more than $197,000 towards (801)584-4501 rhino conservation in Africa and Indonesia. or email us at This is a fun, family event that includes all-you-can-eat [email protected] pizza, as well as the opportunity to win fabulous prizes. before the dinosaurs go extinct – again! Registration for adults and $25 for children under 10 years. For event details, and $10 all that’s new For more event info, please visit our website: - or prehistoric - www.utahaazk.org or email us at [email protected] at Hogle Zoo, You can also follow us on visit the Group Parties page on our website at BOWL ZK IN A G www.hoglezoo.org A F S O O R R HIN Features Get Ready For Some Dino-Size Fun Utah’s Zoological Society Board Members This Summer at Utah’s Hogle Zoo! 2 Chairman James E. -

RECIPROCAL LIST from YOUR ORGANIZATION and CALL N (309) 681-3500 US at (309) 681-3500 to CONFIRM
RECIPROCAL LOCAL HIGHLIGHTS RULES & POLICIES Enjoy a day or weekend trip Here are some important rules and to these local reciprocal zoos: policies regarding reciprocal visits: • FREE means free general admission and 50% off means 50% off general Less than 2 Hours Away: admission rates. Reciprocity applies to A Peoria Park District Facility the main facility during normal operating Miller Park Zoo, Bloomington, IL: days and hours. May exclude special Peoria Zoo members receive 50% off admission. exhibits or events requiring extra fees. RECIPROCAL Niabi Zoo, Coal Valley, IL: • A membership card & photo ID are Peoria Zoo members receive FREE admission. always required for each cardholder. LIST Scovill Zoo, Decatur, IL: • If you forgot your membership card Peoria Zoo members receive 50% off admission. at home, please call the Membership Office at (309) 681-3500. Please do this a few days in advance of your visit. More than 2 Hours Away: • The number of visitors admitted as part of a Membership may vary depending St. Louis Zoo, St. Louis, MO: on the policies and level benefits of Peoria Zoo members receive FREE general the zoo or aquarium visited. (Example, admission and 50% off Adventure Passes. some institutions may limit number of children, or do not allow “Plus” guests.) Milwaukee Zoo, Milwaukee, WI: Peoria Zoo members receive FREE admission. • This list may change at anytime. Please call each individual zoo or aquarium Lincoln Park Zoo, Chicago, IL: BEFORE you visit to confirm details and Peoria Zoo members receive FREE general restrictions! admission and 10% off retail and concessions. DUE TO COVID-19, SOME FACILITIES Cosley Zoo, Wheaton, IL: MAY NOT BE PARTICIPATING. -

Rio Grande Heritage Farm Education Guide
Rio Grande Heritage Farm Education Guide Grades 4-5 Contents General Biopark Information Biopark Group Admission Information School Lunch Order Form General Teacher Tips Chaperone Guide Teacher Background Information Pre-Visit Activities Field Trip Worksheet Post-Visit Activities Student Handouts Student Handout Answer Sheets GENERAL BIOPARK INFORMATION Facilities The Albuquerque BioPark is a gateway to the mystery and diversity of living organisms. Core facilities include: Albuquerque Aquarium, Rio Grande Botanic Garden, Rio Grande Zoo and Tingley Beach. The BioPark has an estimated 6,000 animals, 11,000 plants, 300 staff and 300 year-round volunteers. The Director of the Albuquerque BioPark is Ray Darnell. The Albuquerque Aquarium is a great place to explore aquatic environments by tracing a drop of water from the headwaters of the Rio Grande in southern Colorado to the Gulf of Mexico and out to the oceans of the world. Current exhibits highlight fish of the Rio Grande at Central Bridge, moray eels, invertebrates, coral reefs, floating jellies, sea turtles and lots of toothy sharks. Further construction will develop tanks that highlight species that live in the Pacific Ocean. (Location 2601 Central NW) The Rio Grande Botanic Garden celebrates the miracle of photosynthesis in living color every day. Our state-of-the-art glass conservatories feature plants native to Mediterranean climate zones and xeric plants from North American deserts and other arid regions of the world. A trio of formal walled gardens illustrates Old World design in fountains, tile, herbs and roses. El Jardin de la Curandera is an ethnobotanic exhibit with a beautiful bronze sculpture, and the Children’s Fantasy Garden has giant fun for kids of all ages.