Ação Dos Extratos De Neoregelia Compacta (Mez) L.B
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Bromelcairns
Club Activities & Around the Members SEPTEMBER: We met at Kewarra at Dave & Brendan’s where the trees & shrubs have all grown well and the bromeliads are thriving. Members wandered around Bromelcairns the garden and were amazed when they saw Dyckia ‘Betty Farnhill’ aka ‘BB’ in Newsletter - 2008 # 5 spike! ---- small plants had formed in the centre of the cluster of large plants Cairns Bromeliad Society Inc. and were in flower, the orange bells appeared to be laughing at us. It was an P.O.Box 28 Cairns. Queensland 4870 amazing sight! No, Dave did not de-pup it! * With 13 good neoregelias entered in the mini show it was hard to judge but President Bob Hudson 0740533913 V-President Thomas Jones unlisted Brendan’s Neoregelia ‘Leopard’ was just perfect, with Darryl’s ‘Fandango’ a close Secretary Lynn Hudson 0740533913 second and a spider with web relegated Dave’s very rich ‘Burgundy’ to third. Treasurer Sharron Miller 0740322283 Excellent miniatures. ‘Well Done’ to each Entrant. Librarian Stuart Howe 0402832354 * We had a short discussion on neoregelias, then on varied topics as questions Editor Lynn Hudson 0740533913 arose and then the inevitable ingredients/ratio for ‘pot mixes’. Editor Assist. * We discussed the Show schedule and agreed on changes that include the BSI OIC Raffles Karen Stevens 0740361086 Member Concierge Barry Osborne 0740532047 definition of ‘flowering’ and for some genera to be more than one specimen. The Popular Vote Steward Karen Cross 0740545497 Schedule will be distributed next February. *Honorary Life Member - Grace Goode O.A.M.* * As Sharron had kept requesting a bus trip Bob suggested we go to Butler’s Life Member - Lynn Hudson Open Garden & visit Greg Oldano. -
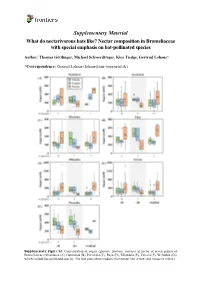
Supplementary Material What Do Nectarivorous Bats Like? Nectar Composition in Bromeliaceae with Special Emphasis on Bat-Pollinated Species
Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S1: Concentration of sugars (glucose, fructose, sucrose) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)) which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S2: Concentration of amino acids (ala, arg, asn, asp, gaba, gln, glu, gly, his, iso, leu, lys, met, phe, pro, ser, thr, trp, tyr, val) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S3: Cation concentrations (Ca2+, K+, Na+, Mg2+) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). -

February 2012
BromeliAdvisory February 2012 WEBPAGE: http://www.bssf-miami.org/ FEBRUARY 21, 2012 7:30 PM Speaker: Dennis Cathcart on Wally Berg http://www.facebook.com/home.php?sk=group_1881 55814554155&ap=1 RAFFLE TABLE: Robert Meyer FOOD TABLE: Pat Tarkanish Joy Parrish, Maureen http://ja-jp.facebook.com/pages/Bromeliad-So Adelman ciety-of-South-Florida/84661684279 President Carl Bauer VP: Barbara Partagas Speaker for the Month: Treasurer: Alan Herndon Dennis Cathcart – the man behind Tropiflora – something which he describes as, “. a bromeliad Secretary: Lori Weyrick collecting hobby got out of hand.” Tropiflora _________________ registered in 1976 and now is BIG. He or his DIRECTORS nursery can be seen at numerous shows Past Pres.: Robert Meyer throughout the year. He is one of the few Directors: featured speakers for Orlandiana ‘12 – the 20th Urszula Dudek ‘12-‘13 World Conference Lenny Goldstein ‘12-‘13 Sandy Roth ‘11-‘12 Special Orders Anyone? Craig Morrell ‘11-‘12 If you want Dennis to bring items to YOU at our meeting, email or call them and make your order. Deadline for the order is February 17, 2012. http://www.tropiflora.com/ Editor 1-800-613-7520, or [email protected] Robert C Meyer RENEW MEMBERSHIPS NOW – SEE LAST PAGE Door Prize: Alan Herndon Education: Nat DeLeon Hospitality: Elaine Mills Library: Skye Palmer Inside this edition: PRESIDENT’S MESSAGE ............................. 2 Membership: Melody Ray IN CASE YOU MISSED IT .......................... 2-4 Mem. Plant Sales: Antonio OBITUARY ....................................... 4 Arbelaez AN ARTISTIC INTERLUDE ........................... 4 Raffle: Mike Michalski GARDEN NOTES ................................ 5-6 Refreshments: Sandy Roth ALL HAIL OUR LONG-TERM MEMBERS ............. -

Growing Bromeliads Epiphytically in the Subtropical Home Garden Kerry Booth Tate (As Published in the BSI Journal, May-June 2003, Revised August 2017)
Growing Bromeliads Epiphytically in the Subtropical Home Garden Kerry Booth Tate (as published in the BSI Journal, May-June 2003, Revised August 2017) Most bromeliad growers I know, and know of, cultivate their plants in pots under shade cloth, or some form of protective structure. This is necessary when climatic conditions do not replicate the bromeliads’ natural habitat. However, for those lucky gardeners who live in a subtropical climate, as I do, growing bromeliads in trees of the home garden can be successful and very effective. I have many established trees in my garden, thanks to the previous owners. Moving here from a cool-temperate region, I was greatly impressed and inspired by a huge flowering clump of the common Billbergia pyramidalis, climbing the trunk of an old Silky Oak (Grevillea robusta). Since then, my trees have become living sculptures – embellished with their ornaments, it’s like Christmas all year! With each new bromeliad purchase, I research its origin and growth habit in the literature available (pre internet access and the realm of international forums and facebook!), and decide where and under which conditions it might thrive. When tying a bromeliad onto the branch or trunk of a tree, I do not use sphagnum moss around the root area of the plant. Sometimes, a purchased pot-grown bromeliad already has an established root ball including pine chunks. This can be easier to secure to a branch, especially if the plant is not stoloniferous. Well-grown pups, with an obvious stolon, can be tied directly onto the upper side of a branch very easily. -

June 2011 UNE WEBPAGE: J 21 2001 @ 7 :30 PM Speaker: Dr
BromeliAdvisory June 2011 UNE WEBPAGE: http://www.bssf-miami.org/ J 21 2001 @ 7 :30 PM Speaker: Dr. Karl Green – Bromeliad Quiz for http://www.facebook.com/home.php?sk=group_1881 55814554155&ap=1 prizes (bromeliads) hosted by Dr. Karl Green. RAFFLE TABLE: Paul Finlayson and Dr. Bob http://ja-jp.facebook.com/pages/Bromeliad-So Grayson (don’t miss this one) ciety-of-South-Florida/84661684279 FOOD TABLE: Barbara Sparling, Sara Donayre, Maureen Adelman, Bernice Reed, Pat Gatjens President Carl Bauer VP: Barbara Partagas Treasurer: Alan Herndon Karl Green will be our speaker. Karl is an Secretary: Lori Weyrick active member with exceptional growing DIRECTORS skills and taxonomic proficiency in Past Pres.: Robert Meyer bromeliads. A retired medical doctor, Directors: Karl’s endeavors in the bromeliad world Nat DeLeon ‘10-‘11 have bursted from hobbyist to serious and Rhonda Herndon ‘10-‘11 learned grower whose rented shade house Sandy Roth ‘11-‘12 has thousands of species – accentuated with Craig Morrell ‘11-‘12 a large scale collection of pure foster plants. And, with a dry whimsical and often wry manner, Karl lends a laugh to our Karl Green sports Editor a Tillandsia Robert C Meyer meetings and members. funkiana Door Prize: Alan Herndon Inside this edition: Education: Nat DeLeon PRESIDENT’S MESSAGE ............................. 2 GARDEN NOTES ................................ 2-3 Hospitality: Elaine Mills A BUSY YEAR AHEAD ............................ 4-5 Library: Ofelia Sorzano FIELD TRIP ...................................... 5 Membership: Moyna Prince HOW ABOUT A NIGHT RIDE?......................... 6 Member Plant Sales: Antonio BOARD TO PRESENT NAT DELEON SCHOLARSHIP ......... 6 Arbelaez MURDER IN CORBIN A............................ 6-7 Raffle: Mike Michalski Refreshments: Patty Gonzalez What Who Now we are on facebook with Sales Antonio Arbelaez two pages for your pleasure. -

Neoregelias: Part 1
Bromeliaceae VOLUME XLI - No. 3 - MAY/JUNE 2007 The Bromeliad Society of Queensland Inc. P. O. Box 565, Fortitude Valley Queensland, Australia 4006, Home Page www.bromsqueensland.com OFFICERS PRESIDENT Olive Trevor (07) 3351 1203 VICE PRESIDENT Barry Kable PAST PRESIDENT Bob Reilly (07) 3870 8029 SECRETARY Vacant TREASURER Glenn Bernoth (07) 4661 3 634 BROMELIACEAE EDITOR Ross Stenhouse SHOW ORGANISER Bob Cross COMMITTEE David Rees, Paul Dunstan, Ann McBur- nie, Arnold James,Viv Duncan MEMBERSHIP SECRETARY Roy Pugh (07) 3263 5057 SEED BANK CO-ORDINATOR Doug Parkinson (07) 5497 5220 AUDITOR Anna Harris Accounting Services SALES AREA STEWARD Pat Barlow FIELD DAY CO-ORDINATOR Nancy Kickbusch LIBRARIAN Evelyn Rees ASSISTANT SHOW ORGANISER Phil Beard SUPPER STEWARDS Nev Ryan, Barry Genn PLANT SALES Nancy Kickbusch (Convenor) N. Poole (Steward) COMPETITION STEWARDS Dorothy Cutcliffe, Alan Phythian CHIEF COMPETITION STEWARD Jenny Cakurs HOSTESS Gwen Parkinson BSQ WEBMASTER Ross Stenhouse LIFE MEMBERS Grace Goode OAM Peter Paroz, Michael O’Dea Editors Email Address: [email protected] The Bromeliad Society of Queensland Inc. gives permission to all Bromeliad Societies to re- print articles in their journals provided proper acknowledgement is given to the original author and the Bromeliaceae, and no contrary direction is published in Bromeliaceae. This permission does not apply to any other person or organisation without the prior permission of the author. Opinions expressed in this publication are those of the individual contributor and may not neces- sarily reflect the opinions of the Bromeliad Society of Queensland or of the Editor Authors are responsible for the accuracy of the information in their articles. -

Far North Coast Bromeliad Study Group N.S.W
Far North Coast Bromeliad Study Group N.S.W. Study Group meets the third Thursday of each month Next meeting 21st August 2014 at 11 a.m. Venue: PineGrove Bromeliad Nursery 114 Pine Street Wardell 2477 Phone (02) 6683 4188 Discussion: July 2014 General Discussion Editorial Team: Kay Daniels Trish Kelly Ross Little Helen Clewett [email protected] Statements and opinions expressed in articles are those of the authors and are not necessarily endorsed by the Group. Articles appearing in this News Letter may be used in other Publications provided that the source is credited. 1 Meeting 19th June 2014 The meeting was opened at approximately 11:10am. The 23 members and two visitors present were welcomed. A total of six apologies were received. General Business A new book for our ever expanding Library, Jewels of the Jungle, Bromeliaceae of Ecuador, Part 1 by Jose’ M. Manzanares was presented to the Group. The mail for the month was the BSI Journal also to be added to the Library. The Group discussed the request from the Queensland Bromeliad Society for reciprocal exchange of newsletters which has been agreed upon. Ron had a request for someone from the Group to supply a large number of Neoregelia compacta for one of his Op. Shop customers. Ron also reported on Denis Collis, a former member who has been suffering poor health, we extended our best wishes to Denis and his wife. There was the ongoing discussion about labelling seed and seedlings correctly however one can only put on the label what is on the packet to begin with. -

Bromelcairns 2015#3
Bromelcairns Bimonthly Newsletter of Cairns Bromeliad Societ Inc. 2015 # 3 P.O. Box 28 Cairns Queensland 4870 Austalia President Bob Hudson 0740533913 V-President Brendan Leishman 0740578604 Secretary Dave Weston 0740578604 Treasurer Lesley Hepburn 0488788892 Librarian Steven French 0740322283 Editor Lynn Hudson 0740533913 Editor Assist. Jodie Smith 0405022155 Member Concierge Sharron Miller 0740322283 Pop. Vote Steward Lynn Hudson 0740533913 OIC Pots Frances Boyd 0740552550 OIC Raffles Karen Stevens 0740361086 Honorary Life Member - Grace Goode O.A.M. Honorary Life Member - Kay Edington Life Member - Lynn Hudson Life Member - Robert (Bob) Hudson ******************************************************************** Aims of the Society Promote and Develop Interest in Bromeliads through Friendship To Co-operate with similar Clubs throughout the World ******************************************************************** Membership Fee: $15 Single, $25 Family, Country Member $25. $7.50 junior (if not in family membership) Meetings start at 1.pm sharp first Saturday of the month. Please bring a cup and a chair. Library: All books & magazines borrowed are to be returned in good order to the following meeting. If not on wait list, they may be rebooked. Plant Display/Sales: To participate, a member must be financial and circumstances permitting, have attended at least three meetings in the past six months. Where the society is charged a stall fee - 20% of sales are deducted for club funds. No charge venue & meetings - 10% of sales is deducted. All plants to be clean, free of disease, named and price tagged. Show Plants: Must be the property of and in the custody of the entrant for the past three months. For Society Shows the entrant must be financial and have attended at least three meetings during the past six months. -

TELHADOS VERDES EM CLIMA TROPICAL UMA NOVA TÉCNICA E SEU POTENCIAL DE ATENUAÇÃO TÉRMICA Bruno Rezende Silva Tese De Doutorad
TELHADOS VERDES EM CLIMA TROPICAL UMA NOVA TÉCNICA E SEU POTENCIAL DE ATENUAÇÃO TÉRMICA Bruno Rezende Silva Tese de Doutorado apresentada ao Programa de Pós-Graduação em Engenharia Civil, Coppe, da Universidade Federal do Rio de Janeiro, como parte dos requisitos necessários à obtenção do Título de Doutor em Engenharia Civil. Orientadores: Maria Claudia Barbosa André Mantovani Rio de Janeiro Julho 2016 TELHADOS VERDES EM CLIMA TROPICAL UMA NOVA TÉCNICA E SEU POTENCIAL DE ATENUAÇÃO TÉRMICA Bruno Rezende Silva TESE SUBMETIDA AO CORPO DOCENTE DO INSTITUTO ALBERTO LUIZ COIMBRA DE PÓS-GRADUAÇÃO E PESQUISA DE ENGENHARIA (COPPE) DA UNIVERSIDADE FEDERAL DO RIO DE JANEIRO COMO PARTE DOS REQUISITOS NECESSÁRIOS PARA A OBTENÇÃO DO GRAU DE DOUTOR EM CIÊNCIAS EM ENGENHARIA CIVIL, ÁREA DE MEIO AMBIENTE. Examinada por: ________________________________________________ Profa. Maria Claudia Barbosa, D.Sc. ________________________________________________ Prof. Andre Mantovani Oliveira, D.Sc. ________________________________________________ Prof. Marcelo Gomes Miguez, D.Sc. ________________________________________________ Prof. João Marcelo Alvarenga Braga, D.Sc. ________________________________________________ Profa. Sylvia Meimaridou Rola, D.Sc. RIO DE JANEIRO, RJ - BRASIL JULHO DE 2016 iv Silva, Bruno Rezende Telhados verdes em clima tropical: uma nova técnica e seu potencial de atenuação térmica/ Bruno Rezende Silva. – Rio de Janeiro: UFRJ/COPPE, 2016. XV, 168 p.: il.; 29,7 cm. Orientadores: Maria Claudia Barbosa e André Mantovani Tese (doutorado) – UFRJ/ COPPE/ Programa de Engenharia Civil, 2016. Referências Bibliográficas: p. 131-147. 1. Telhado verde. 2. Hidropônico. 3. Sem substrato. 4. Tropical. 5. Epífita. 6. Litófita. I. Barbosa, Maria Claudia et al. II. Universidade Federal do Rio de Janeiro, COPPE, Programa de Engenharia Civil. III. Título. -

Far North Coast Bromeliad Study Group N.S.W
Far North Coast Bromeliad Study Group N.S.W. Study Group meets the third Thursday of each month Next meeting 17th May 2012 at 11 a.m. Venue: PineGrove Bromeliad Nursery 114 Pine Street Wardell 2477 Phone (02) 6683 4188 Discussion: April 2012 General show & tell Editorial Team: Don Beard Ross Little & Helen Clewett [email protected] 1 Meeting 15th March 2012 The meeting was opened at 11:23am by Ron. A total of 32 members attended the meeting. Apologies were given for seven members. Ron mentioned that Rosemary Dalton had had a second operation and was on the mend. Laurie Mountford had also recovered. General Business Ross reminded the meeting that DVD’s containing Newsletters from various Groups and Societies from around Australia were available from the library. The disks are updated monthly. Also, with the author’s permission, member’s articles and photos used in our Newsletters and/or for presentations, would be retained by the library. Both Trish’s and Debbie’s originals have been filed. A copy of Derek Butcher’s (Uncle Derek) latest Tillandsia disk is now in the library. The issue of labelling sales and raffle broms was mentioned again (see p3, FNCBSG(NSW) Newsletter, March 2012). A much repeated discussion on label- ling followed. Ross pointed out that the whole idea of labelling is to make ones life easier, especially when you want to replace lost plants or plants you wish to obtain. You are not expected to remember all the names just retain the tags. In regard to library books, please ensure that the borrowing cards are filled out correctly when borrowing, and that your name is crossed out when the book is returned. -

Fernanda Maria Cordeiro De Oliveira Contribuições Aos Estudos Anatômicos De Bromeliaceae
Fernanda Maria Cordeiro de Oliveira Contribuições aos estudos anatômicos de Bromeliaceae (Poales) sob uma perspectiva filogenética Contribution to the anatomical studies of Bromeliaceae (Poales) under a phylogenetic perspective São Paulo 2017 Fernanda Maria Cordeiro de Oliveira Contribuições aos estudos anatômicos de Bromeliaceae (Poales) sob uma perspectiva filogenética Contribution to the anatomical studies of Bromeliaceae (Poales) under a phylogenetic perspective Tese apresentada ao Instituto de Biociências da Universidade de São Paulo, para a obtenção de Título de Doutora em Ciências Biológicas, na Área de Botânica. Orientadora: Profa. Dra. Gladys Flavia de Albuquerque Melo de Pinna Co-Orientadora: Profa. Dra. Maria das Graças Wanderley. São Paulo 2017 Oliveira, Fernanda Maria Cordeiro Contribuições aos estudos anatômicos de Bromeliaceae (Poales) sob uma perspectiva filogenética 161 páginas Tese (Doutorado) - Instituto de Biociências da Universidade de São Paulo. Departamento de Botânica. 1. Reconstrução de caracteres ancestrais; 2. Evolução; 3. Complexo Nidularióide; 4. Anatomia floral; 5. Tricomas glandulares I Universidade de São Paulo. Instituto de Biociências. Departamento de Botânica. Comissão Julgadora _______________________________ _______________________________ Prof(a). Dr(a). Prof(a). Dr(a). _______________________________ _______________________________ Prof(a). Dr(a). Prof(a). Dr(a). _______________________________ Profa. Dra. Gladys Flavia de Albuquerque Melo de Pinna (Orientadora) Àquela que me amou desde o primeiro olhar. “A humanidade é parte de um vasto universo em evolução. A Terra, nosso lar, está viva com uma comunidade de vida única. As forças da natureza fazem da existência uma aventura exigente e incerta, mas a Terra providenciou as condições essenciais para a evolução da vida. (...) O meio ambiente global com seus recursos finitos é uma preocupação comum de todas as pessoas. -

FLORIDA COUNCIL of BROMELIAD SOCIETIES Page 2
FLORIDA COUNCIL OF Volume 37 Issue 1 BROMELIAD SOCIETIES February 2017 FLORIDA COUNCIL OF BROMELIAD SOCIETIES Page 2 TABLE OF CONTENTS Table of Contents 2 FCBS Officers and Member Societies 3 I love Bromeliads by Carol Wolfe 4 Florida’s Native Plants by Karen Andreas 5 An Ecological Lexicon by Karen Andreas 10 What’s New at fcbs.org by Michael Andreas 10 2017 Calendar of Events 11 Remembering Roberto Burle Marx (1909-1994) by Herb Plever 12 Mexican Bromeliad Weevil Report by Teresa M. Cooper 17 A Word to the Wise - Anonymous 21 FCBS Draft Minutes by Patty Gonzales 22 Epiphyte Bromeliads at their Best by Tom Wolfe 24 Jay’s Archives by Jay Thurrott 29 These are photos of My Madness -Hybridizing by Mike Michalski 31 2017 Extravaganza Registration Form 32 2017 Extravaganza Schedule of Events 33 2017 Extravaganza Pamela Koide Hyatt, Keynote Speaker 34 2017 Extravaganza Ads for sale 35 2017 Extravaganza Sales Rules 36 This newsletter is published four times a year, February, May, August, and November, and is a publication of the Florida Council of Bromeliad Societies. Please submit your bromeliad related activities, articles, photographs, society shows, news and events, by the first of each of the above months of publication. All material, including articles and photographs, are copyrighted by FCBS, its authors and contributors and may be used by permission only. For permission to reprint any articles, photographs or materials, contact Karen Andreas at [email protected] FCBS TAX DEDUCTIBLE RECEIPTS The Florida Council of Bromeliad Societies, Inc. is a 501 (c) 3 Non-Profit Corporation, Incorporated in the State of Florida.