Struktur Komunitas Makrozoobenthos
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

January-February (1.58 Mbs)
January-February, 2012 __________________________________________________ Volume 53 no. 1 The club will meet at the usual time (7:00 PM) and place (SW Branch Jacksonville Public Library), and we have reprised the time-honored monthly date, the fourth Thursday (Jan. 26, 2012). The program will be presented by Charlotte Thorpe and Harry Lee on the club field trip to Cedar Key the weekend after Thanksgiving. Following the presentation there will be time allotted for show-and-tell as well as an ID clinic, so bring any west FL shells you might find of interest to the group and/or in need of identification. Brian Marshall will open the meeting with a chronicle of the New Years Day hunt for the first living specimen of the Panasoffkee Liptooth, the Shell-of-the-Month and a snail new to science. On February 23 we will convene at the usual time and place. On tap will be a presentation by Rick Edwards, who, with Roz and their son William, enjoyed a Caribbean cruise including Grand Cayman Island and Cozumel. He was able to get his feet in the water in both ports-of-call, and his underwater camera was fully operational. Harry Lee will talk about how he deployed pharmaceutical rep's to collect marine sediments in Grand Cayman and other Caribbean waters. A recently-named micromollusk provided by this armchair collecting method will be featured. ......................................................................................................................................................................... Eighteen Jacksonville Shell Club Members attended the Christmas Party hosted by Claire Newsome on December 10th. We enjoyed a wonderful dinner, a fun gift exchange, companionship, and a "Good Time" was had by all. -

ABSTRACT Title of Dissertation: PATTERNS IN
ABSTRACT Title of Dissertation: PATTERNS IN DIVERSITY AND DISTRIBUTION OF BENTHIC MOLLUSCS ALONG A DEPTH GRADIENT IN THE BAHAMAS Michael Joseph Dowgiallo, Doctor of Philosophy, 2004 Dissertation directed by: Professor Marjorie L. Reaka-Kudla Department of Biology, UMCP Species richness and abundance of benthic bivalve and gastropod molluscs was determined over a depth gradient of 5 - 244 m at Lee Stocking Island, Bahamas by deploying replicate benthic collectors at five sites at 5 m, 14 m, 46 m, 153 m, and 244 m for six months beginning in December 1993. A total of 773 individual molluscs comprising at least 72 taxa were retrieved from the collectors. Analysis of the molluscan fauna that colonized the collectors showed overwhelmingly higher abundance and diversity at the 5 m, 14 m, and 46 m sites as compared to the deeper sites at 153 m and 244 m. Irradiance, temperature, and habitat heterogeneity all declined with depth, coincident with declines in the abundance and diversity of the molluscs. Herbivorous modes of feeding predominated (52%) and carnivorous modes of feeding were common (44%) over the range of depths studied at Lee Stocking Island, but mode of feeding did not change significantly over depth. One bivalve and one gastropod species showed a significant decline in body size with increasing depth. Analysis of data for 960 species of gastropod molluscs from the Western Atlantic Gastropod Database of the Academy of Natural Sciences (ANS) that have ranges including the Bahamas showed a positive correlation between body size of species of gastropods and their geographic ranges. There was also a positive correlation between depth range and the size of the geographic range. -

Marine Shells of the Western Coast of Flordia
wm :iii! mm ilili ! Sfixing cHdL J^oad .Sandivicl'i, j\{ai.i.ach.u±£.tti. icuxucm \^*^£ FRONTISPIECE Photo by Ruth Bernhard Spondylus americanus Hermann MARINE SHELLS f>4 OF THE WESTERN COAST OF FLORIDA By LOUISE M. PERRY AND JEANNE S. SCHWENGEL With Revisions and Additions to Louise M. Perry's Marine Shells of the Southwest Coast of Florida Illustrations by W. Hammersley Southwick, Axel A. Olsson, and Frank White March, 1955 PALEONTOLOGICAL RESEARCH INSTITUTION ITHACA, NEW YORK U. S. A. MARINE SHELLS OF THE SOUTHWEST COAST OF FLORIDA printed as Bulletins of American Paleontology, vol. 26, No. 95 First printing, 1940 Second printing, 1942 Copyright, 1955, by Paleontological Research Institution Library of Congress Catalog Card Number: 5-^-12005 Printed in the United States of America // is perhaps a more fortunate destiny to have a taste for collecting shells than to be born a millionaire. Robert Louis Stevenson imeters 50 lllllllllllllllllllllllllllll II II III nil 2 Inches CONTENTS Page Preface by reviser 7 Foreword by Wm. J. Clench 9 Introduction 11 Generalia 13 Collection and preparation of specimens 17 Systematic descriptions 24 Class Amphineura :. 24 Class Pelecypoda 27 Class Scaphopoda 97 Class Gasteropoda 101 Plates 199 Index 311 PREFACE BY THE REVISER It has been a privilege to revise Louise M. Perry's fine book on "Marine Shells of Southwest Florida", to include her studies on eggs and larvae of mollusks; and to add descriptions and illustra- tions of several newly discovered shells thus making it a more com- prehensive study of the molluscan life of western Florida. The work that I have done is only a small return to Dr. -

Quaternary Micromolluscan Fuana of the Mudlump Province, Mississippi River Delta
Louisiana State University LSU Digital Commons LSU Historical Dissertations and Theses Graduate School 1967 Quaternary Micromolluscan Fuana of the Mudlump Province, Mississippi River Delta. James Xavier Corgan Louisiana State University and Agricultural & Mechanical College Follow this and additional works at: https://digitalcommons.lsu.edu/gradschool_disstheses Recommended Citation Corgan, James Xavier, "Quaternary Micromolluscan Fuana of the Mudlump Province, Mississippi River Delta." (1967). LSU Historical Dissertations and Theses. 1286. https://digitalcommons.lsu.edu/gradschool_disstheses/1286 This Dissertation is brought to you for free and open access by the Graduate School at LSU Digital Commons. It has been accepted for inclusion in LSU Historical Dissertations and Theses by an authorized administrator of LSU Digital Commons. For more information, please contact [email protected]. I This dissertation has been microfilmed exactly aa received CORGAN, James Xavier, 1930- QUATERNARY MICROMOLLUSCAN FAUNA OF THE MUDLUMP PROVINCE, MISSISSIPPI RIVER DELTA. Louisiana State University and Agricultural and Mechanical College, Ph.D., 1967 Geology University Microfilms, Inc., Ann Arbor, Michigan JAMES XAVIER CQRGAN 1Q£7 All Rights Reserved QUATERNARY MICROMOLLUSC AN FAUNA OF THE MUDLUMP PROVINCE, MISSISSIPPI RIVER DELTA A Dissertation Submitted to the Graduate Faculty of Louisiana State University and Agricultural and Mechanical College in partial fulfillment of the requirements for the degree of Doctor of Philosophy in The Department of Geology James X^Corgan B.A., New York University, 1955 M.A., Columbia University, 1957 June, 1967 ACKNOWLEDGMENTS Continuing aid and encouragement from Dr. Alan H. Cheetham and Dr. James P. Morgan made th is dissertation possible. Research was directed by Dr. Cheetham and essentially completed during his tenure as Associate Professor of Geology, Louisiana State University. -

Fasciolariidae
WMSDB - Worldwide Mollusc Species Data Base Family: FASCIOLARIIDAE Author: Claudio Galli - [email protected] (updated 07/set/2015) Class: GASTROPODA --- Clade: CAENOGASTROPODA-HYPSOGASTROPODA-NEOGASTROPODA-BUCCINOIDEA ------ Family: FASCIOLARIIDAE Gray, 1853 (Sea) - Alphabetic order - when first name is in bold the species has images Taxa=1523, Genus=128, Subgenus=5, Species=558, Subspecies=42, Synonyms=789, Images=454 abbotti , Polygona abbotti (M.A. Snyder, 2003) abnormis , Fusus abnormis E.A. Smith, 1878 - syn of: Coralliophila abnormis (E.A. Smith, 1878) abnormis , Latirus abnormis G.B. III Sowerby, 1894 abyssorum , Fusinus abyssorum P. Fischer, 1883 - syn of: Mohnia abyssorum (P. Fischer, 1884) achatina , Fasciolaria achatina P.F. Röding, 1798 - syn of: Fasciolaria tulipa (C. Linnaeus, 1758) achatinus , Fasciolaria achatinus P.F. Röding, 1798 - syn of: Fasciolaria tulipa (C. Linnaeus, 1758) acherusius , Chryseofusus acherusius R. Hadorn & K. Fraussen, 2003 aciculatus , Fusus aciculatus S. Delle Chiaje in G.S. Poli, 1826 - syn of: Fusinus rostratus (A.G. Olivi, 1792) acleiformis , Dolicholatirus acleiformis G.B. I Sowerby, 1830 - syn of: Dolicholatirus lancea (J.F. Gmelin, 1791) acmensis , Pleuroploca acmensis M. Smith, 1940 - syn of: Triplofusus giganteus (L.C. Kiener, 1840) acrisius , Fusus acrisius G.D. Nardo, 1847 - syn of: Ocinebrina aciculata (J.B.P.A. Lamarck, 1822) aculeiformis , Dolicholatirus aculeiformis G.B. I Sowerby, 1833 - syn of: Dolicholatirus lancea (J.F. Gmelin, 1791) aculeiformis , Fusus aculeiformis J.B.P.A. Lamarck, 1816 - syn of: Perrona aculeiformis (J.B.P.A. Lamarck, 1816) acuminatus, Latirus acuminatus (L.C. Kiener, 1840) acus , Dolicholatirus acus (A. Adams & L.A. Reeve, 1848) acuticostatus, Fusinus hartvigii acuticostatus (G.B. II Sowerby, 1880) acuticostatus, Fusinus acuticostatus G.B. -
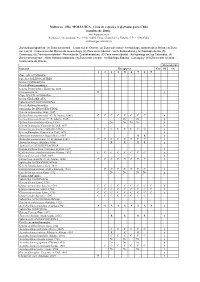
Moluscos - Filo MOLLUSCA
Moluscos - Filo MOLLUSCA. Lista de especies registradas para Cuba (octubre de 2006). José Espinosa Sáez Instituto de Oceanología, Ave 1ª No. 18406, Playa, Ciudad de La Habana, C.P. 11200, Cuba [email protected] Zonas biogeográficas: (1) Zona suroriental – Costa sur de Oriente, (2) Zona surcentral - Archipiélago Jardines de la Reina, (3) Zona sur central - Costa al sur del Macizo de Guamuhaya, (4) Zona suroccidental - Golfo de Batabanó y Archipiélago de los, (5) Canarreos, (6) Zona suroccidental - Península de Guanahacabibes, (7) Zona noroccidental - Archipiélago de Los Colorados, (8) Zona noroccidental - Norte Habana-Matanzas, (9) Zona norte-central - Archipiélago Sabana - Camagüey, (10) Zona norte-oriental - Costa norte de Oriente Abreviaturas Especies Bioegiones Cu Pl Oc 1 2 3 4 5 6 7 8 9 Clase APLACOPHORA Subclase SOLENOGASTRES Orden CAVIBELONIA Familia Proneomeniidae Género Proneomenia Hubrecht, 1880 Proneomenia sp . R x Clase POLYPLACOPHORA Orden NEOLORICATA Suborden ISCHNOCHITONINA Familia Ischnochitonidae Subfamilia ISCHNOCHITONINAE Género Ischnochiton Gray, 1847 Ischnochiton erythronotus (C. B. Adams, 1845) C C C C C C C C x Ischnochiton papillosus (C. B. Adams, 1845) Nc Nc x Ischnochiton striolatus (Gray, 1828) Nc Nc Nc Nc x Género Ischnoplax Carpenter in Dall, 1879 x Ischnoplax pectinatus (Sowerby, 1832) C C C C C C C C x Género Stenoplax Carpenter in Dall, 1879 x Stenoplax bahamensis Kaas y Belle, 1987 R R x Stenoplax purpurascens (C. B. Adams, 1845) C C C C C C C C x Stenoplax boogii (Haddon, 1886) R R R R x Subfamilia CALLISTOPLACINAE Género Callistochiton Carpenter in Dall, 1879 x Callistochiton shuttleworthianus Pilsbry, 1893 C C C C C C C C x Género Ceratozona Dall, 1882 x Ceratozona squalida (C. -

Identifying Gastropod Spawn from DNA Barcodes: Possible but Not Yet Practicable
Molecular Ecology Resources (2009) doi: 10.1111/j.1755-0998.2009.02576.x DNABlackwell Publishing Ltd BARCODING Identifying gastropod spawn from DNA barcodes: possible but not yet practicable N. PUILLANDRE,* E. E. STRONG,† P. BOUCHET,‡ M.-C. BOISSELIER,* A. COULOUX§ and S. SAMADI* *UMR 7138, Systématique, adaptation, évolution (UPMC/IRD/MNHN/CNRS), Université Pierre et Marie Curie (UPMC), CP26, 57 rue Cuvier, 75231 Paris cedex 05, France, †Department of Invertebrate Zoology, Smithsonian Institution, National Museum of Natural History, MRC 163, PO Box 37012, Washington, DC 20013-7012, USA, ‡Muséum National d’Histoire Naturelle, 57 rue Cuvier, 75231 Paris cedex 05, France, §GENOSCOPE, Centre National de Séquençage, 91000 Evry, France Abstract Identifying life stages of species with complex life histories is problematic as species are often only known and/or described from a single stage. DNA barcoding has been touted as an important tool for linking life-history stages of the same species. To test the current efficacy of DNA barcodes for identifying unknown mollusk life stages, 24 marine gastropod egg capsules were collected off the Philippines in deep water and sequenced for partial fragments of the COI, 16S and 12S mitochondrial genes. Two egg capsules of known shallow- water Mediterranean species were used to calibrate the method. These sequences were compared to those available in GenBank and the Barcode of Life Database (BOLD). Using COI sequences alone, only a single Mediterranean egg capsule was identified to species, and a single Philippine egg capsule was identified tentatively to genus; all other COI sequences recovered matches between 76% and 90% with sequences from BOLD and Gen- Bank. -

Diversity and Community Composition of Marine Mollusks Fauna on a Mainland Island of the Coast of Paraná, Southern Brazil
Pesquisa e Ensino em Ciências ISSN 2526-8236 (online edition) Exatas e da Natureza Pesquisa e Ensino em Ciências 2(1): 48–59 (2018) ARTICLE Research and Teaching in Exatas e da Natureza © 2018 UFCG / CFP / UACEN Exact and Natural Sciences Diversity and community composition of marine mollusks fauna on a mainland island of the coast of Paraná, southern Brazil Marcos de Vasconcellos Gernet1, Eduardo Colley2, Elizângela da Veiga Santos1,3 & Carlos João Birckolz1 (1) Universidade Federal do Paraná, Laboratório de Ecologia Aplicada e Bioinvasões, Rua Rio Grande do Norte 145, Mirassol 83255-000, Pontal do Paraná, Paraná, Brazil. E-mail: [email protected], [email protected] (2) Universidade de São Paulo, Museu de Zoologia, Avenida Nazaré 481, Ipiranga 04263-000, São Paulo, São Paulo, Brazil. E-mail: [email protected] (3) Universidade Federal do Paraná, Setor Litoral, Rua Jaguariaíva, 512, Caiobá 83260-000, Matinhos, Paraná, Brazil. E-mail: [email protected] Gernet M.V., Colley E., Santos E.V. & Birckolz C.J. (2018) Diversity and community composition of marine mollusks fauna on a mainland island of the coast of Paraná, southern Brazil. Pesquisa e Ensino em Ciências Exatas e da Natureza, 2(1): 48–59. http://dx.doi.org/10.29215/pecen.v2i1.580 Diversidade e composição da comunidade de moluscos marinhos de uma ilha continental do litoral do Paraná, sul do Brasil Resumo: A Ilha do Farol é uma ilha continental, no estado do Paraná, sul do Brasil. Devido à sua posição em relação ao continente, três ambientes distintos são observados nela: área de costão rochoso exposto ao mar aberto (A); área estuarina (B); área de praia arenosa (C). -

East Coast Marine Shells; Descriptions of Shore Mollusks Together With
fi*": \ EAST COAST MARINE SHELLS / A • •:? e p "I have seen A curious child, who dwelt upon a tract Of Inland ground, applying to his ear The .convolutions of a smooth-lipp'd shell; To yi'hJ|3h in silence hush'd, his very soul ListehM' .Intensely and his countenance soon Brightened' with joy: for murmerings from within Were heai>^, — sonorous cadences, whereby. To his b^ief, the monitor express 'd Myster.4?>us union with its native sea." Wordsworth 11 S 6^^ r EAST COAST MARINE SHELLS Descriptions of shore mollusks together with many living below tide mark, from Maine to Texas inclusive, especially Florida With more than one thousand drawings and photographs By MAXWELL SMITH EDWARDS BROTHERS, INC. ANN ARBOR, MICHIGAN J 1937 Copyright 1937 MAXWELL SMITH PUNTZO IN D,S.A. LUhoprinted by Edwards B'olheri. Inc.. LUhtiprinters and Publishert Ann Arbor, Michigan. iQfj INTRODUCTION lilTno has not felt the urge to explore the quiet lagoon, the sandy beach, the coral reef, the Isolated sandbar, the wide muddy tidal flat, or the rock-bound coast? How many rich harvests of specimens do these yield the collector from time to time? This volume is intended to answer at least some of these questions. From the viewpoint of the biologist, artist, engineer, or craftsman, shellfish present lessons in development, construction, symme- try, harmony and color which are almost unique. To the novice an acquaint- ance with these creatures will reveal an entirely new world which, in addi- tion to affording real pleasure, will supply much of practical value. Life is indeed limitless and among the lesser animals this is particularly true. -

Paleocommunities of the Yorktown Formation (Pliocene) of Virginia
i TITLE Paleocommunities of the Yorktown Formation (Pliocene) of Virginia Gwen M. Daley Dissertation submitted to the Faculty of the Virginia Polytechnic Institute and State University in partial fulfillment of the requirements of the degree of Doctor of Philosophy in Geological Sciences Richard K. Bambach (Chair) J Bret Bennington Lauck W. Ward Arnold I. Miller Michal Kowalewski August 6th, 1999 Blacksburg, Virginia Keywords: Paleocommunity, Molluscan Paleoecology, Yorktown Formation Copyright 1999, Gwen M. Daley ii Paleocommunities of the Yorktown Formation (Pliocene) of Virginia by Gwen M. Daley R.K. Bambach, Chairman Department of Geological Sciences, Virginia Polytechnic Institute and State University (ABSTRACT) The fossiliferous Yorktown Formation (Pliocene) of Virginia was used as a natural laboratory for testing predictions of ecological and evolutionary theories. Specifically, coordinated stasis and ecological locking models have testable elements that can be analyzed using data from the Yorktown Formation. The ecological locking model requires that species within an ecosystem have strong interactions in order to stabilize morphologies of multiple lineages over millions of years. Species intereactions that are strong enough to do this should also be strong enough to be a major ordering force on the composition of paleocommunities. Single and replicate samples were taken from 30 cm stratigraphic intervals within the Rushmere and Morgart's Beach Members at several localities. A total of 142 samples were collected from 5 localites, which yielded 29,000 specimens belonging to 140 species of bivalves, gastropods, and other taxonomic groups. Principle components analysis, ANOVA, MANOVA, and other analyses were used to test the occurence and recurrence of local paleocommunities, paleocommunities, and paleocommunity types. -

Mollusks Taken by Beam Trawl in the Vicinity of Gray's Reef National Marine Sanctuary on the Continental Shelf Off Georgia, Southeastern US
Mollusks taken by Beam Trawl in the vicinity of Gray's Reef National Marine Sanctuary on the Continental Shelf off Georgia, Southeastern U.S. Item Type monograph Authors Wolfe, Dougals A. Publisher NOAA/National Ocean Service/National Centers for Coastal Ocean Science/Center for Coastal Fisheries and Habitat Research Download date 26/09/2021 22:59:08 Link to Item http://hdl.handle.net/1834/19903 Mollusks taken by Beam Trawl in the vicinity of Gray’s Reef National Marine Sanctuary on the Continental Shelf off Georgia, Southeastern U.S. NOAA Technical Memorandum NOS NCCOS 88 Mention of trade names or commercial products does not constitute endorsement or recommendation for their use by the United States government. Citation for this Report Wolfe, Douglas A. 2008. Mollusks taken by Beam Trawl in the vicinity of Gray’s Reef National Marine Sanctuary on the Continental Shelf off Georgia, Southeastern U.S. NOAA Technical Memorandum NOS NCCOS 88. 40 pp. Mollusks taken by Beam Trawl in the vicinity of Gray’s Reef National Marine Sanctuary on the Continental Shelf off Georgia, Southeastern U.S. Douglas A. Wolfe* NOAA, National Ocean Service National Centers for Coastal Ocean Science Center for Coastal Fisheries and Habitat Research NOAA Beaufort Laboratory 101 Pivers Island Road Beaufort, North Carolina 28516 *(retired) Present address: 109 Shore Drive, Beaufort, NC 28516 NOAA Technical Memorandum NOS NCCOS 88 December, 2008 Table of Contents Abstract…………………………………………………………………….. iii Introduction…………………………………………………………………. 1 Methods………………………………………………………………….….. 2 Results………………………………………………………………….……. 4 Sample Characteristics………………………………………….…….. 4 Total Numbers of Taxa………………………………………….……. 6 Species Associations and Community Composition……….….….….. 7 Effect of Depth……………………………………………….…. 7 The “Atrina-Cymatium” Community………………………...… 10 Thee Nassarius acutus-Phascolion-Pythinella Connection…… 11 Rock-Dwelling Species………………………………………… 13 Range Extensions…………………………………………….………. -

Genetic Divergence Among Sympatric Populations of Three Species of Oyster Drills (Urosalpinx) in Cedar Key, Florida
BULLETIN OF MARINE SCIENCE, 82(1): 19–31, 2008 Genetic DIVergence among SYMPatric POPulations of THree SPecies of OYster Drills (UROSALPINX) in CEDar KEY, FloriDA John D. Robinson and Robert T. Dillon, Jr. Abstract Three gastropod species of the genus Urosalpinx inhabit intertidal and subtidal regions of the southeastern United States. Urosalpinx cinerea (Say, 1822) is native to the Atlantic coast from Newfoundland to northeast Florida, while Urosalpinx perrugata (Conrad, 1846) and Urosalpinx tampaensis (Conrad, 1846) are largely re- stricted to the Gulf of Mexico. The morphological similarity of U. cinerea and U. perrugata is so striking that they have been suggested to be subspecies. We used a combination of molecular and morphological methods to examine divergence among populations of these three nominal species in a newly discovered area of sympatry: Cedar Key, Florida. Significant shell morphological differences were de- tected among the three species, but overlapping ranges prevented unambiguous discrimination of U. cinerea and U. perrugata. A survey of gene frequencies at nine allozyme-encoding loci in the three Cedar Key populations (together with two al- lopatric controls) revealed multiple fixed differences between the species, confirm- ing their reproductive isolation. Interspecific mtDNA sequence divergence was ex- tensive (10.3%–17.3%), but well within the range of previously reported congeneric divergences. A neighbor-joining phylogeny grouped U. cinerea with U. perrugata, while U. tampaensis was found to be slightly more divergent. We suggest that the Florida peninsula may have served as a barrier to gene flow, promoting the allopat- ric speciation of U. cinerea and U. perrugata sometime after the divergence of U.