Initial Characterization of Cxxc5 As a Putative Dna Binding Protein
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

CXXC5 (Retinoid-Inducible Nuclear Factor, RINF) Is a Potential Therapeutic Target in High-Risk Human Acute Myeloid Leukemia
www.impactjournals.com/oncotarget/ Oncotarget, September, Vol.4, No 9 CXXC5 (Retinoid-Inducible Nuclear Factor, RINF) is a Potential Therapeutic Target in High-Risk Human Acute Myeloid Leukemia Audrey Astori1,2,3, Hanne Fredly4,5, Thomas Aquinas Aloysius6, Lars Bullinger7, Véronique Mansat-De Mas8,9, Pierre de la Grange10, François Delhommeau11,12, Karen Marie Hagen4,5, Christian Récher8,9, Isabelle Dusanter-Fourt1,2,3, Stian Knappskog6, Johan Richard Lillehaug6, Frédéric Pendino*,1,2,3,6, Øystein Bruserud*,4,5 1 Inserm, U1016, Institut Cochin, F-75014, Paris, France; 2 CNRS, UMR8104, F-75014, Paris, France; 3 Université Paris Descartes, Sorbonne Paris Cité, Paris, France; 4 Section for Hematology, Institute of Medicine, University of Bergen, Norway; 5 Department of Medicine, Haukeland University Hospital; Bergen, Norway; 6 Department of Molecular Biology, University of Bergen, Bergen, Norway; 7 Department of Internal Medicine III, University of Ulm, Ulm, Germany; 8 Inserm, Unité Mixte de Recherche 1037-Cancer Research Center of Toulouse, CNRS 5294, Université de Toulouse, Centre Hospitalier Universitaire Purpan, F-31059, Toulouse, France; 9 Service d’Hématologie, Centre Hospitalier Universitaire Purpan, Hôpital Purpan, F-31059, Toulouse, France; 10 GenoSplice, Hôpital Saint-Louis, F-75010, Paris, France; 11 UPMC, Pierre and Marie Curie University, GRC n°07, Groupe de Recherche Clinique sur les Myéloproliférations Aiguës et Chroniques MyPAC, F-75012, Paris, France; 12 AP-HP, Hôpital Saint-Antoine, Service d’Hématologie et Immunologie Biologiques, F-75012, Paris, France. * These two authors shared the last authorship. Correspondence to: Frédéric Pendino, email: [email protected] Keywords: Acute myeloid leukemia, CXXC5/RINF, chemotherapy, apoptosis Received: July 30, 2013 Accepted: August 13, 2013 Published: August 15, 2013 This is an open-access article distributed under the terms of the Creative Commons Attribution License, which permits unrestricted use, distribution, and reproduction in any medium, provided the original author and source are credited. -

Human Induced Pluripotent Stem Cell–Derived Podocytes Mature Into Vascularized Glomeruli Upon Experimental Transplantation
BASIC RESEARCH www.jasn.org Human Induced Pluripotent Stem Cell–Derived Podocytes Mature into Vascularized Glomeruli upon Experimental Transplantation † Sazia Sharmin,* Atsuhiro Taguchi,* Yusuke Kaku,* Yasuhiro Yoshimura,* Tomoko Ohmori,* ‡ † ‡ Tetsushi Sakuma, Masashi Mukoyama, Takashi Yamamoto, Hidetake Kurihara,§ and | Ryuichi Nishinakamura* *Department of Kidney Development, Institute of Molecular Embryology and Genetics, and †Department of Nephrology, Faculty of Life Sciences, Kumamoto University, Kumamoto, Japan; ‡Department of Mathematical and Life Sciences, Graduate School of Science, Hiroshima University, Hiroshima, Japan; §Division of Anatomy, Juntendo University School of Medicine, Tokyo, Japan; and |Japan Science and Technology Agency, CREST, Kumamoto, Japan ABSTRACT Glomerular podocytes express proteins, such as nephrin, that constitute the slit diaphragm, thereby contributing to the filtration process in the kidney. Glomerular development has been analyzed mainly in mice, whereas analysis of human kidney development has been minimal because of limited access to embryonic kidneys. We previously reported the induction of three-dimensional primordial glomeruli from human induced pluripotent stem (iPS) cells. Here, using transcription activator–like effector nuclease-mediated homologous recombination, we generated human iPS cell lines that express green fluorescent protein (GFP) in the NPHS1 locus, which encodes nephrin, and we show that GFP expression facilitated accurate visualization of nephrin-positive podocyte formation in -

CXXC5 Antibody (Pab)
21.10.2014CXXC5 antibody (pAb) Rabbit Anti-Human/Mouse/Rat CXXC-type zinc finger protein 5 (CF5, WID, RINF, HSPC195) Instruction Manual Catalog Number PK-AB718-6111 Synonyms CXXC5 Antibody: CXXC-type zinc finger protein 5, CF5, WID, RINF, HSPC195 Description CXXC5 is zinc finger protein closely related to the DVL1-binding protein CXXC4 (also known as Idax), and like CXXC4 is thought to modulate the Wnt signaling pathway during development. CXXC5 is upregulated in neural stem cells upon BMP4 stimulation, leading to decreased levels of the Wnt-signaling target AXIN2 and facilitated the response of the stem cells to Wnt3a. Recent reports suggest CXXC5 transcription is activated by the Wilms tumor 1 (WT1) transcription factor, and together are involved in the WNT/beta-catenin pathway and play a role in embryonic kidney development. Quantity 100 µg Source / Host Rabbit Immunogen CXXC5 antibody was raised against a 15 amino acid synthetic peptide near the amino terminus of human CXXC5. Purification Method Affinity chromatography purified via peptide column. Clone / IgG Subtype Polyclonal antibody Species Reactivity Human, Mouse, Rat Specificity At least two isoforms of CXXC5 are known to exist. CXXC5 antibody is predicted to not cross-react with other CXXC protein family members. Formulation Antibody is supplied in PBS containing 0.02% sodium azide. Reconstitution During shipment, small volumes of antibody will occasionally become entrapped in the seal of the product vial. For products with volumes of 200 μl or less, we recommend gently tapping the vial on a hard surface or briefly centrifuging the vial in a tabletop centrifuge to dislodge any liquid in the container’s cap. -

Epigenetic Characterization of Cxxc5 Gene Locus A
EPIGENETIC CHARACTERIZATION OF CXXC5 GENE LOCUS A THESIS SUBMITTED TO THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCES OF MIDDLE EAST TECHNICAL UNIVERSITY BY GİZEM KARS IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF MASTER OF SCIENCE IN MOLECULAR BIOLOGY AND GENETICS AUGUST 2018 Approval of the thesis: EPIGENETIC CHARACTERIZATION OF THE CXXC5 GENE LOCUS submitted by GİZEM KARS in partial fulfillment of the requirements for the degree of Master of Science in Molecular Biology and Genetics Department, Middle East Technical University by, Prof. Dr. Halil Kalıpçılar ____________________ Dean, Graduate School of Natural and Applied Sciences Prof. Dr. Orhan Adalı ____________________ Head of Department, Biological Sciences Prof. Dr. Mesut Muyan ____________________ Supervisor, Biological Sciences Dept., METU Examining Committee Members: Prof. Dr. A. Elif Erson-Bensan ____________________ Biological Sciences Dept., METU Prof. Dr. Mesut Muyan ____________________ Biological Sciences Dept., METU Assoc. Prof. Dr. Çağdaş Devrim Son ____________________ Biological Sciences Dept., METU Asst. Prof. Dr. Erkan Kiriş ____________________ Biological Sciences Dept., METU Asst. Prof. Dr. Murat Cevher ____________________ Molecular Biology and Genetics Dept., Bilkent University Date: 29.08.2018 I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work. Name, Last name : Gizem Kars Signature : iv ABSTRACT EPIGENETIC CHARACTERIZATION OF CXXC5 GENE LOCUS Kars, Gizem M.S., Molecular Biology and Genetics Department Supervisor: Prof. Dr. Mesut Muyan August 2018, 77 pages 17β-estradiol (E2), the main circulating form of estrogen, induces diverse cellular responses through Estrogen Receptor α and β (ERα and ER β). -

Research2007herschkowitzetvolume Al
Open Access Research2007HerschkowitzetVolume al. 8, Issue 5, Article R76 Identification of conserved gene expression features between comment murine mammary carcinoma models and human breast tumors Jason I Herschkowitz¤*†, Karl Simin¤‡, Victor J Weigman§, Igor Mikaelian¶, Jerry Usary*¥, Zhiyuan Hu*¥, Karen E Rasmussen*¥, Laundette P Jones#, Shahin Assefnia#, Subhashini Chandrasekharan¥, Michael G Backlund†, Yuzhi Yin#, Andrey I Khramtsov**, Roy Bastein††, John Quackenbush††, Robert I Glazer#, Powel H Brown‡‡, Jeffrey E Green§§, Levy Kopelovich, reviews Priscilla A Furth#, Juan P Palazzo, Olufunmilayo I Olopade, Philip S Bernard††, Gary A Churchill¶, Terry Van Dyke*¥ and Charles M Perou*¥ Addresses: *Lineberger Comprehensive Cancer Center. †Curriculum in Genetics and Molecular Biology, University of North Carolina at Chapel Hill, Chapel Hill, NC 27599, USA. ‡Department of Cancer Biology, University of Massachusetts Medical School, Worcester, MA 01605, USA. reports §Department of Biology and Program in Bioinformatics and Computational Biology, University of North Carolina at Chapel Hill, Chapel Hill, NC 27599, USA. ¶The Jackson Laboratory, Bar Harbor, ME 04609, USA. ¥Department of Genetics, University of North Carolina at Chapel Hill, Chapel Hill, NC 27599, USA. #Department of Oncology, Lombardi Comprehensive Cancer Center, Georgetown University, Washington, DC 20057, USA. **Department of Pathology, University of Chicago, Chicago, IL 60637, USA. ††Department of Pathology, University of Utah School of Medicine, Salt Lake City, UT 84132, USA. ‡‡Baylor College of Medicine, Houston, TX 77030, USA. §§Transgenic Oncogenesis Group, Laboratory of Cancer Biology and Genetics. Chemoprevention Agent Development Research Group, National Cancer Institute, Bethesda, MD 20892, USA. Department of Pathology, Thomas Jefferson University, Philadelphia, PA 19107, USA. Section of Hematology/Oncology, Department of Medicine, Committees on Genetics and Cancer Biology, University of Chicago, Chicago, IL 60637, USA. -

Estradiol-Estrogen Receptor Α Mediates the Expression of The
www.nature.com/scientificreports OPEN Estradiol-Estrogen Receptor α Mediates the Expression of the CXXC5 Gene through the Estrogen Received: 26 July 2016 Accepted: 02 November 2016 Response Element-Dependent Published: 25 November 2016 Signaling Pathway Pelin Yaşar, Gamze Ayaz & Mesut Muyan 17β-estradiol (E2), the primary circulating estrogen hormone, mediates physiological and pathophysiological functions of breast tissue mainly through estrogen receptor α (ERα). Upon binding to E2, ERα modulates the expression of target genes involved in the regulation of cellular proliferation primarily through interactions with specific DNA sequences, estrogen response elements (EREs). Our previous microarray results suggested that E2-ERα modulates CXXC5 expression. Because of the presence of a zinc-finger CXXC domain (ZF-CXXC), CXXC5 is considered to be a member of the ZF- CXXC family, which binds to non-methylated CpG dinucleotides. Although studies are limited, CXXC5 appears to participate as a transcription factor, co-regulator and/or epigenetic factor in the regulation of cellular events induced by various signaling pathways. However, how signaling pathways mediate the expression of CXXC5 is yet unclear. Due to the importance of E2-ERα signaling in breast tissue, changes in the CXXC5 transcription/synthesis could participate in E2-mediated cellular events as well. To address these issues, we initially examined the mechanism whereby E2-ERα regulates CXXC5 expression. We show here that CXXC5 is an E2-ERα responsive gene regulated by the interaction of E2-ERα with an ERE present at a region upstream of the initial translation codon of the gene. Estrogen hormones, particularly 17β -estradiol (E2) as the major estrogenic hormone in the circulation, play crit- ical roles in the homeodynamic regulation of many organ and tissue, including breast tissue, functions. -

CXXC5 Mediates Growth Plate Senescence and Is a Target for Enhancement of Longitudinal Bone Growth
Published Online: 10 April, 2019 | Supp Info: http://doi.org/10.26508/lsa.201800254 Downloaded from life-science-alliance.org on 27 September, 2021 Research Article CXXC5 mediates growth plate senescence and is a target for enhancement of longitudinal bone growth Sehee Choi1,2, Hyun-Yi Kim1,2, Pu-Hyeon Cha1,2, Seol Hwa Seo1,2, Chulho Lee1,2, Yejoo Choi1,2, Wookjin Shin1,2, Yunseok Heo1,3, Gyoonhee Han1,2, Weontae Lee1,3, Kang-Yell Choi1,2,4 Longitudinal bone growth ceases with growth plate senescence (Carel et al, 2004). However, the underlying mechanisms that regulate during puberty. However, the molecular mechanisms of this growth plate senescence are largely unknown. phenomenon are largely unexplored. Here, we examined Wnt- In recent years, accumulating evidence from basic and clinical responsive genes before and after growth plate senescence and studies revealed that chondrocyte activity and status is directly found that CXXC finger protein 5 (CXXC5), a negative regulator of subject to regulation by paracrine signaling within the growth plate the Wnt/β-catenin pathway, was gradually elevated with re- (Baron et al, 2015). Specifically, Wnt/β-catenin signaling has duction of Wnt/β-catenin signaling during senescent changes of emerged as a key player in growth plate maturation, and mutation 2/2 rodent growth plate. Cxxc5 mice demonstrated delayed of genes involved in the regulation of Wnt/β-catenin signaling growth plate senescence and tibial elongation. As CXXC5 func- often resulted in impaired bone growth. For example, cartilage- tions by interacting with dishevelled (DVL), we sought to identify specific loss of Ctnnb1 encoding β-catenin caused defects in small molecules capable of disrupting this interaction. -

The Loss of TET2 Promotes CD8+ T Cell Memory Differentiation Shannon A
The Loss of TET2 Promotes CD8+ T Cell Memory Differentiation Shannon A. Carty, Mercy Gohil, Lauren B. Banks, Renee M. Cotton, Matthew E. Johnson, Erietta Stelekati, Andrew D. This information is current as Wells, E. John Wherry, Gary A. Koretzky and Martha S. of September 24, 2021. Jordan J Immunol 2018; 200:82-91; Prepublished online 17 November 2017; doi: 10.4049/jimmunol.1700559 Downloaded from http://www.jimmunol.org/content/200/1/82 Supplementary http://www.jimmunol.org/content/suppl/2017/11/17/jimmunol.170055 Material 9.DCSupplemental http://www.jimmunol.org/ References This article cites 72 articles, 25 of which you can access for free at: http://www.jimmunol.org/content/200/1/82.full#ref-list-1 Why The JI? Submit online. • Rapid Reviews! 30 days* from submission to initial decision by guest on September 24, 2021 • No Triage! Every submission reviewed by practicing scientists • Fast Publication! 4 weeks from acceptance to publication *average Subscription Information about subscribing to The Journal of Immunology is online at: http://jimmunol.org/subscription Permissions Submit copyright permission requests at: http://www.aai.org/About/Publications/JI/copyright.html Email Alerts Receive free email-alerts when new articles cite this article. Sign up at: http://jimmunol.org/alerts The Journal of Immunology is published twice each month by The American Association of Immunologists, Inc., 1451 Rockville Pike, Suite 650, Rockville, MD 20852 Copyright © 2017 by The American Association of Immunologists, Inc. All rights reserved. Print ISSN: 0022-1767 Online ISSN: 1550-6606. The Journal of Immunology The Loss of TET2 Promotes CD8+ T Cell Memory Differentiation Shannon A. -

Studies of Zinc Finger Proteins in Epigenetic Gene Regulation Nan Liu
STUDIES OF ZINC FINGER PROTEINS IN EPIGENETIC GENE REGULATION NAN LIU MÜNCHEN 2014 STUDIES OF ZINC FINGER PROTEINS IN EPIGENETIC GENE REGULATION NAN LIU Dissertation an der Fakultät für Biologie der Ludwig‐Maximilians‐Universität München vorgelegt von Nan Liu aus Yushu, China München, den 2014 Erstgutachter: Prof. Dr. Heinrich Leonhardt Zweitgutachter: PD Dr. Anna Friedl Tag der mündlichen Prüfung: 04.12.2014 Contents Content Summary ...................................................................................................... i 1 Introduction .......................................................................................... 1 1.1 Epigenetic regulation ............................................................................ 2 1.1.1 DNA methylation ................................................................................................... 2 1.1.2 Histone modifications ............................................................................................ 4 1.2 Zinc finger proteins (ZFPs) and zinc finger motifs................................... 7 1.2.1 C2H2 type zinc fingers............................................................................................ 8 1.2.2 CXXC type zinc fingers .......................................................................................... 10 1.2.3 Treble clef type zinc fingers ................................................................................. 12 1.3 ZFPs act as modifiers in the epigenetic regulatory system .................... 17 1.3.1 Writers -

Gene Section Short Communication
Atlas of Genetics and Cytogenetics in Oncology and Haematology INIST -CNRS OPEN ACCESS JOURNAL Gene Section Short Communication CXXC5 (CXXC finger protein 5) Pelin Yasar, Mesut Muyan Department of Biological Sciences, Middle East Technical University, Ankara, Turkey (PY, MM) Published in Atlas Database: April 2014 Online updated version : http://AtlasGeneticsOncology.org/Genes/CXXC5ID52549ch5q31.html DOI: 10.4267/2042/55369 This work is licensed under a Creative Commons Attribution-Noncommercial-No Derivative Works 2.0 France Licence. © 2015 Atlas of Genetics and Cytogenetics in Oncology and Haematology Abstract DNA/RNA Review on CXXC5, with data on DNA/RNA, on Description the protein encoded and where the gene is implicated. The gene is on the plus strand and encompasses 35 kb of DNA. Identity The exon number of gene is 3 and parts of the Other names: CF5, RINF, WID second and third exons encode the protein (ENSP00000302543). HGNC (Hugo): CXXC5 Transcription Location: 5q31.2 1447 bp long mRNA; 969 bp long open reading Local order: From centromere to telomere: frame. SPATA24-DNAJC18-ECSCR-TMEM173- UBE2D2-CXXC5 -PSD2-NRG2. Pseudogene Note: Orientation on forward strand. No reported pseudogenes. Local order of CXXC5 is shown together with leading and subsequent genes on chromosome 5. The direction of arrows indicates transcriptional directions on the chromosome and arrow sizes approximate gene sizes. Atlas Genet Cytogenet Oncol Haematol. 2014; 19(1) 1 CXXC5 (CXXC finger protein 5) Yasar P, Muyan M Boxes are exons. The lines are introns. Shaded parts of the exon boxes are coding regions. Unshaded parts are noncoding regions. CXXC5 contains a nuclear localization signal adjacent to the CXXC-zinc finger domain. -

Functional Importance of Cxxc5 in E2-Driven Cellular Proliferation
FUNCTIONAL IMPORTANCE OF CXXC5 IN E2-DRIVEN CELLULAR PROLIFERATION A THESIS SUBMITTED TO THE GRADUATE SCHOOL OF NATURAL AND APPLIED SCIENCES OF MIDDLE EAST TECHNICAL UNIVERSITY BY NEGIN RAZIZADEH IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF MASTER OF SCIENCE IN BIOLOGY SEPTEMBER 2019 Approval of the thesis: FUNCTIONAL IMPORTANCE OF CXXC5 IN E2-DRIVEN CELLULAR PROLIFERATION submitted by NEGIN RAZIZADEH in partial fulfillment of the requirements for the degree of Master of Science in Biology Department, Middle East Technical University by, Prof. Dr. Halil Kalıpçılar Dean, Graduate School of Natural and Applied Sciences Prof. Dr. Ayşe Gül Gözen Head of Department, Biology Prof. Dr. Mesut Muyan Supervisor, Biology, METU Examining Committee Members: Assist. Prof. Dr. Erkan Kiriş Biological Sciences, Middle East Technical University Prof. Dr. Mesut Muyan Biology, METU Assist. Prof. Dr. Murat Alper Cevher Molecular Biology and Genetics, Bilkent University Date: 06.09.2019 I hereby declare that all information in this document has been obtained and presented in accordance with academic rules and ethical conduct. I also declare that, as required by these rules and conduct, I have fully cited and referenced all material and results that are not original to this work. Name, Surname: Negin Razizadeh Signature: iv ABSTRACT FUNCTIONAL IMPORTANCE OF CXXC5 IN E2-DRIVEN CELLULAR PROLIFERATION Razizadeh, Negin Master of Science, Biology Supervisor: Prof. Dr. Mesut Muyan September 2019, 82 pages 17β-estradiol (E2) as the main circulating estrogen hormone has an important role in the regulation of various tissues including mammary tissue. E2 effects target tissue functions by binding to the nuclear receptors, ERα and β. -
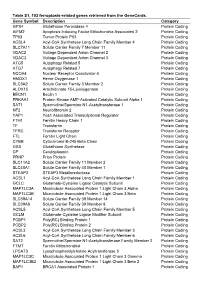
Table S1. 103 Ferroptosis-Related Genes Retrieved from the Genecards
Table S1. 103 ferroptosis-related genes retrieved from the GeneCards. Gene Symbol Description Category GPX4 Glutathione Peroxidase 4 Protein Coding AIFM2 Apoptosis Inducing Factor Mitochondria Associated 2 Protein Coding TP53 Tumor Protein P53 Protein Coding ACSL4 Acyl-CoA Synthetase Long Chain Family Member 4 Protein Coding SLC7A11 Solute Carrier Family 7 Member 11 Protein Coding VDAC2 Voltage Dependent Anion Channel 2 Protein Coding VDAC3 Voltage Dependent Anion Channel 3 Protein Coding ATG5 Autophagy Related 5 Protein Coding ATG7 Autophagy Related 7 Protein Coding NCOA4 Nuclear Receptor Coactivator 4 Protein Coding HMOX1 Heme Oxygenase 1 Protein Coding SLC3A2 Solute Carrier Family 3 Member 2 Protein Coding ALOX15 Arachidonate 15-Lipoxygenase Protein Coding BECN1 Beclin 1 Protein Coding PRKAA1 Protein Kinase AMP-Activated Catalytic Subunit Alpha 1 Protein Coding SAT1 Spermidine/Spermine N1-Acetyltransferase 1 Protein Coding NF2 Neurofibromin 2 Protein Coding YAP1 Yes1 Associated Transcriptional Regulator Protein Coding FTH1 Ferritin Heavy Chain 1 Protein Coding TF Transferrin Protein Coding TFRC Transferrin Receptor Protein Coding FTL Ferritin Light Chain Protein Coding CYBB Cytochrome B-245 Beta Chain Protein Coding GSS Glutathione Synthetase Protein Coding CP Ceruloplasmin Protein Coding PRNP Prion Protein Protein Coding SLC11A2 Solute Carrier Family 11 Member 2 Protein Coding SLC40A1 Solute Carrier Family 40 Member 1 Protein Coding STEAP3 STEAP3 Metalloreductase Protein Coding ACSL1 Acyl-CoA Synthetase Long Chain Family Member 1 Protein