Des Bienitz in Leipzig
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

(Aculeata) in Birch Stands of the Air-Polluted Area of Northern Bohemia
JOURNAL OF FOREST SCIENCE, 49, 2003 (4): 148–158 Hymenoptera (Aculeata) in birch stands of the air-polluted area of Northern Bohemia E. KULA1, P. TYRNER2 1Mendel University of Agriculture and Forestry, Faculty of Forestry and Wood Technology, Brno, Czech Republic 2Litvínov Grammar School, Litvínov, Czech Republic ABSTRACT: The Hymenoptera (Aculeata) fauna was studied in birch stands (Betula pendula Roth) of colder areas of Northern Bohemia using the method of Moericke’s yellow traps. Altogether 159 species were trapped; the most important were Andrena lappona, Vespula vulgaris, Halictus sp., Trypoxylon minus and Vespula rufa. Only 12.7% of the species are widely spread in this ecosystem type. In 1990–1994 and in 1995–1999 we compared the abundance of the fauna and discovered that many species of the families Apidae and Sphecidae receded from the birch stands due to changing site conditions (light, weed infestation). Keywords: Hymenoptera; Aculeata; Betula pendula; Moericke’s yellow traps; Northern Bohemia Birch (Betula pendula Roth) stands have been a sub- The attention of the majority of authors was focused stitute forest community for dead spruce stands in the on warmer localities of Bohemia that have a greater and air-polluted area of Northern Bohemia since 1980. The more interesting range of fauna (BALTHASAR 1954, fauna of this area has been the object of long-term inves- 1972; KOCOUREK 1966), in contrast to localities where tigations in the Děčín Sandstone Uplands. In this area we the climate is colder and more humid (TYRNER 1988, collected 861 species of moths (KULA 1997a); in addition, 1995). the crown fauna of birch includes 119 species of caterpil- The objective of the present study is to document the lars (KULA 1997b) and 71 species of bugs (KULA 1999). -

A Comprehensive Guide to Insects of Britain & Ireland
a comprehensive guide to insects of Britain & ireland To be launched Spring 2014. order your copy now and save over £7.50! Offer endS 31 March 2014 Special expected list price: £27.50 Pre-Publication special price: £19.95 offer you save: £7.50 A comprehensive guide to Insects of Britain & irelAnd by Paul D. Brock Special expected list price: £27.50 * Scientific Associate of the Pre-Publication special price: £19.95 Natural History Museum, offer you save: £7.50 London, and author of the acclaimed ‘Insects of the New Forest’ full colour photographs throughout, with fully comprehensive sections on all insect 2 Ants, bees and wasps Subfamily Andreninae Ants, bees and wasps 3 Andrena species form the majority of this large subfamily of small to large, mining (soil-nesting) bees; very few groups, including flies, bees and wasps nest communally. There are sometimes several species with similar appearance, thus care is needed in identification. Many have a single brood, but identification of others with two broods is so by seasonal variation. In a few species, giant males occur, with large heads and mandibles. metimes complicated species and a few Sphecodes species are cleptoparasites and parasitic flies are often seen around Colourful nests where it is fascinating to watch their behaviour. A selection of species in this popular genus is include Nomada widespread, some are very local. ISBN 978-1-874357-58-2 d; although Andrena angustior Body length: 8–11 mm. Small, distinguished by the long marginal area on 2nd tergite. Cleptoparasite probably Nomada fabriciana Flexibound, 195 × 135mm, around 500pp woodlands, meadows and sometimes heaths. -

Monitoring of Odonata in Britain and Possible Insights Into Climate Change
A peer-reviewed open-access journal BioRisk 5: 127–139Monitoring (2010) of Odonata in Britain and possible insights into climate change 127 doi: 10.3897/biorisk.5.846 RESEARCH ARTICLE BioRisk http://biorisk-journal.com/ Monitoring of Odonata in Britain and possible insights into climate change Adrian J. Parr 10 Orchard Way, Barrow, Bury St Edmunds, Suff olk IP29 5BX, Great Britain Corresponding author: Adrian J. Parr ([email protected]) Academic editor: Jürgen Ott | Received 29 July 2010 | Accepted 20 August 2010 | Published 30 December 2010 Citation: Parr AJ (2010) Monitoring of Odonata in Britain and possible insights into climate change. In: Ott J (Ed) (2010) Monitoring Climatic Change With Dragonfl ies. BioRisk 5: 127–139. doi: 10.3897/biorisk.5.846 Abstract Th e history of recording and monitoring of Odonata in Britain is briefl y described. Results are then pre- sented which suggest that the country’s Odonata fauna is currently in a period of fl ux, in a manner consist- ent with the actions of a high-level regulatory factor such as climate change. Th e ranges of many resident species are shifting. Leucorrhinia dubia has recently been lost from southern England, but many species are presently expanding their ranges to the north and west, some (such as Aeshna mixta and Anax imperator) with considerable speed. In addition to these changes, a number of ‘southern’ species have started to ap- pear in Britain for the very fi rst time. Th ese include Lestes barbarus, Erythromma viridulum (which has now become a locally-common resident in southeast England), Anax parthenope and Crocothemis erythraea. -

Functional Morphology and Evolution of the Sting Sheaths in Aculeata (Hymenoptera) 325-338 77 (2): 325– 338 2019
ZOBODAT - www.zobodat.at Zoologisch-Botanische Datenbank/Zoological-Botanical Database Digitale Literatur/Digital Literature Zeitschrift/Journal: Arthropod Systematics and Phylogeny Jahr/Year: 2019 Band/Volume: 77 Autor(en)/Author(s): Kumpanenko Alexander, Gladun Dmytro, Vilhelmsen Lars Artikel/Article: Functional morphology and evolution of the sting sheaths in Aculeata (Hymenoptera) 325-338 77 (2): 325– 338 2019 © Senckenberg Gesellschaft für Naturforschung, 2019. Functional morphology and evolution of the sting sheaths in Aculeata (Hymenoptera) , 1 1 2 Alexander Kumpanenko* , Dmytro Gladun & Lars Vilhelmsen 1 Institute for Evolutionary Ecology NAS Ukraine, 03143, Kyiv, 37 Lebedeva str., Ukraine; Alexander Kumpanenko* [[email protected]]; Dmytro Gladun [[email protected]] — 2 Natural History Museum of Denmark, SCIENCE, University of Copenhagen, Universitet- sparken 15, DK-2100, Denmark; Lars Vilhelmsen [[email protected]] — * Corresponding author Accepted on June 28, 2019. Published online at www.senckenberg.de/arthropod-systematics on September 17, 2019. Published in print on September 27, 2019. Editors in charge: Christian Schmidt & Klaus-Dieter Klass. Abstract. The sting of the Aculeata or stinging wasps is a modifed ovipositor; its function (killing or paralyzing prey, defense against predators) and the associated anatomical changes are apomorphic for Aculeata. The change in the purpose of the ovipositor/sting from being primarily an egg laying device to being primarily a weapon has resulted in modifcation of its handling that is supported by specifc morphological adaptations. Here, we focus on the sheaths of the sting (3rd valvulae = gonoplacs) in Aculeata, which do not penetrate and envenom the prey but are responsible for cleaning the ovipositor proper and protecting it from damage, identifcation of the substrate for stinging, and, in some taxa, contain glands that produce alarm pheromones. -
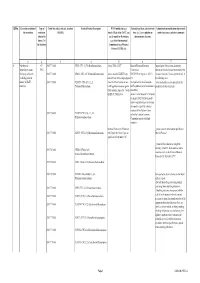
Qrno. 1 2 3 4 5 6 7 1 CP 2903 77 100 0 Cfcl3
QRNo. General description of Type of Tariff line code(s) affected, based on Detailed Product Description WTO Justification (e.g. National legal basis and entry into Administration, modification of previously the restriction restriction HS(2012) Article XX(g) of the GATT, etc.) force (i.e. Law, regulation or notified measures, and other comments (Symbol in and Grounds for Restriction, administrative decision) Annex 2 of e.g., Other International the Decision) Commitments (e.g. Montreal Protocol, CITES, etc) 12 3 4 5 6 7 1 Prohibition to CP 2903 77 100 0 CFCl3 (CFC-11) Trichlorofluoromethane Article XX(h) GATT Board of Eurasian Economic Import/export of these ozone destroying import/export ozone CP-X Commission substances from/to the customs territory of the destroying substances 2903 77 200 0 CF2Cl2 (CFC-12) Dichlorodifluoromethane Article 46 of the EAEU Treaty DECISION on August 16, 2012 N Eurasian Economic Union is permitted only in (excluding goods in dated 29 may 2014 and paragraphs 134 the following cases: transit) (all EAEU 2903 77 300 0 C2F3Cl3 (CFC-113) 1,1,2- 4 and 37 of the Protocol on non- On legal acts in the field of non- _to be used solely as a raw material for the countries) Trichlorotrifluoroethane tariff regulation measures against tariff regulation (as last amended at 2 production of other chemicals; third countries Annex No. 7 to the June 2016) EAEU of 29 May 2014 Annex 1 to the Decision N 134 dated 16 August 2012 Unit list of goods subject to prohibitions or restrictions on import or export by countries- members of the -

HBRG Atlas of Social Wasps
HBRG Atlas of Social Wasps HBRG has already produced atlases for bumblebees and ants. We are now planning a companion atlas for the social wasps. These are the ‘yellow-jacket’ wasps known (but not necessarily loved) by everyone. Saxon Wasp Dolichovespula saxonica (source). One major driver for this idea is the northward expansion of the Saxon Wasp Dolichovespula saxonica, which was first recorded in the UK in Surrey in 1987. It has since spread steadily northwards, and was in Highland by 2013. In 2018, it became obvious that it was well established in the north, at least as far north as Evanton on the Cromarty Firth in the east and Oban in the west. We in HBRG are in an ideal position to monitor its further spread. The German Wasp Vespula germanica, absent from Highland for decades, is now re-established in the Moray Firth area and is likely to spread farther. As we have only eight species recorded in Highland - and the Hornet has only a single record - it is a manageable group (see below). We know remarkably little about the distribution of even the common species. Another aim of the project is to establish a baseline against which to measure any changes in distribution caused by environmental change or by the colonisation by the Saxon Wasp. To succeed in discovering more, we do need the help of our members, especially those living in or visiting the more remote corners of the area. We will cooperate with a UK-wide project run by BWARS with very similar aims. The nature of the task Currently, only 11 of our 351 hectads (10km squares) have all 6 truly Highland species recorded since 1995 (the cut-off date for the Atlas); only 59 have three or more species; and 208 have none at all! In the coverage map opposite, blanks or pale grey squares need to be targeted. -

Gaddsteklar I Östergötland – Inventeringar I Sand- Och Grusmiljöer 2002-2007, Samt Övriga Fynd I Östergötlands Län
Gaddsteklar i Östergötland Inventeringar i sand- och grusmiljöer 2002-2007, samt övriga fynd i Östergötlands län LÄNSSTYRELSEN ÖSTERGÖTLAND Titel: Gaddsteklar i Östergötland – Inventeringar i sand- och grusmiljöer 2002-2007, samt övriga fynd i Östergötlands län Författare: Tommy Karlsson Utgiven av: Länsstyrelsen Östergötland Hemsida: http://www.e.lst.se Beställningsadress: Länsstyrelsen Östergötland 581 86 Linköping Länsstyrelsens rapport: 2008:9 ISBN: 978-91-7488-216-2 Upplaga: 400 ex Rapport bör citeras: Karlsson, T. 2008. Gaddsteklar i Östergötland – Inventeringar i sand- och grusmiljöer 2002-2007, samt övriga fynd i Östergötlands län. Länsstyrelsen Östergötland, rapport 2008:9. Omslagsbilder: Trätapetserarbi Megachile ligniseca Bålgeting Vespa crabro Finmovägstekel Arachnospila abnormis Illustrationer: Kenneth Claesson POSTADRESS: BESÖKSADRESS: TELEFON: TELEFAX: E-POST: WWW: 581 86 LINKÖPING Östgötagatan 3 013 – 19 60 00 013 – 10 31 18 [email protected] e.lst.se Rapport nr: 2008:9 ISBN: 978-91-7488-216-2 LÄNSSTYRELSEN ÖSTERGÖTLAND Förord Länsstyrelsen Östergötland arbetar konsekvent med för länet viktiga naturtyper inom naturvårdsarbetet. Med viktig menas i detta sammanhang biotoper/naturtyper som hyser en mångfald hotade arter och där Östergötland har ett stort ansvar – en stor andel av den svenska arealen och arterna. Det har tidigare inneburit stora satsningar på eklandskap, Omberg, skärgården, ängs- och hagmarker och våra kalkkärr och kalktorrängar. Till dessa naturtyper bör nu också de öppna sandmarkerna fogas. Denna inventering och sammanställning visar på dessa markers stora biologiska mångfald och rika innehåll av hotade och rödlistade arter. Detta är ju bra nog men dessutom betyder de solitära bina, humlorna och andra pollinerande insekter väldigt mycket för den ekologiska balansen och funktionaliteten i naturen. -

Aculeate Conservation Group/ Hymettus Report for 2006
Aculeate Conservation Group/ Hymettus Report for 2006 1. Background to 2006 Research. 1.1 During 2006 a new body, Hymettus Ltd., was constituted. Hymettus will take over and extend the role of the Aculeate Conservation Group. This report deals with research originally agreed at the 2005 ACG Annual Review and funded by English Nature (now also re-incarnated as Natural England), but executed under Hymettus Ltd.. During 2006 work was financially supported by English Nature, Earthwatch, Syngenta and the RSPB in accordance with the relevant Annex a documents, which see for details. 1.2 2005 Projects are reported in the following order of taxonomic group: ants, wasps, bees, other projects. 2. Ant Projects. 2.1 Formica exsecta 2.1.1 At the 2005 Review meeting Stephen Caroll was asked to enquire of the Devon Trust as to whether they would be prepared to consider looking at the possibility of proposing a landscape project for the Bovey Basin which would include the habitat requirements of Formica exsecta and , if so, whether a contribution from the ACG towards the costs of looking at this would be appropriate. 2.1.2 The Trust received this request enthusiastically and have submitted a copy of Andrew Taylor’s (their Officer) Report. Stephen Caroll will be able to bring us up to date with developments at the Review meting. The Report is presented here (appendices may be obtained from Mike Edwards): Landscape-scale habitat work in Devon’s Bovey Basin Report to Hymettus Limited, October 2006 1. Introduction The Bovey Basin is located in the Teignbridge district of South Devon. -

Cesare Brizio, Guido Pagliano & Filippo Maria Buzzetti
ANNALI DEL MUSEO CIVICO DI ROVERETO 36 2020 Sezione: Archeologia•Storia•Scienze Naturali Sezione: Archeologia 36 Storia 2020 Scienze Naturali DIRETTORE RESPONSABILE Alessandra Cattoi Comitato di Redazione Claudia Beretta, Alessio Bertolli, Barbara Maurina, Filippo Prosser, Gionata Stancher, Fabiana Zandonai, Elena Zeni. Fondazione Museo Civico di Rovereto Borgo S. Caterina 41, 38068 Rovereto Tel. 0464 452800 - Fax 0464 439487 www.fondazionemcr.it [email protected] ISSN 1720-9161 In copertina: L’apparato per le registrazioni ultrasoniche, che include il microfono Ultramic 250 e il computer portatile Asus Netbook. Ann. Mus. civ. Rovereto Sez.: Arch., St., Sc. nat. Vol. 36 279-296 2020 CESARE BRIZIO, GUIDO PAGLIANO & FILIPPO MARIA BUZZETTI THE BURROWING BUZZ OF SPHEX SP. EXTENDS TO THE INAUDIBLE RANGE Abstract - Cesare Brizio, Guido Pagliano & Filippo Maria Buzzetti - Th e burrowing buzz of Sphex sp. extends to the inaudible range. In recent years, several species of Orthopterans were fi eld-recorded by authors 1 and 3 thanks to an innovative, low cost USB microphone with a sampling frequency of 250 kHz. In August 2019, during an acoustic exploration for Orthopterans, author 1 intercepted sounds from a burrow in the soil, from which a Sphecid wasp – here tentatively determined as Sphex funerarius (Gussakovskij, 1934) – emerged and was photographed in suboptimal conditions during the recording session. While the quality of the digital audio tracks was satisfactory, the collection of the buzzing specimen proved unfeasible. We provide a concise review of scientifi c literature about burrowing behaviour in Sphecidae, in particular covering those sources that describe the buzzing sound associated with the burrow excavation, and propose a comprehensive review of the audio samples obtained, including envelopes, spectrograms and frequency analyses, and revealing the previously unreported extension well into the ultrasonic domain, up to 70 kHz and above, of the buzzing sound emitted by burrowing Sphecoidea. -

Yorkhill Green Spaces Wildlife Species List
Yorkhill Green Spaces Wildlife Species List April 2021 update Yorkhill Green Spaces Species list Draft list of animals, plants, fungi, mosses and lichens recorded from Yorkhill, Glasgow. Main sites: Yorkhill Park, Overnewton Park and Kelvinhaugh Park (AKA Cherry Park). Other recorded sites: bank of River Kelvin at Bunhouse Rd/ Old Dumbarton Rd, Clyde Expressway path, casual records from streets and gardens in Yorkhill. Species total: 711 Vertebrates: Amhibians:1, Birds: 57, Fish: 7, Mammals (wild): 15 Invertebrates: Amphipods: 1, Ants: 3, Bees: 26, Beetles: 21, Butterflies: 11, Caddisflies: 2, Centipedes: 3, Earthworms: 2, Earwig: 1, Flatworms: 1, Flies: 61, Grasshoppers: 1, Harvestmen: 2, Lacewings: 2, Mayflies: 2, Mites: 4, Millipedes: 3, Moths: 149, True bugs: 13, Slugs & snails: 21, Spiders: 14, Springtails: 2, Wasps: 13, Woodlice: 5 Plants: Flowering plants: 174, Ferns: 5, Grasses: 13, Horsetail: 1, Liverworts: 7, Mosses:17, Trees: 19 Fungi and lichens: Fungi: 24, Lichens: 10 Conservation Status: NameSBL - Scottish Biodiversity List Priority Species Birds of Conservation Concern - Red List, Amber List Last Common name Species Taxon Record Common toad Bufo bufo amphiban 2012 Australian landhopper Arcitalitrus dorrieni amphipod 2021 Black garden ant Lasius niger ant 2020 Red ant Myrmica rubra ant 2021 Red ant Myrmica ruginodis ant 2014 Buff-tailed bumblebee Bombus terrestris bee 2021 Garden bumblebee Bombus hortorum bee 2020 Tree bumblebee Bombus hypnorum bee 2021 Heath bumblebee Bombus jonellus bee 2020 Red-tailed bumblebee Bombus -

Sterol Addition During Pollen Collection by Bees
Sterol addition during pollen collection by bees: another possible strategy to balance nutrient deficiencies? Maryse Vanderplanck, Pierre-Laurent Zerck, Georges Lognay, Denis Michez To cite this version: Maryse Vanderplanck, Pierre-Laurent Zerck, Georges Lognay, Denis Michez. Sterol addition during pollen collection by bees: another possible strategy to balance nutrient deficiencies?. Apidologie, 2020, 51 (5), pp.826-843. 10.1007/s13592-020-00764-3. hal-02784696 HAL Id: hal-02784696 https://hal.archives-ouvertes.fr/hal-02784696 Submitted on 3 May 2021 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. Apidologie (2020) 51:826–843 Original article * INRAE, DIB and Springer-Verlag France SAS, part of Springer Nature, 2020 DOI: 10.1007/s13592-020-00764-3 Sterol addition during pollen collection by bees: another possible strategy to balance nutrient deficiencies? 1,2 1 3 1 Maryse VANDERPLANCK , Pierre-Laurent ZERCK , Georges LOGNAY , Denis MICHEZ 1Laboratory of Zoology, Research Institute for Biosciences, University of Mons, 20 Place du Parc, 7000, Mons, Belgium 2CNRS, UMR 8198 - Evo-Eco-Paleo, Univ. Lille, F-59000, Lille, France 3Analytical Chemistry, Agro Bio Chem Department, Gembloux Agro-Bio Tech University of Liège, 2 Passage des Déportés, 5030, Gembloux, Belgium Received 10 July 2019 – Revised2March2020– Accepted 30 March 2020 Abstract – Sterols are essential nutrients for bees which are thought to obtain them exclusively from pollen. -

Species Delimitation and Phylogeography of Aphonopelma Hentzi (Araneae, Mygalomorphae, Theraphosidae): Cryptic Diversity in North American Tarantulas
Species Delimitation and Phylogeography of Aphonopelma hentzi (Araneae, Mygalomorphae, Theraphosidae): Cryptic Diversity in North American Tarantulas Chris A. Hamilton1*, Daniel R. Formanowicz2, Jason E. Bond1 1 Auburn University Museum of Natural History and Department of Biological Sciences, Auburn University, Auburn, Alabama, United States of America, 2 Department of Biology, The University of Texas at Arlington, Arlington, Texas, United States of America Abstract Background: The primary objective of this study is to reconstruct the phylogeny of the hentzi species group and sister species in the North American tarantula genus, Aphonopelma, using a set of mitochondrial DNA markers that include the animal ‘‘barcoding gene’’. An mtDNA genealogy is used to consider questions regarding species boundary delimitation and to evaluate timing of divergence to infer historical biogeographic events that played a role in shaping the present-day diversity and distribution. We aimed to identify potential refugial locations, directionality of range expansion, and test whether A. hentzi post-glacial expansion fit a predicted time frame. Methods and Findings: A Bayesian phylogenetic approach was used to analyze a 2051 base pair (bp) mtDNA data matrix comprising aligned fragments of the gene regions CO1 (1165 bp) and ND1-16S (886 bp). Multiple species delimitation techniques (DNA tree-based methods, a ‘‘barcode gap’’ using percent of pairwise sequence divergence (uncorrected p- distances), and the GMYC method) consistently recognized a number of divergent and genealogically exclusive groups. Conclusions: The use of numerous species delimitation methods, in concert, provide an effective approach to dissecting species boundaries in this spider group; as well they seem to provide strong evidence for a number of nominal, previously undiscovered, and cryptic species.