Identifying Ecological Effects of Organic Toxicants and Metals Using
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-

List of Animal Species with Ranks October 2017
Washington Natural Heritage Program List of Animal Species with Ranks October 2017 The following list of animals known from Washington is complete for resident and transient vertebrates and several groups of invertebrates, including odonates, branchipods, tiger beetles, butterflies, gastropods, freshwater bivalves and bumble bees. Some species from other groups are included, especially where there are conservation concerns. Among these are the Palouse giant earthworm, a few moths and some of our mayflies and grasshoppers. Currently 857 vertebrate and 1,100 invertebrate taxa are included. Conservation status, in the form of range-wide, national and state ranks are assigned to each taxon. Information on species range and distribution, number of individuals, population trends and threats is collected into a ranking form, analyzed, and used to assign ranks. Ranks are updated periodically, as new information is collected. We welcome new information for any species on our list. Common Name Scientific Name Class Global Rank State Rank State Status Federal Status Northwestern Salamander Ambystoma gracile Amphibia G5 S5 Long-toed Salamander Ambystoma macrodactylum Amphibia G5 S5 Tiger Salamander Ambystoma tigrinum Amphibia G5 S3 Ensatina Ensatina eschscholtzii Amphibia G5 S5 Dunn's Salamander Plethodon dunni Amphibia G4 S3 C Larch Mountain Salamander Plethodon larselli Amphibia G3 S3 S Van Dyke's Salamander Plethodon vandykei Amphibia G3 S3 C Western Red-backed Salamander Plethodon vehiculum Amphibia G5 S5 Rough-skinned Newt Taricha granulosa -

Hungerford's Crawling Water Beetle (Brychius Hungerfordi)
COSEWIC Assessment and Status Report on the Hungerford’s Crawling Water Beetle Brychius hungerfordi in Canada ENDANGERED 2011 COSEWIC status reports are working documents used in assigning the status of wildlife species suspected of being at risk. This report may be cited as follows: COSEWIC. 2011. COSEWIC assessment and status report on the Hungerford’s Crawling Water Beetle Brychius hungerfordi in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa. ix + 40 pp. (www.sararegistry.gc.ca/status/status_e.cfm). Production note: COSEWIC would like to acknowledge Colin Jones for writing the status report on Hungerford’s Crawling Water Beetle (Brychius hungerfordi) in Canada, prepared under contract with Environment Canada. This report was overseen and edited by Paul Catling, Co-chair of the COSEWIC Arthropods Specialist Subcommittee. For additional copies contact: COSEWIC Secretariat c/o Canadian Wildlife Service Environment Canada Ottawa, ON K1A 0H3 Tel.: 819-953-3215 Fax: 819-994-3684 E-mail: COSEWIC/[email protected] http://www.cosewic.gc.ca Également disponible en français sous le titre Ếvaluation et Rapport de situation du COSEPAC sur l’haliplide de Hungerford (Brychius hungerfordi) au Canada. Cover illustration/photo: Hungerford’s Crawling Water Beetle — Photo provided by S.A. Marshall, University of Guelph. ©Her Majesty the Queen in Right of Canada, 2011. Catalogue No. CW69-14/627-2011E-PDF ISBN 978-1-100-18679-5 Recycled paper COSEWIC Assessment Summary Assessment Summary – May 2011 Common name Hungerford’s Crawling Water Beetle Scientific name Brychius hungerfordi Status Endangered Reason for designation A probable early postglacial relict, this water beetle is endemic to the upper Great Lakes and is Endangered in the U.S. -

Trichoptera:Hydropsychidae) Based on DNA and Morphological Evidence Christy Jo Geraci National Museum on Natural History, Smithsonian Institute
Clemson University TigerPrints Publications Biological Sciences 3-2010 Defining the Genus Hydropsyche (Trichoptera:Hydropsychidae) Based on DNA and Morphological Evidence Christy Jo Geraci National Museum on Natural History, Smithsonian Institute Xin Zhou University of Guelph John C. Morse Clemson University, [email protected] Karl M. Kjer Rutgers University - New Brunswick/Piscataway Follow this and additional works at: https://tigerprints.clemson.edu/bio_pubs Part of the Biology Commons Recommended Citation Please use publisher's recommended citation. This Article is brought to you for free and open access by the Biological Sciences at TigerPrints. It has been accepted for inclusion in Publications by an authorized administrator of TigerPrints. For more information, please contact [email protected]. J. N. Am. Benthol. Soc., 2010, 29(3):918–933 ’ 2010 by The North American Benthological Society DOI: 10.1899/09-031.1 Published online: 29 June 2010 Defining the genus Hydropsyche (Trichoptera:Hydropsychidae) based on DNA and morphological evidence Christy Jo Geraci1 Department of Entomology, National Museum of Natural History, Smithsonian Institution, Washington, DC 20013-7012 USA Xin Zhou2 Biodiversity Institute of Ontario, University of Guelph, Guelph, Ontario, N1G 2W1 Canada John C. Morse3 Department of Entomology, Soils, and Plant Sciences, Clemson University, Clemson, South Carolina 29634 USA Karl M. Kjer4 Department of Ecology, Evolution and Natural Resources, School of Environmental and Biological Sciences, Rutgers University, New Brunswick, New Jersey 08901 USA Abstract. In this paper, we review the history of Hydropsychinae genus-level classification and nomenclature and present new molecular evidence from mitochondrial cytochrome c oxidase subunit I (COI) and nuclear large subunit ribosomal ribonucleic acid (28S) markers supporting the monophyly of the genus Hydropsyche. -
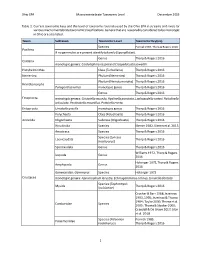
Ohio EPA Macroinvertebrate Taxonomic Level December 2019 1 Table 1. Current Taxonomic Keys and the Level of Taxonomy Routinely U
Ohio EPA Macroinvertebrate Taxonomic Level December 2019 Table 1. Current taxonomic keys and the level of taxonomy routinely used by the Ohio EPA in streams and rivers for various macroinvertebrate taxonomic classifications. Genera that are reasonably considered to be monotypic in Ohio are also listed. Taxon Subtaxon Taxonomic Level Taxonomic Key(ies) Species Pennak 1989, Thorp & Rogers 2016 Porifera If no gemmules are present identify to family (Spongillidae). Genus Thorp & Rogers 2016 Cnidaria monotypic genera: Cordylophora caspia and Craspedacusta sowerbii Platyhelminthes Class (Turbellaria) Thorp & Rogers 2016 Nemertea Phylum (Nemertea) Thorp & Rogers 2016 Phylum (Nematomorpha) Thorp & Rogers 2016 Nematomorpha Paragordius varius monotypic genus Thorp & Rogers 2016 Genus Thorp & Rogers 2016 Ectoprocta monotypic genera: Cristatella mucedo, Hyalinella punctata, Lophopodella carteri, Paludicella articulata, Pectinatella magnifica, Pottsiella erecta Entoprocta Urnatella gracilis monotypic genus Thorp & Rogers 2016 Polychaeta Class (Polychaeta) Thorp & Rogers 2016 Annelida Oligochaeta Subclass (Oligochaeta) Thorp & Rogers 2016 Hirudinida Species Klemm 1982, Klemm et al. 2015 Anostraca Species Thorp & Rogers 2016 Species (Lynceus Laevicaudata Thorp & Rogers 2016 brachyurus) Spinicaudata Genus Thorp & Rogers 2016 Williams 1972, Thorp & Rogers Isopoda Genus 2016 Holsinger 1972, Thorp & Rogers Amphipoda Genus 2016 Gammaridae: Gammarus Species Holsinger 1972 Crustacea monotypic genera: Apocorophium lacustre, Echinogammarus ischnus, Synurella dentata Species (Taphromysis Mysida Thorp & Rogers 2016 louisianae) Crocker & Barr 1968; Jezerinac 1993, 1995; Jezerinac & Thoma 1984; Taylor 2000; Thoma et al. Cambaridae Species 2005; Thoma & Stocker 2009; Crandall & De Grave 2017; Glon et al. 2018 Species (Palaemon Pennak 1989, Palaemonidae kadiakensis) Thorp & Rogers 2016 1 Ohio EPA Macroinvertebrate Taxonomic Level December 2019 Taxon Subtaxon Taxonomic Level Taxonomic Key(ies) Informal grouping of the Arachnida Hydrachnidia Smith 2001 water mites Genus Morse et al. -

Position Specificity in the Genus Coreomyces (Laboulbeniomycetes, Ascomycota)
VOLUME 1 JUNE 2018 Fungal Systematics and Evolution PAGES 217–228 doi.org/10.3114/fuse.2018.01.09 Position specificity in the genus Coreomyces (Laboulbeniomycetes, Ascomycota) H. Sundberg1*, Å. Kruys2, J. Bergsten3, S. Ekman2 1Systematic Biology, Department of Organismal Biology, Evolutionary Biology Centre, Uppsala University, Uppsala, Sweden 2Museum of Evolution, Uppsala University, Uppsala, Sweden 3Department of Zoology, Swedish Museum of Natural History, Stockholm, Sweden *Corresponding author: [email protected] Key words: Abstract: To study position specificity in the insect-parasitic fungal genus Coreomyces (Laboulbeniaceae, Laboulbeniales), Corixidae we sampled corixid hosts (Corixidae, Heteroptera) in southern Scandinavia. We detected Coreomyces thalli in five different DNA positions on the hosts. Thalli from the various positions grouped in four distinct clusters in the resulting gene trees, distinctly Fungi so in the ITS and LSU of the nuclear ribosomal DNA, less so in the SSU of the nuclear ribosomal DNA and the mitochondrial host-specificity ribosomal DNA. Thalli from the left side of abdomen grouped in a single cluster, and so did thalli from the ventral right side. insect Thalli in the mid-ventral position turned out to be a mix of three clades, while thalli growing dorsally grouped with thalli from phylogeny the left and right abdominal clades. The mid-ventral and dorsal positions were found in male hosts only. The position on the left hemelytron was shared by members from two sister clades. Statistical analyses demonstrate a significant positive correlation between clade and position on the host, but also a weak correlation between host sex and clade membership. These results indicate that sex-of-host specificity may be a non-existent extreme in a continuum, where instead weak preferences for one host sex may turn out to be frequent. -

UBC 1978 A6 7 C35.Pdf
THE INFLUENCE OF TEMPERATURE AND SALINITY ON THE CUTICULAR PERMEABILITY OF SOME CORIXIDAE by SYDNEY GRAHAM CANNINGS B.Sc, University of British Columbia, 1975 A THESIS SUBMITTED IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF MASTER OF SCIENCE in THE FACULTY OF GRADUATE STUDIES (Department of Zoology) We accept this thesis as conforming to the required standard THE UNIVERSITY OF BRITISH COLUMBIA November, 19 77 © Sydney Graham Cannings, 1977 In presenting this thesis in partial fulfilment of the requirements for an advanced degree at the University of British Columbia, I agree that the Library shall make it freely available for reference and study. I further agree that permission for extensive copying of this thesis for scholarly purposes may be granted by the Head of my Department or by his representatives. It is understood that copying or publication of this thesis for financial gain shall not be allowed without my written permission. Department of ZOOLOGY The University of British Columbia 2075 Wesbrook Place Vancouver, Canada V6T 1W5 Date November 14, 1977 ABSTRACT Most terrestrial, and many aquatic insects are made waterproof by a layer of lipid in or on the epicuticle. At a specific temperature, which is determined by their composition, these lipids undergo a phase .transition which markedly increases the permeability of the integument. The major purpose of this study was to assess the possibility that epicutic.ular wax transition could differ• entially affect the distribution of four species of water boatmen: Cenocorixa bifida hungerfordi Lansbury, Ceno- corixa expleta (Uhler), Cenocorixa blaisdelli. (Hunger- ford) , and Callicorixa vulnerata (Uhler). -

Thesis the Assimti...Ation and Elwination of Cesium By
THESIS THE ASSIMTI...ATION AND ELWINATION OF CESIUM BY FRESHWATER INVERTEBRATES Submitted by Tracy M. Tostowaryk Graduate Degree Program in Ecology In partial fulfillment of the requirements For the Degree of Master of Science Colorado State University Fort Collins, Colorado Fall 2000 QL 3bS.3b'5" .lb11 :2.0DO COLORADO STATE UNIVERSITY November 6, 2000 WE HEREBY RECOMMEND THAT THE THESIS PREPARED UNDER OUR SUPERVISION BY TRACY M. TOSTOWARYK ENTITLED "THE ASSIMILATION AND ELIMINATION OF CESIUM BY FRESHWATER INVERTEBRATES" BE ACCEPTED AS FULFILLING IN PART REQUIREMENTS FOR THE DEGREE OF MASTER OF SCIENCE. Adviser Co-Adviser ii COLORADO STATE UNIV. LIBRARIES ABSTRACT OF THESIS THE ASSIMILATION AND ELIMINATION OF CESIUM BY FRESHWATER INVERTEBRATES Freshwater invertebrates are important vectors of radioactive cesium e34Cs and 137CS) in aquatic food webs, yet little is known about their cesium :uptake and loss kinetics. This study provides a detailed investigation of cesium assimilation and elimination by freshwater invertebrates. Using five common freshwater invertebrates (Gammarus lacustris, Anisoptera sp. nymphs, Claassenia sabulosa and Megarcys signata nymphs, and Orconetes sp.), a variety of food types (oligochaete worms, mayfly nymphs and algae) and six temperature treatments (3.5 to 30°C), the following hypotheses were tested: 1) cesium elimination rates are a positive function of water temperature; 2) cesium elimination rates increase with decreasing body size; 3) assimilation efficiencies range between 0.6 and 0.8 for diet items low in clay. Cesium loss exhibited first order, non-linear kinetics, best described by a two component exponential model. Cesium assimilation efficiencies were higher for invertebrates fed oligochaetes (0.77) and algae (0.80) than those fed mayfly nymphs (0.20). -

ARTHROPODA Subphylum Hexapoda Protura, Springtails, Diplura, and Insects
NINE Phylum ARTHROPODA SUBPHYLUM HEXAPODA Protura, springtails, Diplura, and insects ROD P. MACFARLANE, PETER A. MADDISON, IAN G. ANDREW, JOCELYN A. BERRY, PETER M. JOHNS, ROBERT J. B. HOARE, MARIE-CLAUDE LARIVIÈRE, PENELOPE GREENSLADE, ROSA C. HENDERSON, COURTenaY N. SMITHERS, RicarDO L. PALMA, JOHN B. WARD, ROBERT L. C. PILGRIM, DaVID R. TOWNS, IAN McLELLAN, DAVID A. J. TEULON, TERRY R. HITCHINGS, VICTOR F. EASTOP, NICHOLAS A. MARTIN, MURRAY J. FLETCHER, MARLON A. W. STUFKENS, PAMELA J. DALE, Daniel BURCKHARDT, THOMAS R. BUCKLEY, STEVEN A. TREWICK defining feature of the Hexapoda, as the name suggests, is six legs. Also, the body comprises a head, thorax, and abdomen. The number A of abdominal segments varies, however; there are only six in the Collembola (springtails), 9–12 in the Protura, and 10 in the Diplura, whereas in all other hexapods there are strictly 11. Insects are now regarded as comprising only those hexapods with 11 abdominal segments. Whereas crustaceans are the dominant group of arthropods in the sea, hexapods prevail on land, in numbers and biomass. Altogether, the Hexapoda constitutes the most diverse group of animals – the estimated number of described species worldwide is just over 900,000, with the beetles (order Coleoptera) comprising more than a third of these. Today, the Hexapoda is considered to contain four classes – the Insecta, and the Protura, Collembola, and Diplura. The latter three classes were formerly allied with the insect orders Archaeognatha (jumping bristletails) and Thysanura (silverfish) as the insect subclass Apterygota (‘wingless’). The Apterygota is now regarded as an artificial assemblage (Bitsch & Bitsch 2000). -

Rationales for Animal Species Considered for Species of Conservation Concern, Sequoia National Forest
Rationales for Animal Species Considered for Species of Conservation Concern Sequoia National Forest Prepared by: Wildlife Biologists and Biologist Planner Regional Office, Sequoia National Forest and Washington Office Enterprise Program For: Sequoia National Forest June 2019 In accordance with Federal civil rights law and U.S. Department of Agriculture (USDA) civil rights regulations and policies, the USDA, its Agencies, offices, and employees, and institutions participating in or administering USDA programs are prohibited from discriminating based on race, color, national origin, religion, sex, gender identity (including gender expression), sexual orientation, disability, age, marital status, family/parental status, income derived from a public assistance program, political beliefs, or reprisal or retaliation for prior civil rights activity, in any program or activity conducted or funded by USDA (not all bases apply to all programs). Remedies and complaint filing deadlines vary by program or incident. Persons with disabilities who require alternative means of communication for program information (e.g., Braille, large print, audiotape, American Sign Language, etc.) should contact the responsible Agency or USDA’s TARGET Center at (202) 720-2600 (voice and TTY) or contact USDA through the Federal Relay Service at (800) 877-8339. Additionally, program information may be made available in languages other than English. To file a program discrimination complaint, complete the USDA Program Discrimination Complaint Form, AD-3027, found online at http://www.ascr.usda.gov/complaint_filing_cust.html and at any USDA office or write a letter addressed to USDA and provide in the letter all of the information requested in the form. To request a copy of the complaint form, call (866) 632-9992. -

A Comparison of Aquatic Invertebrate Assemblages Collected from the Green River in Dinosaur National Monument in 1962 and 2001
A Comparison of Aquatic Invertebrate Assemblages Collected from the Green River in Dinosaur National Monument in 1962 and 2001 Final Report for United States Department of the Interior National Park Service Dinosaur National Monument 4545 East Highway 40 Dinosaur, Colorado 81610-9724 Report Prepared by: Dr. Mark Vinson, Ph.D. & Ms. Erin Thompson National Aquatic Monitoring Center Department o f Fisheries and Wildlife Utah State University Logan, Utah 84322-5210 www.usu.edu/buglab 22 January 2002 i Foreword The work described in this report was conducted by personnel of the National Aquatic Monitoring Center, Utah State University, Logan, Utah. Mr. J. Matt Tagg aided in the identification of the aquatic invertebrates. Ms. Leslie Ogden provided computer assistance. Several people at Dinosaur National Monument helped us immensely with various project details. Steve Petersburg, Dana Dilsaver, and Dennis Ditmanson provided us with our research permit. Ann Elder helped with sample archiving. Christy Wright scheduled our trip and provided us with our river permit. We thank them all for all their help and good spirit. We also thank Mr. Walter Kittams (National Park Service, Regional Office, Omaha Nebraska) and Mr. Earl M. Semingsen (Superintendent, Dinosaur National Monument) for funding the study and the members of the 1962 University of Utah expedition: Dr. Angus M. Woodbury, Dr. Stephen Durrant, Mr. Delbert Argyle, Mr. Douglas Anderson, and Dr. Seville Flowers for their foresight to conduct the original study nearly 40 years ago. The concept and value of long-term ecological data is often bantered about, but its value is never more apparent then when we conduct studies like that presented here. -

100 Characters
40 Review and Update of Non-mollusk Invertebrate Species in Greatest Need of Conservation: Final Report Leon C. Hinz Jr. and James N. Zahniser Illinois Natural History Survey Prairie Research Institute University of Illinois 30 April 2015 INHS Technical Report 2015 (31) Prepared for: Illinois Department of Natural Resources State Wildlife Grant Program (Project Number T-88-R-001) Unrestricted: for immediate online release. Prairie Research Institute, University of Illinois at Urbana Champaign Brian D. Anderson, Interim Executive Director Illinois Natural History Survey Geoffrey A. Levin, Acting Director 1816 South Oak Street Champaign, IL 61820 217-333-6830 Final Report Project Title: Review and Update of Non-mollusk Invertebrate Species in Greatest Need of Conservation. Project Number: T-88-R-001 Contractor information: University of Illinois at Urbana/Champaign Institute of Natural Resource Sustainability Illinois Natural History Survey 1816 South Oak Street Champaign, IL 61820 Project Period: 1 October 2013—31 September 2014 Principle Investigator: Leon C. Hinz Jr., Ph.D. Stream Ecologist Illinois Natural History Survey One Natural Resources Way, Springfield, IL 62702-1271 217-785-8297 [email protected] Prepared by: Leon C. Hinz Jr. & James N. Zahniser Goals/ Objectives: (1) Review all SGNC listing criteria for currently listed non-mollusk invertebrate species using criteria in Illinois Wildlife Action Plan, (2) Assess current status of species populations, (3) Review criteria for additional species for potential listing as SGNC, (4) Assess stressors to species previously reviewed, (5) Complete draft updates and revisions of IWAP Appendix I and Appendix II for non-mollusk invertebrates. T-88 Final Report Project Title: Review and Update of Non-mollusk Invertebrate Species in Greatest Need of Conservation. -

Full Issue for TGLE Vol. 53 Nos. 1 & 2
The Great Lakes Entomologist Volume 53 Numbers 1 & 2 - Spring/Summer 2020 Numbers Article 1 1 & 2 - Spring/Summer 2020 Full issue for TGLE Vol. 53 Nos. 1 & 2 Follow this and additional works at: https://scholar.valpo.edu/tgle Part of the Entomology Commons Recommended Citation . "Full issue for TGLE Vol. 53 Nos. 1 & 2," The Great Lakes Entomologist, vol 53 (1) Available at: https://scholar.valpo.edu/tgle/vol53/iss1/1 This Full Issue is brought to you for free and open access by the Department of Biology at ValpoScholar. It has been accepted for inclusion in The Great Lakes Entomologist by an authorized administrator of ValpoScholar. For more information, please contact a ValpoScholar staff member at [email protected]. et al.: Full issue for TGLE Vol. 53 Nos. 1 & 2 Vol. 53, Nos. 1 & 2 Spring/Summer 2020 THE GREAT LAKES ENTOMOLOGIST PUBLISHED BY THE MICHIGAN ENTOMOLOGICAL SOCIETY Published by ValpoScholar, 1 The Great Lakes Entomologist, Vol. 53, No. 1 [], Art. 1 THE MICHIGAN ENTOMOLOGICAL SOCIETY 2019–20 OFFICERS President Elly Maxwell President Elect Duke Elsner Immediate Pate President David Houghton Secretary Adrienne O’Brien Treasurer Angie Pytel Member-at-Large Thomas E. Moore Member-at-Large Martin Andree Member-at-Large James Dunn Member-at-Large Ralph Gorton Lead Journal Scientific Editor Kristi Bugajski Lead Journal Production Editor Alicia Bray Associate Journal Editor Anthony Cognato Associate Journal Editor Julie Craves Associate Journal Editor David Houghton Associate Journal Editor Ronald Priest Associate Journal Editor William Ruesink Associate Journal Editor William Scharf Associate Journal Editor Daniel Swanson Newsletter Editor Crystal Daileay and Duke Elsner Webmaster Mark O’Brien The Michigan Entomological Society traces its origins to the old Detroit Entomological Society and was organized on 4 November 1954 to “.