Biologie Et Pollution Marines
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The Global Status of Freshwater Fish Age Validation Studies and a Prioritization Framework for Further Research Jonathan J
University of Nebraska - Lincoln DigitalCommons@University of Nebraska - Lincoln Nebraska Cooperative Fish & Wildlife Research Nebraska Cooperative Fish & Wildlife Research Unit -- Staff ubP lications Unit 2015 The Global Status of Freshwater Fish Age Validation Studies and a Prioritization Framework for Further Research Jonathan J. Spurgeon University of Nebraska–Lincoln, [email protected] Martin J. Hamel University of Nebraska-Lincoln, [email protected] Kevin L. Pope U.S. Geological Survey—Nebraska Cooperative Fish and Wildlife Research Unit,, [email protected] Mark A. Pegg University of Nebraska-Lincoln, [email protected] Follow this and additional works at: http://digitalcommons.unl.edu/ncfwrustaff Part of the Aquaculture and Fisheries Commons, Environmental Indicators and Impact Assessment Commons, Environmental Monitoring Commons, Natural Resource Economics Commons, Natural Resources and Conservation Commons, and the Water Resource Management Commons Spurgeon, Jonathan J.; Hamel, Martin J.; Pope, Kevin L.; and Pegg, Mark A., "The Global Status of Freshwater Fish Age Validation Studies and a Prioritization Framework for Further Research" (2015). Nebraska Cooperative Fish & Wildlife Research Unit -- Staff Publications. 203. http://digitalcommons.unl.edu/ncfwrustaff/203 This Article is brought to you for free and open access by the Nebraska Cooperative Fish & Wildlife Research Unit at DigitalCommons@University of Nebraska - Lincoln. It has been accepted for inclusion in Nebraska Cooperative Fish & Wildlife Research Unit -- Staff ubP lications by an authorized administrator of DigitalCommons@University of Nebraska - Lincoln. Reviews in Fisheries Science & Aquaculture, 23:329–345, 2015 CopyrightO c Taylor & Francis Group, LLC ISSN: 2330-8249 print / 2330-8257 online DOI: 10.1080/23308249.2015.1068737 The Global Status of Freshwater Fish Age Validation Studies and a Prioritization Framework for Further Research JONATHAN J. -

In the Cape Verde Islands
ZOOLOGIA CABOVERDIANA REVISTA DA SOCIEDADE CABOVERDIANA DE ZOOLOGIA VOLUME 5 | NÚMERO 1 Abril de 2014 ZOOLOGIA CABOVERDIANA REVISTA DA SOCIEDADE CABOVERDIANA DE ZOOLOGIA Zoologia Caboverdiana is a peer-reviewed open-access journal that publishes original research articles as well as review articles and short notes in all areas of zoology and paleontology of the Cape Verde Islands. Articles may be written in English (with Portuguese summary) or Portuguese (with English summary). Zoologia Caboverdiana is published biannually, with issues in spring and autumn. For further information, contact the Editor. Instructions for authors can be downloaded at www.scvz.org Zoologia Caboverdiana é uma revista científica com arbitragem científica (peer-review) e de acesso livre. Nela são publicados artigos de investigação original, artigos de síntese e notas breves sobre zoologia e paleontologia das Ilhas de Cabo Verde. Os artigos podem ser submetidos em inglês (com um resumo em português) ou em português (com um resumo em inglês). Zoologia Caboverdiana tem periodicidade bianual, com edições na primavera e no outono. Para mais informações, deve contactar o Editor. Normas para os autores podem ser obtidas em www.scvz.org Chief Editor | Editor principal Dr Cornelis J. Hazevoet (Instituto de Investigação Científica Tropical, Portugal); [email protected] Editorial Board | Conselho editorial Dr Joana Alves (Instituto Nacional de Saúde Pública, Praia, Cape Verde) Prof. Dr G.J. Boekschoten (Vrije Universiteit Amsterdam, The Netherlands) Dr Eduardo Ferreira (Universidade de Aveiro, Portugal) Rui M. Freitas (Universidade de Cabo Verde, Mindelo, Cape Verde) Dr Javier Juste (Estación Biológica de Doñana, Spain) Evandro Lopes (Universidade de Cabo Verde, Mindelo, Cape Verde) Dr Adolfo Marco (Estación Biológica de Doñana, Spain) Prof. -

Incidences of Caudal Fin Malformation in Fishes from Jubail City, Saudi Arabia, Arabian Gulf
FISHERIES & AQUATIC LIFE (2018) 26: 65-71 Archives of Polish Fisheries DOI 10.2478/aopf-2018-0008 RESEARCH ARTICLE Incidences of caudal fin malformation in fishes from Jubail City, Saudi Arabia, Arabian Gulf Laith A. Jawad, Mustafa Ibrahim, Baradi Waryani Received – 18 August 2017/Accepted – 09 March 2018. Published online: 31 March 2018; ©Inland Fisheries Institute in Olsztyn, Poland Citation: Jawad L.A., Ibrahim M., Waryani B. 2018 – Incidences of caudal fin malformation in fishes from Jubail City, Saudi Arabia, Ara- bian Gulf – Fish. Aquat. Life 26: 65-71. Abstract. These case studies endeavor to report incidences Introduction of caudal fin deformities in several commercial fishes living in natural populations in the Saudi Arabian coastal waters of Aberrations in fish bodies have attracted the attention the Arabian Gulf. Two groups of anomalies were observed, slight and severe. The carangid species, Parastromateus of researchers since the sixteenth century (Gudger niger (Bloch) and the soleid species, Euryglossa orientalis 1936), and since then a large number of studies have (Bloch & Schneider), had slight cases of caudal fin documented the presence of various types of anoma- abnormalities, while the species Oreochrromis mossambicus lies in wild fishes (Boglione et al. 2006, Jawad and (Peters), Epinephelus stoliczkae (Day), Diagramma pictum Hosie 2007, Jawad and _ktoner 2007, (Thunberg), Cephalopholis hemistiktos (Rüppell), Lethrinus Koumoundouros 2008, Orlov 2011, Jawad and nebulosus (ForsskDl), and Lutjanus sanguineus (Cuvier) had severe deformities. The abnormalities were assessed by Al-Mamry 2012, Rutkayová et al. 2016, Jawad et al. morphological diagnosis. None of the cases was fatal as they 2016). Fin anomalies are generally extremely well occurred in adult individuals. -

17 Reproductive Biology of Abu Mullet, Planiliza
Acta Aquatica Turcica E-ISSN: 2651-5474 17(1), 17-24 (2021) DOI:https://doi.org/10.22392/actaquatr.732149 Reproductive Biology of Abu Mullet, Planiliza abu (Heckel, 1843), in Karun River, Southwestern Iran Miaad JORFIPOUR1 , Yazdan KEIVANY1* , Fatemeh PAYKAN-HEYRATI1 , Zaniar GHAFOURI2 1Department of Natural Resources (Fisheries Division), Isfahan University of Technology, Isfahan 84156-83111, Iran, 2Department of Fisheries, Faculty of Natural Resources, University of Tehran, Tehran, Iran *Corresponding author Email: [email protected] Research Article Received 05 May 2020; Accepted 02 December 2020; Release date 01 Mart 2021. How to Cite: Jorfipour, M., Keivany, Y., Paykan-Heyrati, F., & Ghafouri, Z. (2021). Reproductive biology of Abu Mullet, Planiliza abu (Heckel, 1843), in Karun River, Southwestern Iran. Acta Aquatica Turcica, 17(1), 17-24. https://doi.org/10.22392/actaquatr.732149 Abstract Some aspects of the reproductive biology of Planiliza abu (Mugilidae) were investigated by collecting of 428 specimens caught with trawl by local fishermen from Karun River, Ahwaz, from November 2016 to September 2017. The total length for males ranged between 10-17.1 (13.6±1.26 SD) cm and for females, between 10.5-17.3 (13.44±1.35) cm. The age range of fish in both sexes was between 0+-7+ years and the most abundant age group was the 4+. The sex ratio in the studied fish was equal (P>0.05). The mean egg diameter was significantly different (P<0.05) in different months and the individual size ranged between 0.12 and 0.57 mm. The absolute fecundity ranged from 3600 to 48600 eggs and the relative fecundity from 120 to 900 eggs per 1 g of body weight. -

FCEN-UBA | Callicó Fortunato, Roberta Glenda. 2017 02 20
Tesis Doctoral Aplicación de los otolitos en el estudio de la interconectividad de stocks pesqueros de mugílidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa valenciana, España Callicó Fortunato, Roberta Glenda 2017-02-20 Este documento forma parte de la colección de tesis doctorales y de maestría de la Biblioteca Central Dr. Luis Federico Leloir, disponible en digital.bl.fcen.uba.ar. Su utilización debe ser acompañada por la cita bibliográfica con reconocimiento de la fuente. This document is part of the doctoral theses collection of the Central Library Dr. Luis Federico Leloir, available in digital.bl.fcen.uba.ar. It should be used accompanied by the corresponding citation acknowledging the source. Cita tipo APA: Callicó Fortunato, Roberta Glenda. (2017-02-20). Aplicación de los otolitos en el estudio de la interconectividad de stocks pesqueros de mugílidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa valenciana, España. Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Cita tipo Chicago: Callicó Fortunato, Roberta Glenda. "Aplicación de los otolitos en el estudio de la interconectividad de stocks pesqueros de mugílidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa valenciana, España". Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. 2017-02-20. Dirección: Biblioteca Central Dr. Luis F. Leloir, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Contacto: [email protected] Intendente Güiraldes 2160 - C1428EGA - Tel. (++54 +11) 4789-9293 UNIVERSIDAD DE BUENOS AIRES Facultad de Ciencias Exactas y Naturales Departamento de Biodiversidad y Biolog´ıa Experimental Aplicaci´on de los otolitos en el estudio de la interconectividad de stocks pesqueros de mug´ılidos de zonas costeras de la provincia de Buenos Aires, Argentina y de la costa Valenciana, Espa˜na. -
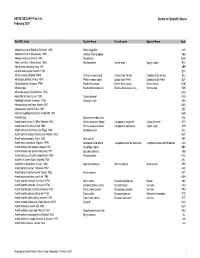
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Poissons Marins De La Sous-Région Nord-Ouest Africaine
COMMISSION EUROPEENNE CENTRE COMMUN DE RECHERCHE Institut de l'Environnement Durable 1-21020 Ispra (VA) Italie Poissons Marins de la Sous-Région Nord-Ouest Africaine par Jan Michael VAKILY, Sékou Balta CAMARA, Asberr Natoumbi M END Y, Yanda MARQUES, Birane SAMB, Abei Jûlio DOS SANTOS, Mohamed Fouad SHERIFF, Mahfoudh OULD TALEE SIDI et Daniel PAUL Y Cap Vert Mauritanie 1 *J* T II Senegal Gambie G'vnée-Bissau II Sierra Leone Guinée 2002 EUR 20379 FR COMMISSION EUROPEENNE CENTRE COMMUN DE RECHERCHE Institut de 1 Environnement Durable 1-21020 Ispra (VA) Italy Poissons Marins de la Sous-Région Nord-Ouest Africaine par Jan Michael Vakily3 , Sékou Balia Camara13, Asberr Natoumbi Mendyc, Vanda Marques0, Birane Sambe , Abei Julio dos Santosi Mohamed Fouad Sheriff6, Mahfoudh Ould Taleb Sidih et Daniel Pauly1 a Centre Commun de Recherche (CCR/IES), IMW Unit (TP 272), 21020 Ispra (VA), Italie b Centre National des Sciences Halieutiques de Boussoura (CNSHB), B.P. 3738, Conakry, Guinée ° Department of Fisheries, 6, Coi. Muammar Ghaddafi Avenue, Banjul, Gambie d Institut National de Développement des Pêches (INDP), CP 132, Mindelo, San Vicente, Cap Vert e Centre de Recherches Océanographiques de Dakar-Thiaroye (CRODT), BP 2241. Dakar, Sénégal f Centro de Investigaçao Pesqueira Aplicada (CIPA), C.P. 102, Bissau, Guinée-Bissau 8 Dep. of Fisheries, Ministry of Agriculture, Forestry & Marine Resources, Freetown, Sierra Leone b Inst. Mauritanien de Recherches Océanographiques et des Pêches (IMROP), B.P. 22, Nouadhibou, Mauritanie ' Fisheries Centre, University of British Columbia, Vancouver, BC V6T 1Z4, Canada 2002 EUR 20379 FR LEGAL NOTICE Neither the European Commission nor any person acting on behalf of the Commission is responsible for the use, which might be made of the following information. -

The Living Planet Index (Lpi) for Migratory Freshwater Fish Technical Report
THE LIVING PLANET INDEX (LPI) FOR MIGRATORY FRESHWATER FISH LIVING PLANET INDEX TECHNICAL1 REPORT LIVING PLANET INDEXTECHNICAL REPORT ACKNOWLEDGEMENTS We are very grateful to a number of individuals and organisations who have worked with the LPD and/or shared their data. A full list of all partners and collaborators can be found on the LPI website. 2 INDEX TABLE OF CONTENTS Stefanie Deinet1, Kate Scott-Gatty1, Hannah Rotton1, PREFERRED CITATION 2 1 1 Deinet, S., Scott-Gatty, K., Rotton, H., Twardek, W. M., William M. Twardek , Valentina Marconi , Louise McRae , 5 GLOSSARY Lee J. Baumgartner3, Kerry Brink4, Julie E. Claussen5, Marconi, V., McRae, L., Baumgartner, L. J., Brink, K., Steven J. Cooke2, William Darwall6, Britas Klemens Claussen, J. E., Cooke, S. J., Darwall, W., Eriksson, B. K., Garcia Eriksson7, Carlos Garcia de Leaniz8, Zeb Hogan9, Joshua de Leaniz, C., Hogan, Z., Royte, J., Silva, L. G. M., Thieme, 6 SUMMARY 10 11, 12 13 M. L., Tickner, D., Waldman, J., Wanningen, H., Weyl, O. L. Royte , Luiz G. M. Silva , Michele L. Thieme , David Tickner14, John Waldman15, 16, Herman Wanningen4, Olaf F., Berkhuysen, A. (2020) The Living Planet Index (LPI) for 8 INTRODUCTION L. F. Weyl17, 18 , and Arjan Berkhuysen4 migratory freshwater fish - Technical Report. World Fish Migration Foundation, The Netherlands. 1 Indicators & Assessments Unit, Institute of Zoology, Zoological Society 11 RESULTS AND DISCUSSION of London, United Kingdom Edited by Mark van Heukelum 11 Data set 2 Fish Ecology and Conservation Physiology Laboratory, Department of Design Shapeshifter.nl Biology and Institute of Environmental Science, Carleton University, Drawings Jeroen Helmer 12 Global trend Ottawa, ON, Canada 15 Tropical and temperate zones 3 Institute for Land, Water and Society, Charles Sturt University, Albury, Photography We gratefully acknowledge all of the 17 Regions New South Wales, Australia photographers who gave us permission 20 Migration categories 4 World Fish Migration Foundation, The Netherlands to use their photographic material. -

Review of the Freshwater Mullets of Iran (Family Mugilidae)
Iran. J. Ichthyol. (June 2016), 4(2): 75–130 Received: April 1, 2017 © 2017 Iranian Society of Ichthyology Accepted: May 29, 2017 P-ISSN: 2383-1561; E-ISSN: 2383-0964 doi: 10.7508/iji.2016.0 http://www.ijichthyol.org Review of the Freshwater Mullets of Iran (Family Mugilidae) Brian W. COAD Canadian Museum of Nature, Ottawa, Ontario, K1P 6P4 Canada. Email: [email protected] Abstract: The systematics, morphology, distribution, biology, economic importance and conservation of the freshwater mullets of Iran are described, the species are illustrated, and a bibliography on these fishes in Iran is provided. Two species are found in the Caspian Sea basin as exotics (Chelon auratus, C. saliens), two species in southern Iranian fresh waters as native species (Mugil cephalus, Planiliza abu) and two species in brackish waters of rivers (Ellochelon vaigiensis, C. subviridis). Keywords: Biology, Morphology, Mugilidae, Chelon, Ellochelon, Liza, Mugil, Planiliza. Citation: Coad, B.W. (2017). Review of the freshwater mullets of Iran (Family Mugilidae). Iranian Journal of Ichthyology 4 (2): 75-130. Introduction number of species are recorded as entering the rivers The freshwater ichthyofauna of Iran comprises a of southern Iran from the Persian Gulf and Sea of diverse set of families and species distributed in Oman although identification is not always certain different basins (Fig. 1). These form important and only two are described here (Ellochelon elements of the aquatic ecosystem and a number of vaigiensis and Planiliza subviridis). Examples of species are of commercial or other significance. The other Persian Gulf estuarine records include literature on these fishes is widely scattered, both in Moolgarda seheli (Forsskål, 1775) and P. -

Combining Otolith Chemistry and Telemetry to Assess Diadromous Migration in Pinkeye Mullet, Trachystoma Petardi (Actinopterygii, Mugiliformes)
Hydrobiologia (2018) 808:265–281 https://doi.org/10.1007/s10750-017-3430-x PRIMARY RESEARCH PAPER Combining otolith chemistry and telemetry to assess diadromous migration in pinkeye mullet, Trachystoma petardi (Actinopterygii, Mugiliformes) Nathan G. Miles . Gavin L. Butler . Sandra L. Diamond . David P. Bishop . Dylan E. van der Meulen . Ivars Reinfelds . Chris T. Walsh Received: 14 June 2016 / Revised: 24 October 2017 / Accepted: 1 November 2017 / Published online: 17 November 2017 Ó Springer International Publishing AG, part of Springer Nature 2017 Abstract This study examines the complex diadro- early life in saline waters. Movement patterns for mous movements in pinkeye mullet (Trachystoma adults varied, with a range of movements identified petardi) of south-eastern Australia. The techniques between fresh and saline waters. Telemetry data used to study these movements included LA-ICP-MS assisted in explaining the likely cause of the ambiguity single line ablation transects and microchemical in otolith microchemistry data, including identifica- imaging as well as preliminary acoustic telemetry tion of multiple rapid movements across salinity results which were used to aid in interpretation of gradients. However, many movements through salin- chemical signatures related to complex movement ity gradients appear too brief to result in any clear patterns across salinity gradients. Ba:Ca and Sr:Ca Sr:Ca or Ba:Ca saline or mesohaline signature within from single ablation transects and microchemical the chemistry of the otolith. The combination of images revealed differences between the otolith core otolith chemistry and telemetry proved useful in and outer regions. Otolith Ba:Ca and Sr:Ca patterns providing information on this poorly understood were more easily distinguished in images compared to species suggesting that T. -

ECOSYSTEMS of the FLORIDA KEYS · a Bibliography
,..... .. , . .. ..... ...,., LIBRARY AND INFORMATION SERVICES DIVISION Current References (92 -1) ECOSYSTEMS OF THE FLORIDA KEYS · A Bibliography U. S. DEPARTMENT OF COMMERCE National Oceanic and Atmospheric Administration National Environmental Satellite, Data, and Information Service National Oceanographic Data Center April1992 Library and Information Services Division Current References 92-1 ECOSYSTEMS OF THE FLORIDA KEYS A Bibliography compiled, edited, and indexed by Linda Pikula NOAA Regional Library Miami, Florida and Stanley Elswick NOAA Central Library Rockville, Maryland United States Department of Commerce National Oceanic and Atmospheric Administration National Environmental Satellite, Data, and Information Service National Oceanographic Data Center March 1992 TABLE OF CONTENTS Table of Contents . i Preface • . iii-iv Bibliography . l-154 Author Index 155-165 Subject and Geographic Index •..•...........166-189 i PREFACE This bibliography was originally prepared for the Florida Keys National Marine Sanctuary located in Key Largo, Florida by the NOAA Regional Library in Miami, Florida. It was prepared with the idea that it would be used by scientists and educators interested in the Keys. The majority of citations are references to works about marine invertebrates and flora, with a substantial number of citations to works about oceanography, geology, meteorology, marine mammals and fishes, and terrestrial flora and fauna. The bibliography was compiled from searches in the DIALOG online databases conducted in February and March -

Poissons Marins De La Sous-Région Nord-Ouest Africaine
Poissons Marins de la Sous-Région Nord-Ouest Africaine Item Type Working Paper Authors Samb, B.; Vakily, J.M.; Ould Taleb Ould Sidi, M.M.; Pauly, D.; Natoumbi Mendy, A.; Sheriff, M.F.; Dos Santos, A.J.; Marques, V.; Camara, S.B. Publisher European Commission Download date 30/09/2021 00:18:29 Link to Item http://hdl.handle.net/1834/319 COMMISSION EUROPEENNE CENTRE COMMUN DE RECHERCHE Institut de l'Environnement Durable I-21020 Ispra (VA) Italie Poissons Marins de la Sous-Région Nord-Ouest Africaine par Jan Michael VAKILY, Sékou Balta CAMARA, Asberr Natoumbi MENDY, Vanda MARQUES, Birane SAMB, Abel Júlio DOS SANTOS, Mohamed Fouad SHERIFF, Mahfoudh OULD TALEB SIDI et Daniel PAULY 2002 EUR 20379 FR COMMISSION EUROPEENNE CENTRE COMMUN DE RECHERCHE Institut de l'Environnement Durable I-21020 Ispra (VA) Italie Poissons Marins de la Sous-Région Nord-Ouest Africaine par Jan Michael Vakilya , Sékou Balta Camarab, Asberr Natoumbi Mendyc, Vanda Marquesd, Birane Sambe , Abel Júlio dos Santosf, Mohamed Fouad Sheriffg, Mahfoudh Ould Taleb Sidih et Daniel Paulyi a Centre Commun de Recherche (CCR/IES), IMW Unit (TP 272), 21020 Ispra (VA), Italie b Centre National des Sciences Halieutiques de Boussoura (CNSHB), B.P. 3738, Conakry, Guinée c Department of Fisheries, 6, Col. Muammar Ghaddafi Avenue, Banjul, Gambie d Institut National de Développement des Pêches (INDP), CP 132, Mindelo, San Vicente, Cap Vert e Centre de Recherches Océanographiques de Dakar-Thiaroye (CRODT), BP 2241. Dakar, Sénégal f Centro de Investigaçao Pesqueira Aplicada (CIPA), C.P. 102, Bissau, Guinée-Bissau g Dep. of Fisheries, Ministry of Agriculture, Forestry & Marine Resources, Freetown, Sierra Leone h Inst.