Achelous Spinimanus
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

DISTRIBUTION PATTERNS of Arenaeus Cribrarius (LAMARCK, 1818) (CRUSTACEA, PORTUNIDAE) in FORTALEZA BA~ UBATUBA (SP), BRAZIL
DISTRIBUTION PATTERNS OF Arenaeus cribrarius (LAMARCK, 1818) (CRUSTACEA, PORTUNIDAE) IN FORTALEZA BA~ UBATUBA (SP), BRAZIL 2 MARCELO ANTONIO AMARO PINHEIRO1,3, ADILSON FRANSOZ0 ,3 2 and MARIA LUCIA NEGREIROS-FRANSOZ0 ,3 lDepartamento de Biologia Aplicada, Faculdade de Ciencias Agnirias e Veterimirias, UNESP, Campus de Iaboticabal - 14870-000 - Iaboticabal, SP, Brasil 2Departamento de Zoologia, Instituto de Biociencias, Cx. Postal 502, UNESP, Cam£us de Botucatu - 18618-000 - Botucatu, SP, Brasil Centro de Aqiiicultura da UNESP (CAUNESP), Nticleo de Estudos em Biologia, Ecologia e Cultivo de Crusmceos (NEBECC) (With 6 figures) ABSTRACT The abundance of the swimming crab A. cribrarius in Fortaleza Bay, Ubatuba (SP) was ana lysed in order to detect the influence of some environmental factors in its distribution. The collections were made by using two otter-trawls deployed from a shrimp-fishing vessel and occurred monthly during one year. The Fortaleza Bay was sampled in 7 radials of I Ian each. Each environmental factor (temperature, salinity and dissolved oxygen of the bottom water, depth, granulometric composition and organic matter of the sediment), sampled in the middle point of each transect, was correlated with the abundance of 5 groups (adult males, ovigerous females, non-ovigerous adult females, juveniles, and total number of specimens), by Pear son's linear and canonical correlation analyses. The total amount of specimens revealed a positive linear correlation with temperature and very fine sand fraction, and a negative linear correlation with organic material contents. Different association patterns appeared in relation to the abundance of the groups mentioned above, such as depth and granulometry. Ovigerous females were the only group which was associated with the whole set of granulometric frac tions of the sediment. -

Stock Status Report 2016
SKATES – Familia Rajidae About twenty species of the Family Rajidae (Class Chondrichthyes) are distributed in the Treaty area. Commonly known as skates, these species constitute, together with the narrownose smoothhoundand the angular angel shark, the most exploited chondrichthyans of the region. Considering their geographical distribution and the fisheries to which they are subject, two groups can be established: coastal skates and deepwater skates. The coastal skates inhabit the coastal strip of the Treaty area, between 34° and 39° S and from the coast to 50 m depth. It is composed of at least 9 species (Sympterygia bonapartii, S. acuta, Atlantoraja castelnaui, A. cyclophora, Psammobatis bergi, P. extenta, P. rutrum, Rioraja agassizi and Zearaja flavirostris (= Z. chilensis, = Dipturus chilensis). It should be mentioned that the species S. bonapartii and Z. flavirostris have a wide geographic distribution in the maritime areas south of 34° S, including both the coastal region and the deeper one. However, the highest abundances of S. bonapartii occur at depths less than 50 m, while Z. flavirostris, the most important of all the skate from the commercial point of view, is concentrated especially at depths greater than 50 m. A third species, Psammobatis lentiginosa, inhabit in an intermediate region between the two previous or ecotone, close to the 50 m isobath, between 34° and 42° S. In the Treaty area the coastal skates are captured by the fleet Argentine coast that operates on the multispecific fishery called "variado costero" and by the Uruguayan fleet Category B. The others species of the Family Rajidae, which inhabit in the average and external continental shelf of the ZCP, are included in the group deepwater skates. -

Molecular Phylogeny of the Western Atlantic Species of the Genus Portunus (Crustacea, Brachyura, Portunidae)
Blackwell Publishing LtdOxford, UKZOJZoological Journal of the Linnean Society0024-4082The Lin- nean Society of London, 2007? 2007 1501 211220 Original Article PHYLOGENY OF PORTUNUS FROM ATLANTICF. L. MANTELATTO ET AL. Zoological Journal of the Linnean Society, 2007, 150, 211–220. With 3 figures Molecular phylogeny of the western Atlantic species of the genus Portunus (Crustacea, Brachyura, Portunidae) FERNANDO L. MANTELATTO1*, RAFAEL ROBLES2 and DARRYL L. FELDER2 1Laboratory of Bioecology and Crustacean Systematics, Department of Biology, FFCLRP, University of São Paulo (USP), Ave. Bandeirantes, 3900, CEP 14040-901, Ribeirão Preto, SP (Brazil) 2Department of Biology, Laboratory for Crustacean Research, University of Louisiana at Lafayette, Lafayette, LA 70504-2451, USA Received March 2004; accepted for publication November 2006 The genus Portunus encompasses a comparatively large number of species distributed worldwide in temperate to tropical waters. Although much has been reported about the biology of selected species, taxonomic identification of several species is problematic on the basis of strictly adult morphology. Relationships among species of the genus are also poorly understood, and systematic review of the group is long overdue. Prior to the present study, there had been no comprehensive attempt to resolve taxonomic questions or determine evolutionary relationships within this genus on the basis of molecular genetics. Phylogenetic relationships among 14 putative species of Portunus from the Gulf of Mexico and other waters of the western Atlantic were examined using 16S sequences of the rRNA gene. The result- ant molecularly based phylogeny disagrees in several respects with current morphologically based classification of Portunus from this geographical region. Of the 14 species generally recognized, only 12 appear to be valid. -

Shrimps, Lobsters, and Crabs of the Atlantic Coast of the Eastern United States, Maine to Florida
SHRIMPS, LOBSTERS, AND CRABS OF THE ATLANTIC COAST OF THE EASTERN UNITED STATES, MAINE TO FLORIDA AUSTIN B.WILLIAMS SMITHSONIAN INSTITUTION PRESS Washington, D.C. 1984 © 1984 Smithsonian Institution. All rights reserved. Printed in the United States Library of Congress Cataloging in Publication Data Williams, Austin B. Shrimps, lobsters, and crabs of the Atlantic coast of the Eastern United States, Maine to Florida. Rev. ed. of: Marine decapod crustaceans of the Carolinas. 1965. Bibliography: p. Includes index. Supt. of Docs, no.: SI 18:2:SL8 1. Decapoda (Crustacea)—Atlantic Coast (U.S.) 2. Crustacea—Atlantic Coast (U.S.) I. Title. QL444.M33W54 1984 595.3'840974 83-600095 ISBN 0-87474-960-3 Editor: Donald C. Fisher Contents Introduction 1 History 1 Classification 2 Zoogeographic Considerations 3 Species Accounts 5 Materials Studied 8 Measurements 8 Glossary 8 Systematic and Ecological Discussion 12 Order Decapoda , 12 Key to Suborders, Infraorders, Sections, Superfamilies and Families 13 Suborder Dendrobranchiata 17 Infraorder Penaeidea 17 Superfamily Penaeoidea 17 Family Solenoceridae 17 Genus Mesopenaeiis 18 Solenocera 19 Family Penaeidae 22 Genus Penaeus 22 Metapenaeopsis 36 Parapenaeus 37 Trachypenaeus 38 Xiphopenaeus 41 Family Sicyoniidae 42 Genus Sicyonia 43 Superfamily Sergestoidea 50 Family Sergestidae 50 Genus Acetes 50 Family Luciferidae 52 Genus Lucifer 52 Suborder Pleocyemata 54 Infraorder Stenopodidea 54 Family Stenopodidae 54 Genus Stenopus 54 Infraorder Caridea 57 Superfamily Pasiphaeoidea 57 Family Pasiphaeidae 57 Genus -

Carcinus Maenas
Selection and Availability of Shellfish Prey for Invasive Green Crabs [Carcinus maenas (Linneaus, 1758)] in a Partially Restored Back-Barrier Salt Marsh Lagoon on Cape Cod, Massachusetts Author(s): Heather Conkerton, Rachel Thiet, Megan Tyrrell, Kelly Medeiros and Stephen Smith Source: Journal of Shellfish Research, 36(1):189-199. Published By: National Shellfisheries Association DOI: http://dx.doi.org/10.2983/035.036.0120 URL: http://www.bioone.org/doi/full/10.2983/035.036.0120 BioOne (www.bioone.org) is a nonprofit, online aggregation of core research in the biological, ecological, and environmental sciences. BioOne provides a sustainable online platform for over 170 journals and books published by nonprofit societies, associations, museums, institutions, and presses. Your use of this PDF, the BioOne Web site, and all posted and associated content indicates your acceptance of BioOne’s Terms of Use, available at www.bioone.org/page/terms_of_use. Usage of BioOne content is strictly limited to personal, educational, and non-commercial use. Commercial inquiries or rights and permissions requests should be directed to the individual publisher as copyright holder. BioOne sees sustainable scholarly publishing as an inherently collaborative enterprise connecting authors, nonprofit publishers, academic institutions, research libraries, and research funders in the common goal of maximizing access to critical research. Journal of Shellfish Research, Vol. 36, No. 1, 189–199, 2017. SELECTION AND AVAILABILITY OF SHELLFISH PREY FOR INVASIVE GREEN CRABS -

Invertebrate ID Guide
11/13/13 1 This book is a compilation of identification resources for invertebrates found in stomach samples. By no means is it a complete list of all possible prey types. It is simply what has been found in past ChesMMAP and NEAMAP diet studies. A copy of this document is stored in both the ChesMMAP and NEAMAP lab network drives in a folder called ID Guides, along with other useful identification keys, articles, documents, and photos. If you want to see a larger version of any of the images in this document you can simply open the file and zoom in on the picture, or you can open the original file for the photo by navigating to the appropriate subfolder within the Fisheries Gut Lab folder. Other useful links for identification: Isopods http://www.19thcenturyscience.org/HMSC/HMSC-Reports/Zool-33/htm/doc.html http://www.19thcenturyscience.org/HMSC/HMSC-Reports/Zool-48/htm/doc.html Polychaetes http://web.vims.edu/bio/benthic/polychaete.html http://www.19thcenturyscience.org/HMSC/HMSC-Reports/Zool-34/htm/doc.html Cephalopods http://www.19thcenturyscience.org/HMSC/HMSC-Reports/Zool-44/htm/doc.html Amphipods http://www.19thcenturyscience.org/HMSC/HMSC-Reports/Zool-67/htm/doc.html Molluscs http://www.oceanica.cofc.edu/shellguide/ http://www.jaxshells.org/slife4.htm Bivalves http://www.jaxshells.org/atlanticb.htm Gastropods http://www.jaxshells.org/atlantic.htm Crustaceans http://www.jaxshells.org/slifex26.htm Echinoderms http://www.jaxshells.org/eich26.htm 2 PROTOZOA (FORAMINIFERA) ................................................................................................................................ 4 PORIFERA (SPONGES) ............................................................................................................................................... 4 CNIDARIA (JELLYFISHES, HYDROIDS, SEA ANEMONES) ............................................................................... 4 CTENOPHORA (COMB JELLIES)............................................................................................................................ -

Larval Development of the Speckled Swimming Crab, <I>Arenaeus Cribrarius</I> (Decapoda: Brachyura: Portunidae) Reare
BULLETIN OF MARINE SCIENCE, 42(1): 101-132, 1988 LARVAL DEVELOPMENT OF THE SPECKLED SWIMMING CRAB, ARENAEUS CRIBRARIUS (DECAPODA: BRACHYURA: PORTUNIDAE) REARED IN THE LABORATORY Kenneth C. Stuck and Frank M. Truesdale ABSTRACT Eight zoeal stages and a megalopa of the speckled swimming crab, Arenaeus cribrarius, are described and figured from larvae of an ovigerous specimen collected at Hom Island, Mis- sissippi (Gulf of Mexico). Crab stages 1-3 are also briefly described. Larvae were reared at 25°C and 300/00salinity; some individuals completed zoeal development in 30 days,and reached crab I, 13 days later. Zoea I characters of A. cribrarius are compared with those of seven other species of shallow water Gulf Portuninae, from larvae reared by the authors, and from the literature. Antennal and telson features are important in distinguishing among zoeae I ofGulfPortuninae. Characters ofzoeae II-VIII and the megalopa of A. cribrarius and those of corresponding stages of Callinecles sapidus, C. similis. and PorlUnus spinicarpus from the literature are compared. In zoeae III and VI, setation of maxillar basal and coxal endites is a distinguishing feature among A. cribrarius, C. sapidus, C. similis, and P. spinicarpus, and in zoea V, maxillular basal and coxal endite setation distinguish each. Antennular aesthetasc formula distinguishes each species having a zoea VIII, and in all zoeal stages this feature distinguishes A. cribrarius from the others. Zoeae IV and VII of C. sapidus, C. similis and P. spinicarpus can be separated by setation of maxillular basal and coxal endites, and in zoea II this same feature distinguishes P. spinicarpus from C. -

Revisión Del Estatus Taxonómico De Los Batomorphii Fósiles De La Cuenca Limón Sur, Costa Rica Y Descripción De Una Nueva Especie De Dasyatidae
Revista Geológica de América Central, 65, 1-27, 2021 doi: 10.15517/rgac.v0i65.46685 ISSN: 0256-7024 Revisión del estatus taxonómico de los Batomorphii fósiles de la cuenca Limón Sur, Costa Rica y descripción de una nueva especie de Dasyatidae Review of the taxonomic status of fossil Batomorphii from Southern Limon Basin, Costa Rica and description of a new species of Dasyatidae César A. Laurito1* y Ana L. Valerio2 1Instituto Nacional de Aprendizaje (INA), San José, Costa Rica 2Museo Nacional de Costa Rica, Departamento de Historia Natural, San José, Costa Rica *Autor para contacto: [email protected] (Recibido: 16/12/2020; aceptado 27/01/2021) ABSTRACT: A taxonomic review of the rays [Batoidea] faunal assemblage from the Locality of Alto Guayacán, initially described by Laurito (1999), was made, same that was recovered from sediments of the Uscari Formation. The reason for making such revision is the remarkable advance in the knowledge of the dentition and the phylogenetic relationships of the recent and fossil rays. This is complemented by the multiple investigations on fossil Chondrichthyes from southern Central America and the Caribbean that have undoubtedly revolutionized the fossil record of the region. Many of the new species, then described for the Southern Limón Basin, have been validated and recognized by the scientific community and registered in other locations. However, it was necessary to review some of the previous determinations, in order to have an updated taxonomic record. Keywords: Batomorphii; Rajiformes; Myliobatiformes; Uscari Formation; Alto Guayacán. RESUMEN: Se procedió a hacer una revisión taxonómica de la fauna de rayas [Batoidea], descritas inicialmente por Laurito (1999) para la Localidad de Alto Guayacán, misma que fue recuperada de sedimentos de la Formación Uscari. -

(Decapoda, Xanthoidea) from the Southeastern Coast of Brazil
Lat. Am. J. Aquat. Res., 42(3): 588-597, 2014 Morphometry and maturity of Hexapanopeus paulensis 588 1 DOI: 103856/vol42-issue3-fulltext-16 Research Article Morphometric analysis of the mud crab Hexapanopeus paulensis Rathbun, 1930 (Decapoda, Xanthoidea) from the southeastern coast of Brazil Thiago Elias Silva1, Patrícia Bianca Fumis1, Ariadine Cristine Almeida2 Giovana Bertini3 & Vivian Fransozo4 1Instituto de Biociências de Botucatu, Departamento de Zoologia Distrito de Rubião Júnior s/n, CEP 18618-970, Botucatu, SP, Brazil 2Instituto de Biologia, Universidade Federal de Uberlândia Rua Ceará s/n CEP 38400-902, Umuarama, MG, Brazil 3Campus Registro, Universidad Estatal Paulista, Rua Nelson Bhihi Badur 430 CEP 11900-000, Registro, SP, Brazil 4Departamento de Ciências Naturais-Zoologia, Universidade Estadual do Sudoeste da Bahia Estrada do Bem Querer, km 04, CEP 45031-900, Vitória da Conquista, BA, Brazil ABSTRACT. In this study, we estimated the size at onset of maturity (carapace width, CW50) and analyzed the relative growth of some body parts and the heterochely of the mud crab Hexapanopeus paulensis. A total of 800 crabs were collected, from January 1998 to December 1999, on the southeastern coast of Brazil. Each specimen was sexed and measured. CW50 was estimated to be 6.7 mm in males and 6.3 mm in females. Carapace length growth was negatively allometric in both sexes. Cheliped length and height was positively allometric for both males and females. Gonopod growth was isometric (b = 1) and negatively allometric (b < 1) in both juvenile and adult males, respectively. Abdomen relative growth was positively allometric (b > 1) for both juvenile and adult females. -

Hermit Crabs - Paguridae and Diogenidae
Identification Guide to Marine Invertebrates of Texas by Brenda Bowling Texas Parks and Wildlife Department April 12, 2019 Version 4 Page 1 Marine Crabs of Texas Mole crab Yellow box crab Giant hermit Surf hermit Lepidopa benedicti Calappa sulcata Petrochirus diogenes Isocheles wurdemanni Family Albuneidae Family Calappidae Family Diogenidae Family Diogenidae Blue-spot hermit Thinstripe hermit Blue land crab Flecked box crab Paguristes hummi Clibanarius vittatus Cardisoma guanhumi Hepatus pudibundus Family Diogenidae Family Diogenidae Family Gecarcinidae Family Hepatidae Calico box crab Puerto Rican sand crab False arrow crab Pink purse crab Hepatus epheliticus Emerita portoricensis Metoporhaphis calcarata Persephona crinita Family Hepatidae Family Hippidae Family Inachidae Family Leucosiidae Mottled purse crab Stone crab Red-jointed fiddler crab Atlantic ghost crab Persephona mediterranea Menippe adina Uca minax Ocypode quadrata Family Leucosiidae Family Menippidae Family Ocypodidae Family Ocypodidae Mudflat fiddler crab Spined fiddler crab Longwrist hermit Flatclaw hermit Uca rapax Uca spinicarpa Pagurus longicarpus Pagurus pollicaris Family Ocypodidae Family Ocypodidae Family Paguridae Family Paguridae Dimpled hermit Brown banded hermit Flatback mud crab Estuarine mud crab Pagurus impressus Pagurus annulipes Eurypanopeus depressus Rithropanopeus harrisii Family Paguridae Family Paguridae Family Panopeidae Family Panopeidae Page 2 Smooth mud crab Gulf grassflat crab Oystershell mud crab Saltmarsh mud crab Hexapanopeus angustifrons Dyspanopeus -
St. Lucie, Units 1 and 2
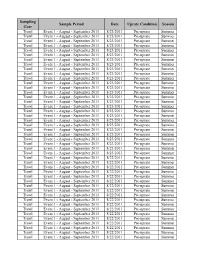
Sampling Sample Period Date Uprate Condition Season Gear Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event 1 - August - September 2011 8/23/2011 Pre-uprate Summer Trawl Event -

Southeastern Regional Taxonomic Center South Carolina Department of Natural Resources
Southeastern Regional Taxonomic Center South Carolina Department of Natural Resources http://www.dnr.sc.gov/marine/sertc/ Southeastern Regional Taxonomic Center Invertebrate Literature Library (updated 9 May 2012, 4056 entries) (1958-1959). Proceedings of the salt marsh conference held at the Marine Institute of the University of Georgia, Apollo Island, Georgia March 25-28, 1958. Salt Marsh Conference, The Marine Institute, University of Georgia, Sapelo Island, Georgia, Marine Institute of the University of Georgia. (1975). Phylum Arthropoda: Crustacea, Amphipoda: Caprellidea. Light's Manual: Intertidal Invertebrates of the Central California Coast. R. I. Smith and J. T. Carlton, University of California Press. (1975). Phylum Arthropoda: Crustacea, Amphipoda: Gammaridea. Light's Manual: Intertidal Invertebrates of the Central California Coast. R. I. Smith and J. T. Carlton, University of California Press. (1981). Stomatopods. FAO species identification sheets for fishery purposes. Eastern Central Atlantic; fishing areas 34,47 (in part).Canada Funds-in Trust. Ottawa, Department of Fisheries and Oceans Canada, by arrangement with the Food and Agriculture Organization of the United Nations, vols. 1-7. W. Fischer, G. Bianchi and W. B. Scott. (1984). Taxonomic guide to the polychaetes of the northern Gulf of Mexico. Volume II. Final report to the Minerals Management Service. J. M. Uebelacker and P. G. Johnson. Mobile, AL, Barry A. Vittor & Associates, Inc. (1984). Taxonomic guide to the polychaetes of the northern Gulf of Mexico. Volume III. Final report to the Minerals Management Service. J. M. Uebelacker and P. G. Johnson. Mobile, AL, Barry A. Vittor & Associates, Inc. (1984). Taxonomic guide to the polychaetes of the northern Gulf of Mexico.