Peces, Crustaceos Y Moluscos Del Istmo Centroamericano
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-

Redalyc.Peces De La Fauna De Acompañamiento En La Pesca
Revista de Biología Tropical ISSN: 0034-7744 [email protected] Universidad de Costa Rica Costa Rica López-Martínez, Juana; Herrera-Valdivia, Eloisa; Rodríguez-Romero, Jesús; Hernández-Vázquez, Sergio Peces de la fauna de acompañamiento en la pesca industrial de camarón en el Golfo de California, México Revista de Biología Tropical, vol. 58, núm. 3, septiembre, 2010, pp. 925-942 Universidad de Costa Rica San Pedro de Montes de Oca, Costa Rica Disponible en: http://www.redalyc.org/articulo.oa?id=44918839010 Cómo citar el artículo Número completo Sistema de Información Científica Más información del artículo Red de Revistas Científicas de América Latina, el Caribe, España y Portugal Página de la revista en redalyc.org Proyecto académico sin fines de lucro, desarrollado bajo la iniciativa de acceso abierto Peces de la fauna de acompañamiento en la pesca industrial de camarón en el Golfo de California, México Juana López-Martínez1, Eloisa Herrera-Valdivia1, Jesús Rodríguez-Romero2 & Sergio Hernández-Vázquez2 1. Centro de Investigaciones Biológicas del Noroeste, S.C. Km 2.35 Carretera a Las Tinajas, S/N Colonia Tinajas, Guaymas, Sonora, México C. P. 85460; [email protected], [email protected] 2. Centro de Investigaciones Biológicas del Noroeste, S.C. Apdo. postal 128 La Paz, B.C.S. C.P. 23000; [email protected], [email protected] Recibido 19-VII-2009. Corregido 15-III-2010. Aceptado 16-IV-2010. Abstract: Bycatch fish species from shrimp industrial fishery in the Gulf of California, Mexico. The shrimp fishery in the Gulf of California is one the most important activities of revenue and employment for communi- ties. -

Scientific Committee Thirteenth Regular Session
SCIENTIFIC COMMITTEE THIRTEENTH REGULAR SESSION Rarotonga, Cook Islands 9-17 August 2017 Summary of purse seine fishery bycatch at a regional scale, 2003-2016 WCPFC-SC13-2017/ST-WP-05 T. Peatman, V. Allain, S. Caillot, P. Williams, and N. Smith Oceanic Fisheries Programme, FAME, Pacific Community (SPC) Executive Summary The Western and Central Pacific Fisheries Commission (WCPFC) has a responsibility to assess the impact of fishing on non-target species. In this report, we estimate the bycatch of the large-scale purse seine fishery operating primarily in tropical waters of the WCPFC Area east of 140°E. These large vessels, typically greater than 500 tonnes carrying capacity, have been responsible for approximately 83% of the purse seine catch of the main tuna target species, skipjack, yellowfin and bigeye tuna, in recent years, a catch which has varied between 1.5 and 2 million tonnes annually since 2010. Data are collected from large-scale purse seine vessels through logsheets completed by vessel operators, in which catch, primarily of the target species, and other information are recorded for each purse seine set. Since the mid-1990s, some vessels have had observers on board to collect more detailed information on fishing operations, including the quantities of bycatch. Observer coverage of the purse seine fleet was modest (<10%) prior to 2010, after which a new rule that all purse seine vessels should carry observers was agreed by WCPFC and implemented by its members, most notably those coastal states who are members of the Parties to the Nauru Agreement (PNA). Therefore, from 2010, coverage of available observer data increased dramatically to around 60-80% per year. -

Miscellaneous Demersal Fishes Capture Production by Species, Fishing Areas and Countries Or Areas B-34 Poissons Démersaux Diver
173 Miscellaneous demersal fishes Capture production by species, fishing areas and countries or areas B-34 Poissons démersaux divers Captures par espèces, zones de pêche et pays ou zones Peces demersales diversos Capturas por especies, áreas de pesca y países o áreas Species, Fishing area Espèce, Zone de pêche 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 Especie, Área de pesca t t t t t t t t t t Greater argentine ...B ...C Argentina silus 1,23(05)015,03 ARU 27 Netherlands ... ... ... ... ... ... 2 611 10 662 3 637 1 062 Norway ... ... ... ... ... ... ... ... ... 1 820 27 Fishing area total ... ... ... ... ... ... 2 611 10 662 3 637 2 882 Species total ... ... ... ... ... ... 2 611 10 662 3 637 2 882 Argentine ...B ...C Argentina sphyraena 1,23(05)015,04 ARY 27 Netherlands ... ... ... ... ... ... - - 2 232 3 566 Norway ... ... ... ... ... ... ... ... ... 2 584 27 Fishing area total ... ... ... ... ... ... ... ... 2 232 6 150 Species total ... ... ... ... ... ... ... ... 2 232 6 150 Argentines Argentines Argentinas Argentina spp 1,23(05)015,XX ARG 21 Canada 591 51 12 8 17 20 12 1 3 1 Cuba 553 4 5 - - - - - - - Russian Fed - - - 5 - - - - - - 21 Fishing area total 1 144 55 17 13 17 20 12 1 3 1 27 Denmark 1 455 748 1 420 1 039 916 614 918 910 470 335 Faroe Is 8 433 17 167 8 186 6 388 9 572 7 058 6 264 3 441 7 055 12 576 France - - 114 55 41 1 - 147 11 - Germany 1 498 633 24 483 189 150 164 1 086 181 219 Iceland 3 367 13 387 5 495 4 595 2 478 4 357 2 680 3 645 - 4 776 Ireland 1 089 405 396 4 709 7 505 7 592 96 82 20 - Netherlands 4 696 4 964 8 033 3 636 3 659 4 213 - - - - Norway 5 167 8 654 7 823 6 107 14 876 7 406 8 351 11 577 17 073 20 744 Portugal - - - - - - - - - 0 Russian Fed - - - 1 214 496 293 154 721 79 39 Spain - - - 34 34 3 7 18 19 50 Sweden 541 428 0 273 1 010 484 42 0 - 0 UK - - 28 - 7 955 4 862 109 579 75 5 27 Fishing area total 26 246 46 386 31 519 28 533 48 731 37 033 18 785 22 206 24 983 38 744 34 Morocco - - - - - - - 231 295 509 34 Fishing area total - - - - - - - 231 295 509 37 France - - 7 4 4 7 5 7 6 5 Morocco .. -

International Symposium on Circle Hooks in Research, Management, and Conservation Abstracts*
BULLETIN OF MARINE SCIENCE. 88(3):791–815. 2012 http://dx.doi.org/10.5343/bms.2012.1031 INTERNATIONAL SYMPOSIUM ON CIRCLE HOOKS IN RESEARCH, MANAGEMENT, AND CONSERVATION ABSTRACTS* Challenges OF circle hook adoption in Indonesian live bait long- line Fisheries by Ahmad Hafizh Adyas and Imam Musthofa Zainudin.—Since 2005, WWF-Indonesia has facilitated efforts to reduce sea turtle bycatch on tuna longlines. The onboard observer data collected between 2006 and 2010 covering 49 vessels documented 359 sea turtles harvested. While fishermen did not think this bycatch was a major problem, con- sidering the large number of vessels in the fleet there is a large potential of cumulative im- pacts. Forty vessels from Benoa-Bali and Bitung North Sulawesi have been involved in circle hook trials and adoption between 2006 and 2010, covering 128 fishing trips, 3361 settings, and using >70,000 circle hooks. The results are promising—circle hooks reduced sea turtle bycatch by 78% while catching target fish as effectively as traditional J-hooks. However, the circle hooks (C16) could not be applied in live bait fisheries due to their large size; the 5 mm shank of the circle hook was inadequate to hold the bait (typically milkfish of 15–20 cm) and also the bait typically dies faster. Given that around 90% of Indonesia’s tuna longline fleet use live bait (with shallow sets), this is a considerable issue to resolve. Other obstacles for adop- tion stem from the use of monofilament line and the basket hauling technique, and the shape and weight of the circle hooks, all of which are perceived by fishermen as making their work more difficult (e.g., harder to haul and also causes a rumpling in the line). -

Peces De La Fauna De Acompañamiento En La Pesca Industrial De Camarón En El Golfo De California, México
Peces de la fauna de acompañamiento en la pesca industrial de camarón en el Golfo de California, México Juana López-Martínez1, Eloisa Herrera-Valdivia1, Jesús Rodríguez-Romero2 & Sergio Hernández-Vázquez2 1. Centro de Investigaciones Biológicas del Noroeste, S.C. Km 2.35 Carretera a Las Tinajas, S/N Colonia Tinajas, Guaymas, Sonora, México C. P. 85460; [email protected], [email protected] 2. Centro de Investigaciones Biológicas del Noroeste, S.C. Apdo. postal 128 La Paz, B.C.S. C.P. 23000; [email protected], [email protected] Recibido 19-VII-2009. Corregido 15-III-2010. Aceptado 16-IV-2010. Abstract: Bycatch fish species from shrimp industrial fishery in the Gulf of California, Mexico. The shrimp fishery in the Gulf of California is one the most important activities of revenue and employment for communi- ties. Nevertheless, this fishery has also created a large bycatch problem, principally fish. To asses this issue, a group of observers were placed on board the industrial shrimp fleet and evaluated the Eastern side of the Gulf during 2004 and 2005. Studies consisted on 20kg samples of the capture for each trawl, and made possible a sys- tematic list of species for this geographic area. Fish represented 70% of the capture. A total of 51 101 fish were collected, belonging to two classes, 20 orders, 65 families, 127 genera, and 241 species. The order Perciformes was the most diverse with 31 families, 78 genera, and 158 species. The best represented families by number of species were: Sciaenidae (34) and Paralichthyidae (18) and Haemulidae and Carangidae (16 each). -

Estructura Y Distribución De La Comunidad Íctica Acompañante En La Pesca Del Camarón (Golfo De Tehuantepec
Estructura y distribución de la comunidad íctica acompañante en la pesca del camarón (Golfo de Tehuantepec. Pacífico Oriental, México) Marco A. Martínez-Muñoz ADVERTIMENT. La consulta d’aquesta tesi queda condicionada a l’acceptació de les següents condicions d'ús: La difusió d’aquesta tesi per mitjà del servei TDX (www.tdx.cat) ha estat autoritzada pels titulars dels drets de propietat intel·lectual únicament per a usos privats emmarcats en activitats d’investigació i docència. No s’autoritza la seva reproducció amb finalitats de lucre ni la seva difusió i posada a disposició des d’un lloc aliè al servei TDX. No s’autoritza la presentació del seu contingut en una finestra o marc aliè a TDX (framing). Aquesta reserva de drets afecta tant al resum de presentació de la tesi com als seus continguts. En la utilització o cita de parts de la tesi és obligat indicar el nom de la persona autora. ADVERTENCIA. La consulta de esta tesis queda condicionada a la aceptación de las siguientes condiciones de uso: La difusión de esta tesis por medio del servicio TDR (www.tdx.cat) ha sido autorizada por los titulares de los derechos de propiedad intelectual únicamente para usos privados enmarcados en actividades de investigación y docencia. No se autoriza su reproducción con finalidades de lucro ni su difusión y puesta a disposición desde un sitio ajeno al servicio TDR. No se autoriza la presentación de su contenido en una ventana o marco ajeno a TDR (framing). Esta reserva de derechos afecta tanto al resumen de presentación de la tesis como a sus contenidos. -

Fish, Crustaceans, Molluscs, Etc Capture Production by Species
542 Fish, crustaceans, molluscs, etc Capture production by species items Pacific, Eastern Central C-77 Poissons, crustacés, mollusques, etc Captures par catégories d'espèces Pacifique, centre-est (a) Peces, crustáceos, moluscos, etc Capturas por categorías de especies Pacífico, centro-oriental English name Scientific name Species group Nom anglais Nom scientifique Groupe d'espèces 2012 2013 2014 2015 2016 2017 2018 Nombre inglés Nombre científico Grupo de especies t t t t t t t Milkfish Chanos chanos 25 9 052 6 861 10 521 10 669 6 312 11 843 7 069 God's flounder Cyclopsetta panamensis 31 ... ... 117 2 20 20 113 California flounder Paralichthys californicus 31 171 170 178 185 210 255 253 Flatfishes nei Pleuronectiformes 31 3 190 4 340 5 401 5 775 5 583 6 346 6 251 North Pacific hake Merluccius productus 32 2 592 8 302 10 077 7 431 11 581 8 248 12 971 Gadiformes nei Gadiformes 32 71 1 1 855 180 949 202 Hawaiian ladyfish Elops hawaiensis 33 0 0 0 - 0 1 - Sea catfishes nei Ariidae 33 3 069 3 721 4 704 5 401 6 471 5 958 7 065 Squirrelfishes nei Holocentridae 33 23 26 25 4 24 26 19 Flathead grey mullet Mugil cephalus 33 516 3 877 5 055 6 266 7 989 6 957 8 947 White mullet Mugil curema 33 176 1 432 1 647 1 798 2 175 1 996 2 436 Bobo mullet Joturus pichardi 33 53 30 28 47 69 52 77 Mullets nei Mugilidae 33 2 972 464 389 557 746 617 834 Snooks(=Robalos) nei Centropomus spp 33 1 655 2 316 3 426 3 310 4 323 3 926 4 840 Groupers nei Epinephelus spp 33 48 45 42 42 42 42 41 ...A Paralabrax spp 33 5 878 5 317 5 520 5 308 5 682 5 892 6 364 Groupers, seabasses -

Familia De Peces Marinos De Panamá Y Su Correspondiente Número De Especies Familia Cuenta De Especie Fuente Acanthuridae 8 Froese, R
Familia de peces marinos de Panamá y su correspondiente número de especies Familia Cuenta de Especie Fuente Acanthuridae 8 Froese, R. and D. Pauly. Editors. 2007.FishBase. Achiridae 6 World Wide Web electronic publication. Albulidae 2 www.fishbase.org, version (04/2007). -
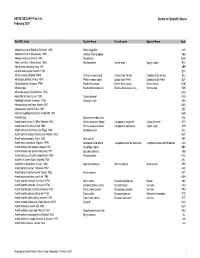
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

61661147.Pdf
Resource Inventory of Marine and Estuarine Fishes of the West Coast and Alaska: A Checklist of North Pacific and Arctic Ocean Species from Baja California to the Alaska–Yukon Border OCS Study MMS 2005-030 and USGS/NBII 2005-001 Project Cooperation This research addressed an information need identified Milton S. Love by the USGS Western Fisheries Research Center and the Marine Science Institute University of California, Santa Barbara to the Department University of California of the Interior’s Minerals Management Service, Pacific Santa Barbara, CA 93106 OCS Region, Camarillo, California. The resource inventory [email protected] information was further supported by the USGS’s National www.id.ucsb.edu/lovelab Biological Information Infrastructure as part of its ongoing aquatic GAP project in Puget Sound, Washington. Catherine W. Mecklenburg T. Anthony Mecklenburg Report Availability Pt. Stephens Research Available for viewing and in PDF at: P. O. Box 210307 http://wfrc.usgs.gov Auke Bay, AK 99821 http://far.nbii.gov [email protected] http://www.id.ucsb.edu/lovelab Lyman K. Thorsteinson Printed copies available from: Western Fisheries Research Center Milton Love U. S. Geological Survey Marine Science Institute 6505 NE 65th St. University of California, Santa Barbara Seattle, WA 98115 Santa Barbara, CA 93106 [email protected] (805) 893-2935 June 2005 Lyman Thorsteinson Western Fisheries Research Center Much of the research was performed under a coopera- U. S. Geological Survey tive agreement between the USGS’s Western Fisheries -
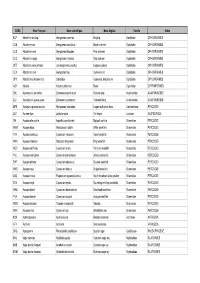
Nom Français
CODE Nom Français Nom scientifique Nom Anglais Famille Ordre KCP Abadèche du Cap Genypterus capensis Kingklip Ophidiidae OPHIDIIFORMES CUB Abadèche noir Genypterus maculatus Black cusk-eel Ophidiidae OPHIDIIFORMES CUS Abadèche rosé Genypterus blacodes Pink cusk-eel Ophidiidae OPHIDIIFORMES CUC Abadèche rouge Genypterus chilensis Red cusk-eel Ophidiidae OPHIDIIFORMES OFZ Abadèche sans jambes Lamprogrammus exutus Legless cuskeel Ophidiidae OPHIDIIFORMES CEX Abadèches nca Genypterus spp Cusk-eels nei Ophidiidae OPHIDIIFORMES OPH Abadèches, brotules nca Ophidiidae Cusk-eels, brotulas nei Ophidiidae OPHIDIIFORMES ALR Ablette Alburnus alburnus Bleak Cyprinidae CYPRINIFORMES ZML Acanthure à pierreries Zebrasoma gemmatum Spotted tang Acanthuridae ACANTHUROIDEI ZLV Acanthure à queue jaune Zebrasoma xanthurum Yellowtail tang Acanthuridae ACANTHUROIDEI MPS Achigan à grande bouche Micropterus salmoides Largemouth black bass Centrarchidae PERCOIDEI LQT Acmée râpe Lottia limatula File limpet Lottiidae GASTROPODA ISA Acoupa aile-courte Isopisthus parvipinnis Bigtooth corvina Sciaenidae PERCOIDEI WEW Acoupa blanc Atractoscion nobilis White weakfish Sciaenidae PERCOIDEI YNV Acoupa cambucu Cynoscion virescens Green weakfish Sciaenidae PERCOIDEI WKK Acoupa chasseur Macrodon ancylodon King weakfish Sciaenidae PERCOIDEI WEP Acoupa du Pérou Cynoscion analis Peruvian weakfish Sciaenidae PERCOIDEI YNJ Acoupa mongolare Cynoscion jamaicensis Jamaica weakfish Sciaenidae PERCOIDEI SWF Acoupa pintade Cynoscion nebulosus Spotted weakfish Sciaenidae PERCOIDEI WKS Acoupa -

Curriculum Vitae
CURRICULUM VITAE GORGONIO RUIZ-CAMPOS LUGAR Y FECHA DE NACIMIENTO: SABINAS HIDALGO, NUEVO LEON, MEXICO; JUNIO 23, 1959. DIRECCION ACTUAL: LAGO VENEZA # 779, FRACC. VALLE DORADO, ENSENADA BAJA CALIFORNIA 22890, MEXICO. TEL. (646) 1-77-74-82. E-Mail: [email protected]; [email protected] EDUCACION: Profesional. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, Monterrey, N.L., México. Licenciatura en Ciencias Biológicas. Septiembre 1976-Enero 1981. Maestría. Centro de Investigación Científica y de Educación Superior de Ensenada, Ensenada, B.C., México. Maestría en Ciencias en Ecología Marina. Enero 1983- Noviembre 1984. Doctorado. Facultad de Ciencias Biológicas, Universidad Autónoma de Nuevo León, Monterrey, N.L., México. Doctorado en Ciencias (Ecología Acuática y Pesca). Enero 1990 a Diciembre 1993. NOMBRAMIENTOS ACADEMICOS: 1983-1987. Profesor Asistente, Facultad de Ciencias, Universidad Autónoma de Baja California, Ensenada, B.C. 1989. Subdirector Administrativo, idem. 1988-1991. Profesor Asociado de Tiempo Completo, idem. 1991-2009. Profesor Titular "C" de Tiempo Completo con definitividad. Idem. 2010- Profesor-Investigador Titular "C" de Tiempo Completo con definitividad. Idem. 1991- Curador Científico de las Colecciones 1 Ictiológica y Ornitológica de la Facultad de Ciencias, Universidad Autónoma de Baja California. DISTINCIONES: 1984- Fundador de la Colección Ictiológica de la Universidad Autónoma de Baja California. 1988-1991. Candidato a Investigador Nacional, Sistema Nacional de Investigadores, México. Num. SNI 882525. 1990- Miembro del Cuerpo Núcleo de Profesores del Programa de Maestría en Manejo de Ecosistemas de Zonas Aridas, Facultad de Ciencias, Universidad Autónoma de Baja California. 1992-2012. Beca al Desempeño Académico Nivel 5. 1991-1994. Investigador Nacional nivel 1, idem.