The Role of GBA2 in Controlling Locomotor Activity
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Bacteria Belonging to Pseudomonas Typographi Sp. Nov. from the Bark Beetle Ips Typographus Have Genomic Potential to Aid in the Host Ecology
insects Article Bacteria Belonging to Pseudomonas typographi sp. nov. from the Bark Beetle Ips typographus Have Genomic Potential to Aid in the Host Ecology Ezequiel Peral-Aranega 1,2 , Zaki Saati-Santamaría 1,2 , Miroslav Kolaˇrik 3,4, Raúl Rivas 1,2,5 and Paula García-Fraile 1,2,4,5,* 1 Microbiology and Genetics Department, University of Salamanca, 37007 Salamanca, Spain; [email protected] (E.P.-A.); [email protected] (Z.S.-S.); [email protected] (R.R.) 2 Spanish-Portuguese Institute for Agricultural Research (CIALE), 37185 Salamanca, Spain 3 Department of Botany, Faculty of Science, Charles University, Benátská 2, 128 01 Prague, Czech Republic; [email protected] 4 Laboratory of Fungal Genetics and Metabolism, Institute of Microbiology of the Academy of Sciences of the Czech Republic, 142 20 Prague, Czech Republic 5 Associated Research Unit of Plant-Microorganism Interaction, University of Salamanca-IRNASA-CSIC, 37008 Salamanca, Spain * Correspondence: [email protected] Received: 4 July 2020; Accepted: 1 September 2020; Published: 3 September 2020 Simple Summary: European Bark Beetle (Ips typographus) is a pest that affects dead and weakened spruce trees. Under certain environmental conditions, it has massive outbreaks, resulting in attacks of healthy trees, becoming a forest pest. It has been proposed that the bark beetle’s microbiome plays a key role in the insect’s ecology, providing nutrients, inhibiting pathogens, and degrading tree defense compounds, among other probable traits. During a study of bacterial associates from I. typographus, we isolated three strains identified as Pseudomonas from different beetle life stages. In this work, we aimed to reveal the taxonomic status of these bacterial strains and to sequence and annotate their genomes to mine possible traits related to a role within the bark beetle holobiont. -

The Rise and Fall of the Bovine Corpus Luteum
University of Nebraska Medical Center DigitalCommons@UNMC Theses & Dissertations Graduate Studies Spring 5-6-2017 The Rise and Fall of the Bovine Corpus Luteum Heather Talbott University of Nebraska Medical Center Follow this and additional works at: https://digitalcommons.unmc.edu/etd Part of the Biochemistry Commons, Molecular Biology Commons, and the Obstetrics and Gynecology Commons Recommended Citation Talbott, Heather, "The Rise and Fall of the Bovine Corpus Luteum" (2017). Theses & Dissertations. 207. https://digitalcommons.unmc.edu/etd/207 This Dissertation is brought to you for free and open access by the Graduate Studies at DigitalCommons@UNMC. It has been accepted for inclusion in Theses & Dissertations by an authorized administrator of DigitalCommons@UNMC. For more information, please contact [email protected]. THE RISE AND FALL OF THE BOVINE CORPUS LUTEUM by Heather Talbott A DISSERTATION Presented to the Faculty of the University of Nebraska Graduate College in Partial Fulfillment of the Requirements for the Degree of Doctor of Philosophy Biochemistry and Molecular Biology Graduate Program Under the Supervision of Professor John S. Davis University of Nebraska Medical Center Omaha, Nebraska May, 2017 Supervisory Committee: Carol A. Casey, Ph.D. Andrea S. Cupp, Ph.D. Parmender P. Mehta, Ph.D. Justin L. Mott, Ph.D. i ACKNOWLEDGEMENTS This dissertation was supported by the Agriculture and Food Research Initiative from the USDA National Institute of Food and Agriculture (NIFA) Pre-doctoral award; University of Nebraska Medical Center Graduate Student Assistantship; University of Nebraska Medical Center Exceptional Incoming Graduate Student Award; the VA Nebraska-Western Iowa Health Care System Department of Veterans Affairs; and The Olson Center for Women’s Health, Department of Obstetrics and Gynecology, Nebraska Medical Center. -

1General Introduction and Outline Glycosphingolipids, Carbohydrate
Lipophilic iminosugars : synthesis and evaluation as inhibitors of glucosylceramide metabolism Wennekes, T. Citation Wennekes, T. (2008, December 15). Lipophilic iminosugars : synthesis and evaluation as inhibitors of glucosylceramide metabolism. Retrieved from https://hdl.handle.net/1887/13372 Version: Corrected Publisher’s Version Licence agreement concerning inclusion of doctoral thesis in the License: Institutional Repository of the University of Leiden Downloaded from: https://hdl.handle.net/1887/13372 Note: To cite this publication please use the final published version (if applicable). General Introduction and Outline Glycosphingolipids, Carbohydrate- 1 processing Enzymes and Iminosugar Inhibitors General Introduction The study described in this thesis was conducted with the aim of developing lipophilic iminosugars as selective inhibitors for three enzymes involved in glucosylceramide metabolism. Glucosylceramide, a β-glycoside of the lipid ceramide and the carbohydrate d-glucose, is a key member of a class of biomolecules called the glycosphingolipids (GSLs). One enzyme, glucosylceramide synthase (GCS), is responsible for its synthesis and the two other enzymes, glucocerebrosidase (GBA1) and β-glucosidase 2 (GBA2), catalyze its degradation. Being able to influence glucosylceramide biosynthesis and degradation would greatly facilitate the study of GSL functioning in (patho)physiological processes. This chapter aims to provide background information and some history on the various subjects that were involved in this study. The chapter will start out with a brief overview of the discovery of GSLs and the evolving view of the biological role of GSLs and carbohydrate containing biomolecules in general during the last century. Next, the topology and dynamics of mammalian GSL biosynthesis and degradation will be described with special attention for the involved carbohydrate-processing enzymes. -

A Computational Approach for Defining a Signature of Β-Cell Golgi Stress in Diabetes Mellitus
Page 1 of 781 Diabetes A Computational Approach for Defining a Signature of β-Cell Golgi Stress in Diabetes Mellitus Robert N. Bone1,6,7, Olufunmilola Oyebamiji2, Sayali Talware2, Sharmila Selvaraj2, Preethi Krishnan3,6, Farooq Syed1,6,7, Huanmei Wu2, Carmella Evans-Molina 1,3,4,5,6,7,8* Departments of 1Pediatrics, 3Medicine, 4Anatomy, Cell Biology & Physiology, 5Biochemistry & Molecular Biology, the 6Center for Diabetes & Metabolic Diseases, and the 7Herman B. Wells Center for Pediatric Research, Indiana University School of Medicine, Indianapolis, IN 46202; 2Department of BioHealth Informatics, Indiana University-Purdue University Indianapolis, Indianapolis, IN, 46202; 8Roudebush VA Medical Center, Indianapolis, IN 46202. *Corresponding Author(s): Carmella Evans-Molina, MD, PhD ([email protected]) Indiana University School of Medicine, 635 Barnhill Drive, MS 2031A, Indianapolis, IN 46202, Telephone: (317) 274-4145, Fax (317) 274-4107 Running Title: Golgi Stress Response in Diabetes Word Count: 4358 Number of Figures: 6 Keywords: Golgi apparatus stress, Islets, β cell, Type 1 diabetes, Type 2 diabetes 1 Diabetes Publish Ahead of Print, published online August 20, 2020 Diabetes Page 2 of 781 ABSTRACT The Golgi apparatus (GA) is an important site of insulin processing and granule maturation, but whether GA organelle dysfunction and GA stress are present in the diabetic β-cell has not been tested. We utilized an informatics-based approach to develop a transcriptional signature of β-cell GA stress using existing RNA sequencing and microarray datasets generated using human islets from donors with diabetes and islets where type 1(T1D) and type 2 diabetes (T2D) had been modeled ex vivo. To narrow our results to GA-specific genes, we applied a filter set of 1,030 genes accepted as GA associated. -

United States Patent (19) 11 Patent Number: 5,981,835 Austin-Phillips Et Al
USOO598.1835A United States Patent (19) 11 Patent Number: 5,981,835 Austin-Phillips et al. (45) Date of Patent: Nov. 9, 1999 54) TRANSGENIC PLANTS AS AN Brown and Atanassov (1985), Role of genetic background in ALTERNATIVE SOURCE OF Somatic embryogenesis in Medicago. Plant Cell Tissue LIGNOCELLULOSC-DEGRADING Organ Culture 4:107-114. ENZYMES Carrer et al. (1993), Kanamycin resistance as a Selectable marker for plastid transformation in tobacco. Mol. Gen. 75 Inventors: Sandra Austin-Phillips; Richard R. Genet. 241:49-56. Burgess, both of Madison; Thomas L. Castillo et al. (1994), Rapid production of fertile transgenic German, Hollandale; Thomas plants of Rye. Bio/Technology 12:1366–1371. Ziegelhoffer, Madison, all of Wis. Comai et al. (1990), Novel and useful properties of a chimeric plant promoter combining CaMV 35S and MAS 73 Assignee: Wisconsin Alumni Research elements. Plant Mol. Biol. 15:373-381. Foundation, Madison, Wis. Coughlan, M.P. (1988), Staining Techniques for the Detec tion of the Individual Components of Cellulolytic Enzyme 21 Appl. No.: 08/883,495 Systems. Methods in Enzymology 160:135-144. de Castro Silva Filho et al. (1996), Mitochondrial and 22 Filed: Jun. 26, 1997 chloroplast targeting Sequences in tandem modify protein import specificity in plant organelles. Plant Mol. Biol. Related U.S. Application Data 30:769-78O. 60 Provisional application No. 60/028,718, Oct. 17, 1996. Divne et al. (1994), The three-dimensional crystal structure 51 Int. Cl. ............................. C12N 15/82; C12N 5/04; of the catalytic core of cellobiohydrolase I from Tricho AO1H 5/00 derma reesei. Science 265:524-528. -

Molecular Reprogramming in Tomato Pollen During Development And
Molecular reprogramming in tomato pollen during development and heat stress Dissertation zur Erlangung des Doktorgrades der Naturwissenschaften vorgelegt beim Fachbereich Biowissenschaften (FB15) der Goethe-Universität Frankfurt am Main von Mario Keller geboren in Frankfurt am Main (Hessen) Frankfurt am Main 2018 (D30) Vom Fachbereich Biowissenschaften (FB15) der Goethe-Universität als Dissertation angenommen. Dekan: Prof. Dr. Sven Klimpel Gutachter: Prof. Dr. Enrico Schleiff, Jun. Prof. Dr. Michaela Müller-McNicoll Datum der Disputation: 25.03.2019 Index of contents Index of contents Index of contents ....................................................................................................................................... i Index of figures ........................................................................................................................................ iii Index of tables ......................................................................................................................................... iv Index of supplemental material ................................................................................................................ v Index of supplemental figures ............................................................................................................... v Index of supplemental tables ................................................................................................................ v Abbreviations .......................................................................................................................................... -

Supplementary Table S4. FGA Co-Expressed Gene List in LUAD
Supplementary Table S4. FGA co-expressed gene list in LUAD tumors Symbol R Locus Description FGG 0.919 4q28 fibrinogen gamma chain FGL1 0.635 8p22 fibrinogen-like 1 SLC7A2 0.536 8p22 solute carrier family 7 (cationic amino acid transporter, y+ system), member 2 DUSP4 0.521 8p12-p11 dual specificity phosphatase 4 HAL 0.51 12q22-q24.1histidine ammonia-lyase PDE4D 0.499 5q12 phosphodiesterase 4D, cAMP-specific FURIN 0.497 15q26.1 furin (paired basic amino acid cleaving enzyme) CPS1 0.49 2q35 carbamoyl-phosphate synthase 1, mitochondrial TESC 0.478 12q24.22 tescalcin INHA 0.465 2q35 inhibin, alpha S100P 0.461 4p16 S100 calcium binding protein P VPS37A 0.447 8p22 vacuolar protein sorting 37 homolog A (S. cerevisiae) SLC16A14 0.447 2q36.3 solute carrier family 16, member 14 PPARGC1A 0.443 4p15.1 peroxisome proliferator-activated receptor gamma, coactivator 1 alpha SIK1 0.435 21q22.3 salt-inducible kinase 1 IRS2 0.434 13q34 insulin receptor substrate 2 RND1 0.433 12q12 Rho family GTPase 1 HGD 0.433 3q13.33 homogentisate 1,2-dioxygenase PTP4A1 0.432 6q12 protein tyrosine phosphatase type IVA, member 1 C8orf4 0.428 8p11.2 chromosome 8 open reading frame 4 DDC 0.427 7p12.2 dopa decarboxylase (aromatic L-amino acid decarboxylase) TACC2 0.427 10q26 transforming, acidic coiled-coil containing protein 2 MUC13 0.422 3q21.2 mucin 13, cell surface associated C5 0.412 9q33-q34 complement component 5 NR4A2 0.412 2q22-q23 nuclear receptor subfamily 4, group A, member 2 EYS 0.411 6q12 eyes shut homolog (Drosophila) GPX2 0.406 14q24.1 glutathione peroxidase -

Transcriptomic and Proteomic Profiling Provides Insight Into
BASIC RESEARCH www.jasn.org Transcriptomic and Proteomic Profiling Provides Insight into Mesangial Cell Function in IgA Nephropathy † † ‡ Peidi Liu,* Emelie Lassén,* Viji Nair, Celine C. Berthier, Miyuki Suguro, Carina Sihlbom,§ † | † Matthias Kretzler, Christer Betsholtz, ¶ Börje Haraldsson,* Wenjun Ju, Kerstin Ebefors,* and Jenny Nyström* *Department of Physiology, Institute of Neuroscience and Physiology, §Proteomics Core Facility at University of Gothenburg, University of Gothenburg, Gothenburg, Sweden; †Division of Nephrology, Department of Internal Medicine and Department of Computational Medicine and Bioinformatics, University of Michigan, Ann Arbor, Michigan; ‡Division of Molecular Medicine, Aichi Cancer Center Research Institute, Nagoya, Japan; |Department of Immunology, Genetics and Pathology, Uppsala University, Uppsala, Sweden; and ¶Integrated Cardio Metabolic Centre, Karolinska Institutet Novum, Huddinge, Sweden ABSTRACT IgA nephropathy (IgAN), the most common GN worldwide, is characterized by circulating galactose-deficient IgA (gd-IgA) that forms immune complexes. The immune complexes are deposited in the glomerular mesangium, leading to inflammation and loss of renal function, but the complete pathophysiology of the disease is not understood. Using an integrated global transcriptomic and proteomic profiling approach, we investigated the role of the mesangium in the onset and progression of IgAN. Global gene expression was investigated by microarray analysis of the glomerular compartment of renal biopsy specimens from patients with IgAN (n=19) and controls (n=22). Using curated glomerular cell type–specific genes from the published literature, we found differential expression of a much higher percentage of mesangial cell–positive standard genes than podocyte-positive standard genes in IgAN. Principal coordinate analysis of expression data revealed clear separation of patient and control samples on the basis of mesangial but not podocyte cell–positive standard genes. -

Are Glucosylceramide-Related Sphingolipids Involved in the Increased Risk for Cancer in Gaucher Disease Patients? Review and Hypotheses
cancers Review Are Glucosylceramide-Related Sphingolipids Involved in the Increased Risk for Cancer in Gaucher Disease Patients? Review and Hypotheses 1,2, 1,3, 1 1,2 Patricia Dubot y , Leonardo Astudillo y, Nicole Therville , Frédérique Sabourdy , Jérôme Stirnemann 4 , Thierry Levade 1,2,* and Nathalie Andrieu-Abadie 1,* 1 INSERM UMR1037, CRCT (Cancer Research Center of Toulouse), and Université Paul Sabatier, 31037 Toulouse, France; [email protected] (P.D.); [email protected] (L.A.); [email protected] (N.T.); [email protected] (F.S.) 2 Laboratoire de Biochimie Métabolique, Centre de Référence en Maladies Héréditaires du Métabolisme, Institut Fédératif de Biologie, CHU de Toulouse, 31059 Toulouse, France 3 Service de Médecine Interne, CHU de Toulouse, 31059 Toulouse, France 4 Service de Médecine Interne Générale, Hôpitaux Universitaires de Genève, CH-1211 Geneva, Switzerland; [email protected] * Correspondence: [email protected] (T.L.); [email protected] (N.A.-A.) These authors contributed equally to this work. y Received: 28 November 2019; Accepted: 14 February 2020; Published: 18 February 2020 Abstract: The roles of ceramide and its catabolites, i.e., sphingosine and sphingosine 1-phosphate, in the development of malignancies and the response to anticancer regimens have been extensively described. Moreover, an abundant literature points to the effects of glucosylceramide synthase, the mammalian enzyme that converts ceramide to β-glucosylceramide, in protecting tumor cells from chemotherapy. Much less is known about the contribution of β-glucosylceramide and its breakdown products in cancer progression. In this chapter, we first review published and personal clinical observations that report on the increased risk of developing cancers in patients affected with Gaucher disease, an inborn disorder characterized by defective lysosomal degradation of β-glucosylceramide. -
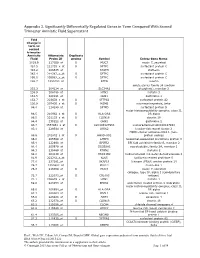
Appendix 2. Significantly Differentially Regulated Genes in Term Compared with Second Trimester Amniotic Fluid Supernatant
Appendix 2. Significantly Differentially Regulated Genes in Term Compared With Second Trimester Amniotic Fluid Supernatant Fold Change in term vs second trimester Amniotic Affymetrix Duplicate Fluid Probe ID probes Symbol Entrez Gene Name 1019.9 217059_at D MUC7 mucin 7, secreted 424.5 211735_x_at D SFTPC surfactant protein C 416.2 206835_at STATH statherin 363.4 214387_x_at D SFTPC surfactant protein C 295.5 205982_x_at D SFTPC surfactant protein C 288.7 1553454_at RPTN repetin solute carrier family 34 (sodium 251.3 204124_at SLC34A2 phosphate), member 2 238.9 206786_at HTN3 histatin 3 161.5 220191_at GKN1 gastrokine 1 152.7 223678_s_at D SFTPA2 surfactant protein A2 130.9 207430_s_at D MSMB microseminoprotein, beta- 99.0 214199_at SFTPD surfactant protein D major histocompatibility complex, class II, 96.5 210982_s_at D HLA-DRA DR alpha 96.5 221133_s_at D CLDN18 claudin 18 94.4 238222_at GKN2 gastrokine 2 93.7 1557961_s_at D LOC100127983 uncharacterized LOC100127983 93.1 229584_at LRRK2 leucine-rich repeat kinase 2 HOXD cluster antisense RNA 1 (non- 88.6 242042_s_at D HOXD-AS1 protein coding) 86.0 205569_at LAMP3 lysosomal-associated membrane protein 3 85.4 232698_at BPIFB2 BPI fold containing family B, member 2 84.4 205979_at SCGB2A1 secretoglobin, family 2A, member 1 84.3 230469_at RTKN2 rhotekin 2 82.2 204130_at HSD11B2 hydroxysteroid (11-beta) dehydrogenase 2 81.9 222242_s_at KLK5 kallikrein-related peptidase 5 77.0 237281_at AKAP14 A kinase (PRKA) anchor protein 14 76.7 1553602_at MUCL1 mucin-like 1 76.3 216359_at D MUC7 mucin 7, -

Linking Gaucher's Disease And
Journal of Young Investigators RESEARCH REVIEW The Role of Mutant Glucocerebrosidase and α-Synuclein Oligomerization in Neurodegeneration: Linking Gaucher’s Disease and Parkinson’s Disease Brendan Scot Tanner1* and John Porter 2 Gaucher’s disease is a pathology associated with intracellular accumulation of glucosylceramide due to glucocerebrosidase dysfuntion. Gaucher’s disease, type I in particular, does not usually present with neurologic components; however, researchers and physicians have recently noted an increased incidence of Parkinsonism in patients with type I Gaucher’s. Parkinson’s disease is a pathology affecting dopaminergic nerve tracts in motor cortices, most notably the substantia nigra. The disease is microscopically characterized by the presence of α-synuclein inclusions (Lewy bodies) in dopaminergic neurons. In an attempt to link the pathologies at a biomolecular level, researchers utilized numerous strategies, all culminating in several common observations: mutations of glucocerebrosidase, mutations of α-synuclein, and lysosomal dysfunction. Accumulated mutations and lysosomal dysfunction result in a complex feed-forward mechanism leading to aberrant ER-Golgi function. This review aims to highlight the previously unknown mechanism of Gaucher-linked Parkinsonism and to shed light on the future direction of linking and treating similar pathologies. INTRODUCTION chromosome 1q22 (Cullen et al. 2011). Each variant of the Observing an increased incidence of Parkinsonism in patients disease manifests in a slightly different manner. This paper will with type I Gaucher’s disease focus on type I Gaucher's disease, common among the Ashkenazi Jews. Type I Gaucher’s disease is the non-neuropathic variant Researchers have spent considerable amounts of energy in an that results in hepatomegaly, splenomegaly, thrombocytopenia, attempt to link two pathophysiological events, α-synuclein and leukopenia, although most patients remain asymptomatic aggregation and glucocerebrosidase dysfunction. -
A Specific Activity‐Based Probe to Monitor Family
DOI:10.1002/cbic.201600561 Full Papers ASpecific Activity-Based Probe to Monitor Family GH59 Galactosylceramidase, the Enzyme Deficient in Krabbe Disease AndrØ R. A. Marques+,[a, f] LianneI.Willems+,[b, g] DanielaHerreraMoro,[a] BogdanI.Florea,[b] SaskiaScheij,[a] RoelofOttenhoff,[a] Cindy P. A. A. van Roomen,[a] Marri Verhoek,[c] JessicaK.Nelson,[a] WouterW.Kallemeijn,[c] AnnaBiela-Banas,[d] Olivier R. Martin,[d] M. BegoÇa Cachón-Gonzµlez,[e] Nee Na Kim,[e] Timothy M. Cox,[e] Rolf G. Boot,[c] Herman S. Overkleeft,*[b] and Johannes M. F. G. Aerts*[a, c] Galactosylceramidase (GALC) is the lysosomal b-galactosidase ring specificity for GALC,equipped with aBODIPY fluorophore responsible for the hydrolysis of galactosylceramide. Inherited at C6 that allows visualization of active enzyme in cellsand tis- deficiency in GALC causes Krabbedisease, adevastating neuro- sues. Detection of residual GALC in patient fibroblasts holds logical disordercharacterizedbyaccumulation of galactosylcer- great promise forlaboratory diagnosis of Krabbedisease.We amide and its deacylated counterpart, the toxic sphingoid base furtherdescribe aprocedure for in situ imaging of active GALC galactosylsphingosine (psychosine). We report the design and in murinebrain by intra-cerebroventricularinfusionofthe ABP. application of afluorescently tagged activity-based probe In conclusion, this GALC-specific ABP should find broad appli- (ABP) for the sensitive and specific labeling of active GALC cations in diagnosis, drug development, and evaluation of molecules from various species. The probe consists of a b-gal- therapyfor Krabbe disease. actopyranose-configured cyclophellitol-epoxide core, confer- Introduction Glycoside hydrolase family 59 (GH59) humangalactosylcerami- the b-anomericconfiguration of the released galactopyrano- dase (GALC, galactocerebrosidase) is an 80 kDa protein respon- side (Scheme 1A).