Indagando Aspectos Evolutivos Con Filogenias: Reloj Molecular Y Otras
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
Acta Botánica Mexicana
ISSN 0187-7151 Acta Botánica WMMexican Acta Botánica Mexicana Acta Botánica Mexicana (ISSN 0187-7151) es una publicación de Instituto de Ecología, A.C. que aparece cuatro veces al año. Da a conocer trabajos originales e inéditos sobre temas botánicos y en particular los relacionados con plantas mexicanas. Todo artículo que se presente para su publicación deberá dirigirse al Comité Editorial de Acta Botánica Mexicana. Pueden reproducirse sin autorización pequeños fragmentos de texto siempre y cuando se den los créditos correspondientes. La reproducción o traducción de artículos completos requiere el permiso de la institución que edita la revista. Las normas editoriales e instrucciones para los autores pueden consultarse en la página wwwl.inecol.edu.mx/abm Acta Botánica Mexicana está actualmente incluida en los siguientes índices y bases de datos de literatura científica: Biological Abstraéis, BIOSIS Previews, Dialnet, índice de Revistas Mexicanas de Investigación Científica y Tecnológica del CONACyT, Journal Citation Reports/Science Edition (con cálculo de factor de impacto), Latindex - Catálogo, RedALyC, SciELO, Science Citation Index Expanded y Scopus. COMITÉ EDITORIAL Editor responsable: Jerzy Rzedowski Rotter Producción Editorial: Rosa Ma. Murillo Martínez Asistente de producción: Patricia Mayoral Loera Editores asociados: Pablo Carrillo Reyes Adolfo Espejo Sema Víctor W. Steinmann Efraín de Luna García Jorge Arturo Meave del Castillo Sergio Zamudio Ruiz Ma. del Socorro González Elizondo Carlos Montaña Cambelli CONSEJO EDITORIAL INTERNACIONAL William R. Anderson, University of Michigan, Hugh H. litis, University of Wisconsin, E.U.A. E.U.A. Sergio Archangelsky, Museo Argentino de Ciencias Antonio Lot, Instituto de Biología, UNAM, Naturales, “Bemardino Rivadavia”, Argentina México Ma. de la Luz Arreguín-Sánchez, Escuela Nacional Carlos Eduardo de Mattos Bicudo, Instituto de de Ciencias Biológicas, IPN, México Botánica, Sao Paulo, Brasil Henrik Balslev, Aarhus Universitet, Dinamarca John T. -

José Guadalupe García-Franco
CURRICULUM VITAE JOSÉ GUADALUPE GARCÍA-FRANCO 20/08/2015 Curriculun Vitae García-Franco Contenido 1. DATOS PERSONALES ..................................................................................................................... 5 2. DATOS LABORALES ....................................................................................................................... 5 3. FORMACIÓN PROFESIONAL ............................................................................................................ 5 3.1. Licenciatura: .......................................................................................................................... 5 3.2. Maestría: ................................................................................................................................ 5 3.3. Doctorado: ............................................................................................................................. 5 4. PERTENENCIA AL SISTEMA NACIONAL DE INVESTIGADORES ......................................................... 5 5. DOMINIO DE IDIOMAS EXTRANJEROS ............................................................................................ 5 6. BECAS OBTENIDAS PARA SU FORMACIÓN PROFESIONAL ............................................................... 5 7. EXPERIENCIA LABORAL ................................................................................................................ 6 8. ASISTENCIA A CURSOS Y TALLERES DE CAPACITACIÓN .............................................................. 6 9. -

The Florida East Coast Bromeliad Society June 2014
1 The Florida East Coast Bromeliad Society June 2014 The Florida East Coast Bromeliad Society Next meeting Sunday, June 8th, 2014 1:30pm. Colony in the Wood – club house 4000 S. Clyde Morris Blvd., Port Orange 32129 June 2014 Summertime is the Right Time… President – Jay Thurrott 386/761-4804 Vice President – Bill Hazard 386/882-3850 Secretary – Jillian Ragia 386/801-2500 Treasurer – Eve Krauth 386/763-2084 ________________________________________________________________________________ When is a good time to separate bromeliad to do it, but somehow Tree managed to pups? When should we repot existing prepare and orchestrate placement of many bromeliads – either to a larger pot size or just of the refreshments for the meeting while to replace the “worn-out” potting mix? When visiting with family for Mothers Day at the are the oak tree leaves finally going to stop same time as the meeting. That’s an example falling into my bromeliads so I can clean all of ‘multi-tasking’ at its best and our sincerest of the fallen debris out of the leaf axils? That thanks go Tree and Bill for their hard work in time is here! It’s summertime and if you plan hosting our May FECBS meeting! Everyone your workdays in the garden so that you can “ooh’d” and “aaaah’d” over the use of avoid the mid-day heat of Florida’s summer, bromeliads in the landscaping and many you can accomplish a lot in the garden. went home with plants that Bill had so Summer in Northeast Florida is when our generously donated for the raffle. -

VOLUME LII Second Quarter 2018
Bromeliaceae VOLUME LII Second Quarter 2018 The Bromeliad Society of Queensland Inc. P.O. Box 565, Fortitude Valley, Q 4006 www.bromsqueensland.com.au Email: [email protected] [email protected] [email protected] Committee Details PRESIDENT Barry Kable (07) 3824 5931 VICE PRESIDENT John Olsen (07) 3856 0265 TREASURER John Olsen SECRETARY Alfonso Trudu COMMITTEE Pam Butler, John Williamson, Gilda Trudu, Glenn Bernoth, Fred Thomson, Tom Isaac, Joy Constantino, Maxim Wilson, Bruce Dunstan. DATABASE MANAGER John Williamson LIBRARIAN Evelyn Rees SHOW CONVENOR John Williamson BROMELIACEAE EDITORS John Olsen, Barbara Murray, Maxim Wilson BSQ WEBMASTER Joy Constantino FIELD DAY COORDINATORS Ruth Kimber & Bev Mulcahy SEED BANK COORDINATOR Peter Ball SUPPER STEWARDS Selga Boothby & Sharon Born PLANT SALES Margaret Kraa & Lee Thornycroft ASSISTANT SALES Michelle Cameron COMPETITION STEWARDS Fred Thomson, Denice McLean, Helen Moriarty NEWSLETTER COORDINATOR Maxim Wilson ASSISTANT SHOW CONVENER Peter Ball HALL COORDINATOR David Rees RAFFLE COORDINATOR Lesley Gibbs EXHIBITION COORDINATOR Amanda Meads HISTORIAN Glenn Bernoth MONTHLY MEETINGS of the Society are held on the 3 rd Thursday of each month except for December, at the Uniting Hall, 52 Merthyr Road, New Farm, Brisbane, commencing 7:30 pm. ANNUAL GENERAL MEETING is held immediately before the March Meeting Front Cover: Edmundoa ‘Rosea’ painting Rear Cover: Tillandsia funckiana By: Steve Molnar The Bromeliad Society of Queensland Inc., gives permission to all Bromeliad Societies to reprint articles in their journals provided [email protected] is advised and proper acknowledgement is given to the original author and Bromeliaceae. This permission does not apply to any other person or organisation without the prior permission of the author. -

FLORIDA WEST COAST BROMELIAD SOCIETY 1954-2014 Celebrating 60 Years of Bromeliads Floridabromeliads.Org
FLORIDA WEST COAST BROMELIAD SOCIETY 1954-2014 Celebrating 60 Years of Bromeliads floridabromeliads.org July 2014 Newsletter NEXT MEETING Date & Time: Location: Tuesday, July 1 Good Samaritan Church Doors open at 7 pm; meeting starts at 7:30 6085 Park Boulevard Pinellas Park, Florida 33781 Program Dennis Cathcart’s presentation, New Explorations and Discoveries in Brazil--Part I, is based on the recent five-week trip he and his wife Linda took to Brazil that took them through four of Brazil’s 26 states. Their objectives were to find Dyckias and other terrestrial bromeliads and visit some of the bromeliad colonies they had known from past visits to Brazil. Along the way they found the Dyckias and so much more—varied scenery, diverse biological zones and climates, wildlife, insects, and plants. Hopefully the ‘Part I’ in the title means we can look forward to additional chapters in their 2014 Brazil tour story. Dennis and Linda have owned and operated Tropiflora Nursery in Sarasota, Florida, since 1976. The nursery specializes in rare and exotic plants, primarily bromeliads along with orchids, cycads, caudiciforms, succulents, ferns, palms and more. It is one of the largest collector-oriented exotic plant nurseries in the United States and has over 200,000 square feet of greenhouses. Many of the plants in their collection were collected by them as seeds and cuttings on their more than100 collecting expeditions made in over 35 years and in 27 countries. Plant Sales The speaker will be the sole plant vendor for this meeting and there will be no member plant sales. -
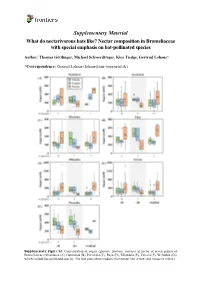
Supplementary Material What Do Nectarivorous Bats Like? Nectar Composition in Bromeliaceae with Special Emphasis on Bat-Pollinated Species
Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S1: Concentration of sugars (glucose, fructose, sucrose) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)) which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S2: Concentration of amino acids (ala, arg, asn, asp, gaba, gln, glu, gly, his, iso, leu, lys, met, phe, pro, ser, thr, trp, tyr, val) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S3: Cation concentrations (Ca2+, K+, Na+, Mg2+) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). -

Adaptive Radiation, Correlated and Contingent Evolution, and Net Species Diversification in Bromeliaceae
Molecular Phylogenetics and Evolution 71 (2014) 55–78 Contents lists available at ScienceDirect Molecular Phylogenetics and Evolution journal homepage: www.elsevier.com/locate/ympev Adaptive radiation, correlated and contingent evolution, and net species diversification in Bromeliaceae Thomas J. Givnish a,*, Michael H.J. Barfuss b, Benjamin Van Ee c, Ricarda Riina d, Katharina Schulte e,f, Ralf Horres g, Philip A. Gonsiska a, Rachel S. Jabaily h, Darren M. Crayn f, J. Andrew C. Smith i, Klaus Winter j, Gregory K. Brown k, Timothy M. Evans l, Bruce K. Holst m, Harry Luther n, Walter Till b, Georg Zizka e, Paul E. Berry o, Kenneth J. Sytsma a a Department of Botany, University of Wisconsin-Madison, Madison, WI 53706, USA b Department of Systematic and Evolutionary Botany, Faculty of Life Sciences, University of Vienna, Vienna A-1030, Austria c School of Natural Sciences, Black Hills State University, Spearfish, SD 57799, USA d Real Jardín Botánico, CSIC, Plaza de Murillo 2, Madrid 28014, Spain e Department of Botany and Molecular Evolution, Research Institute Senckenberg and J.W. Goethe University, Frankfurt am Main D-60325, Germany f Australian Tropical Herbarium, James Cook University, Cairns, QLD 4878, Australia g GenXPro, Frankfurt am Main 60438, Germany h Department of Biology, Rhodes College, Memphis, TN 38112, USA i Department of Plant Sciences, University of Oxford, Oxford OX1 3RB, United Kingdom j Smithsonian Tropical Research Institute, Balboa, Ancon, Republic of Panama k Department of Botany, University of Wyoming, Laramie, WY 82071, USA l Department of Biology, Grand Valley State University, Allendale, MI 49401, USA m Marie Selby Botanical Gardens, Sarasota, FL 34236, USA n Gardens By The Bay, National Parks Board Headquarters, Singapore 259569, Singapore o Department of Ecology and Evolutionary Biology, University of Michigan, Ann Arbor, MI 48109, USA article info abstract Article history: We present an integrative model predicting associations among epiphytism, the tank habit, entangling Received 22 May 2013 seeds, C3 vs. -

FERNANDA MARIA CORDEIRO DE OLIVEIRA.Pdf
UNIVERSIDADE ESTADUAL DE PONTA GROSSA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA EVOLUTIVA (Associação Ampla entre a UEPG e a UNICENTRO) FERNANDA MARIA CORDEIRO DE OLIVEIRA O GÊNERO QUESNELIA GAUDICH. (BROMELIACEAE-BROMELIOIDEAE) NO ESTADO DO PARANÁ, BRASIL: ASPECTOS TAXONÔMICOS E ANATÔMICOS PONTA GROSSA 2012 UNIVERSIDADE ESTADUAL DE PONTA GROSSA PROGRAMA DE PÓS-GRADUAÇÃO EM BIOLOGIA EVOLUTIVA (Associação Ampla entre a UEPG e a UNICENTRO) FERNANDA MARIA CORDEIRO DE OLIVEIRA O GÊNERO QUESNELIA GAUDICH. (BROMELIACEAE-BROMELIOIDEAE) NO ESTADO DO PARANÁ, BRASIL: ASPECTOS TAXONÔMICOS E ANATÔMICOS Dissertação de mestrado apresentada ao Programa de Pós-Graduação em Biologia Evolutiva da Universidade Estadual de Ponta Grossa, em associação com a Universidade Estadual do Centro Oeste como parte dos requisitos para a obtenção do título de mestre em Ciências Biológicas (Área de Concentração em Biologia Evolutiva) Orientadora: Prof. Dra. Rosângela Capuano Tardivo; Co-orientadora: Prof. Dra. Maria Eugênia Costa PONTA GROSSA 2012 “Somewhere over the rainbow Way up high, There's a land that I dreamed of Once in a lullaby. Somewhere over the rainbow Skies are blue, And the dreams that you dare to dream Really do come true. Someday I'll wish upon a star And wake up where the clouds are far Behind me. Where troubles melt like lemon drops High above the chimney tops That's where you'll find me. Somewhere over the rainbow Bluebirds fly. Birds fly over the rainbow. Why then, oh why can't I?” Over the rainbow – E.Y Harburg “O mundo e o universo são lugares extremamente belos e quanto mais os conhecemos, mais belos eles parecem.” (Richard Dawkins) “Ame muitas coisas, porque em amar está a verdadeira força. -

Vascular Epiphytes As Bioindicators of Climate Change and Their Own Vulnerability
VASCULAR EPIPHYTES AS BIOINDICATORS OF CLIMATE CHANGE AND THEIR OWN VULNERABILITY Von der Fakultät für Mathematik und Naturwissenschaften der Carl von Ossietzky Universität Oldenburg zur Erlangung des Grades und Titels eines Doktors der Naturwissenschaften (Dr. rer. nat.) angenommene Dissertation von Frau Siouxsie Maddy Correa Moya Geboren am 11 Dezember 1985 in Caracas-Venezuela Gutachter: Prof. Dr. Gerhard Zotz Zweitgutachter: Prof. Dr. Michael Kleyer Tag der Disputation: 08.09.2017 “When you learn through the crisis - if you are able! - ... You really learn from your heart… and, this knowledge remains deeply rooted in you…” Siouxsie Correa “In the middle of difficulties lies the opportunity” Albert Einstein Claude Levi-Strauss said that the scientist is not a person who gives the right answer; he is one who asks the right questions. It may be partially true; however, I would rather complete this sentence saying: … that the scientist may have the, apparently, right answer today, but it may not be valid tomorrow. ACKNOWLEDGEMENTS First at all, I would like to thank the existence of music, which companied me along all stages of my PhD project and offered me a refugee in difficult moments, inspiration and relaxation during the work journey. Classical artists such as: Mozart, Beethoven, Chopin, Bach, and some of Tchaikovsky´s Waltz were sine qua non companies in the high concentration stages. Grandiose progressive, symphonic and psychedelic rock bands as well as jazz and blues bands were also part of my delight. Among some of these bands I could thanks for their great music: King Crimson, Eloy, Hawkwind, Yes, Gentle Giant, Marmalade, Marillion, Janis Joplin (my favourite ever), John Coltrane, The Trio (Paco de Lucía, Al Di Meola and John Mclaughlin). -

Bromelcairns Bimonthly Newsletter of Cairns Bromeliad Societ Inc
Bromelcairns Bimonthly Newsletter of Cairns Bromeliad Societ Inc. 2016 # 2 P.O. Box 28 Cairns Queensland 4870 Austalia President Brendan Leishman 0740578604 V-President Matt Wilson Secretary Dave Weston 0740578604 Treasurer Kelly Knight 0418768167 Librarian Steven French 0740322283 Editor Lynn Hudson 0740533913 Editor Assist. Jodie Smith 0405022155 Concierge Sharron Miller 0740322283 Pop.Vote Steward Lynn Hudson 0740533913 OIC Raffles Karen Stevens 0740361086 OIC Pots Frances Boyd 0740552550 Honorary Life Member - Grace Goode O.A.M. Honorary Life Member - Kay Edington Life Member - Lynn Hudson Life Member - Robert (Bob) Hudson ******************************************************************** Aims of the Society Promote and Develop Interest in Bromeliads through Friendship To Co-operate with similar Clubs throughout the World ******************************************************************** Membership Fee: $15 Single, $25 Family, Country Member $25. $7.50 junior (if not in family membership) Meetings start at 1.pm sharp first Saturday of the month. Please bring a cup and a chair. Library: All books & magazines borrowed are to be returned in good order to the following meeting. If not on wait list, they may be rebooked. Plant Display/Sales: To participate, a member must be financial and circumstances permitting, have attended at least three meetings in the past six months. Where the society is charged a stall fee - 20% of sales are deducted for club funds. No charge venue & meetings - 10% of sales is deducted. All plants to be clean, free of disease, named and price tagged. Show Plants: Must be the property of and in the custody of the entrant for the past three months. For Society Shows the entrant must be financial and have attended at least three meetings during the past six months. -

Hechtia Glomerata Zucc
::9'.::: ~ CIENCIAS ... ( BIOLÓGICAS CICY Centro de Investigación Científica de Yucatán, A.C. Posgrado en Ciencias Biológicas SISTEMÁTICA Y FILOGENIA DEL COMPLEJO HECHTIA GLOMERATA ZUCC. (HECHTIOIDEAE: BROMELIACEAE) Tesis que presenta CARLOS FRANCISCO JIMÉNEZ NAH En opción al título de MAESTRO EN CIENCIAS (Ciencias Biológicas: Opción Recursos Naturales) Mérida, Yucatán, México Diciembre, 2014 ~... ~ ( POSGRADO EN RECONOCIMIENTO ) CIENCIAS CICY ( BIOLÓGICAS Por medio de la presente, hago constar que el trabajo de tesis titulado Sistemática y filogenia del complejo Hechtia glomerata Zucc. (Hechtioideae: Bromeliaceae), fue realizado en los laboratorios de la Unidad de Recursos Naturales del Centro de Investigación Científica de Yucatán, A.C., bajo la dirección de la Dra. lvón Mercedes Ramírez Morillo, dentro de la Opción de Recursos Naturales perteneciente al Programa de Posgrado en Ciencias Biológicas de este Centro. Atentamente, Director de Docencia Centro de Investigación Científica de Yucatán, AC. Mérida, Yucatán, México; a diciembre de 2014 DECLARACIÓN DE PROPIEDAD Declaro que la información contenida en la sección de Materiales y Métodos Experimentales, los Resultados y Discusión de este documento, proviene de las actividades de experimentación realizadas durante el período que se me asignó para desarrollar mi trabajo de tesis, en las Unidades y Laboratorios del Centro de Investigación Científica de Yucatán, A.C., y que a razón de lo anterior y en contraprestación de los servicios educativos o de apoyo que me fueron brindados, dicha información, en términos de la Ley Federal del Derecho de Autor y la Ley de la Propiedad Industrial, le pertenece patrimonialmente a dicho Centro de Investigación. Por otra parte, en virtud de lo ya manifestado, reconozco que de igual manera los productos intelectuales o desarrollos tecnológicos que deriven o pudieran derivar de lo correspondiente a dicha información, le pertenecen patrimonialmente al Centro de Investigación Científica de Yucatán, A.C. -

Bromeliad Flora of Oaxaca, Mexico: Richness and Distribution
Acta Botanica Mexicana 81: 71-147 (2007) BROMELIAD FLORA OF OAXACA, MEXICO: RICHNESS AND DISTRIBUTION ADOLFO ESPEJO-SERNA1, ANA ROSA LÓPEZ-FERRARI1,NANCY MARTÍNEZ-CORRea1 AND VALERIA ANGÉLICA PULIDO-ESPARZA2 1Universidad Autónoma Metropolitana-Iztapalapa, División de Ciencias Biológicas y de la Salud, Departamento de Biología, Herbario Metropolitano, Apdo. postal 55-535, 09340 México, D.F., México. [email protected] 2El Colegio de la Frontera Sur - San Cristóbal de las Casas, Laboratorio de Análisis de Información Geográfica y Estadística, Chiapas, México. [email protected] ABSTRACT The current knowledge of the bromeliad flora of the state of Oaxaca, Mexico is presented. Oaxaca is the Mexican state with the largest number of bromeliad species. Based on the study of 2,624 herbarium specimens corresponding to 1,643 collections, and a detailed bibliographic revision, we conclude that the currently known bromeliad flora for Oaxaca comprises 172 species and 15 genera. All Mexican species of the genera Bromelia, Fosterella, Greigia, Hohenbergiopsis, Racinaea, and Vriesea are represented in the state. Aechmea nudicaulis, Bromelia hemisphaerica, Catopsis nitida, C. oerstediana, C. wawranea, Pitcairnia schiedeana, P. tuerckheimii, Racinaea adscendens, Tillandsia balbisiana, T. belloensis, T. brachycaulos, T. compressa, T. dugesii, T. foliosa, T. flavobracteata, T. limbata, T. maritima, T. ortgiesiana, T. paucifolia, T. pseudobaileyi, T. rettigiana, T. utriculata, T. x marceloi, Werauhia pycnantha, and W. nutans are recorded for the first time from Oaxaca. Collections from 226 (of 570) municipalities and all 30 districts of the state were studied. Among the vegetation types occurring in Oaxaca, oak forest is the richest with 83 taxa, followed by tropical deciduous forest with 74, and cloud forest with 73 species.