Tesi Gianguzzi G. DEFINITIVA.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Road Map for Developing & Strengthening The
KENYA ROAD MAP FOR DEVELOPING & STRENGTHENING THE PROCESSED MANGO SECTOR DECEMBER 2014 TRADE IMPACT FOR GOOD The designations employed and the presentation of material in this document do not imply the expression of any opinion whatsoever on the part of the International Trade Centre concerning the legal status of any country, territory, city or area or of its authorities, or concerning the delimitation of its frontiers or boundaries. This document has not formally been edited by the International Trade Centre. ROAD MAP FOR DEVELOPING & STRENGTHENING THE KENYAN PROCESSED MANGO SECTOR Prepared for International Trade Centre Geneva, december 2014 ii This value chain roadmap was developed on the basis of technical assistance of the International Trade Centre ( ITC ). Views expressed herein are those of consultants and do not necessarily coincide with those of ITC, UN or WTO. Mention of firms, products and product brands does not imply the endorsement of ITC. This document has not been formally edited my ITC. The International Trade Centre ( ITC ) is the joint agency of the World Trade Organisation and the United Nations. Digital images on cover : © shutterstock Street address : ITC, 54-56, rue de Montbrillant, 1202 Geneva, Switzerland Postal address : ITC Palais des Nations 1211 Geneva, Switzerland Telephone : + 41- 22 730 0111 Postal address : ITC, Palais des Nations, 1211 Geneva, Switzerland Email : [email protected] Internet : http :// www.intracen.org iii ACRONYMS AND ABBREVIATIONS Unless otherwise specified, all references to dollars ( $ ) are to United States dollars, and all references to tons are to metric tons. The following abbreviations are used : AIJN European Fruit Juice Association BRC British Retail Consortium CPB Community Business Plan DC Developing countries EFTA European Free Trade Association EPC Export Promotion Council EU European Union FPEAK Fresh Produce Exporters Association of Kenya FT Fairtrade G.A.P. -

Mango Fruit Quality Improvements in Response to Water Stress: Implications for Adaptation Under Environmental Constraints
Horticultural Science (Prague), 48, 2021 (1): 1–11 Original Paper https://doi.org/10.17221/45/2020-HORTSCI Mango fruit quality improvements in response to water stress: implications for adaptation under environmental constraints Víctor Hugo Durán Zuazo1*, Dionisio Franco Tarifa2, Belén Cárceles Rodríguez1, Baltasar Gálvez Ruiz1, Pedro Cermeño Sacristán3, Simón Cuadros Tavira4, Iván Francisco García-Tejero3 1IFAPA Centro “Camino de Purchil”, Granada, Spain 2Auntamiento de Almuñécar, Almuñécar, Spain 3IFAPA Centro “Las Torres”, Sevilla, Spain 4Departemento de Ingeniería Forestal, Universidad de Córdoba, Córdoba, Spain *Corresponding author: [email protected] Citation: Durán Zuazo V.H., Franco T.D., Cárceles R.B., Gálvez R.B., Cermeño S.P., Cuadros T.S., García T.I.F. (2021): Mango fruit quality improvements in response to water stress: implications for adaptation under environmental con- straints. Hort. Sci. (Prague), 48: 1–11. Abstract: Mediterranean farming is facing increasing periods of water shortage and, in the coming decades, the water reduction is expected to exert the most adverse impact upon growth and productivity. This study was performed to assess the response of the physico-biochemical quality parameters of mango fruits to different doses of irrigation in a Mediterranean subtropical area in Spain. During two-monitoring seasons, trees were subjected to deficit-irrigation strategies receiving 33, 50, and 75% of a crop evapotranspiration (ETC), and a control at 100% ETC. According to the findings and respect to control, the yield was reduced in 8, 11, and 20% for the water-stressed trees at 75, 50, and 33% ETC, respectively, producing smaller fruits in line with the amount of applied irrigation. -

Diversity of a Large Collection of Natural Populations of Mango (Mangifera Indica Linn.) Revealed by Agro-Morphological and Quality Traits
diversity Article Diversity of a Large Collection of Natural Populations of Mango (Mangifera indica Linn.) Revealed by Agro-Morphological and Quality Traits Cuixian Zhang y, Dehong Xie y, Tianqi Bai, Xinping Luo, Faming Zhang, Zhangguang Ni * and Yufu Chen * Institute of Tropical and Subtropical Cash Crops, Yunnan Academy of Agricultural Sciences, Baoshan 678000, China; [email protected] (C.Z.); [email protected] (D.X.); [email protected] (T.B.); [email protected] (X.L.); [email protected] (F.Z.) * Correspondence: [email protected] (Z.N.); [email protected] or [email protected] (Y.C.) These authors contributed equally to this work. y Received: 11 December 2019; Accepted: 3 January 2020; Published: 11 January 2020 Abstract: Collection, characterization and utilization of genetic resources are crucial for developing varieties to meet current and future needs. Although mango is an economically important fruit tree, its genetic resources are still undocumented and are threatened in their natural habits. In this study, the variability of 452 mango accessions from three regions in China (Nujiang, Lancang river and Honghe) was assessed using 41 descriptors including qualitative and quantitative traits, with the aim to identify mango accessions with excellent agronomic and quality traits. To this end, descriptive and multivariate analyses were performed. Based on Shannon–Weaver diversity index, qualitative traits including pericarp color, fruit aroma, flesh color, and fruit flavor recorded the highest variability in the germplasm. Fruit related traits including pulp weight, peel weight, and fruit weight were the most diverse traits in the germplasm with a high coefficient of variation (CV > 40%). Significant differences (MANOVA test, p < 0.000) were observed among the three regions for most of the quantitative traits. -

Tree-Ripe Mango Fruit: Physicochemical Characterization, Antioxidant Properties and Sensory Profile of Six Mediterranean-Grown Cultivars
agronomy Article Tree-Ripe Mango Fruit: Physicochemical Characterization, Antioxidant Properties and Sensory Profile of Six Mediterranean-Grown Cultivars Vittorio Farina 1 , Carla Gentile 2 , Giuseppe Sortino 1,* , Giuseppe Gianguzzi 1 , Eristanna Palazzolo 1 and Agata Mazzaglia 3 1 Department of Agricultural, Food and Forest Sciences (SAAF), Università degli Studi di Palermo, edificio 4, 90128 Palermo, Italy; [email protected] (V.F.); [email protected] (G.G.); [email protected] (E.P.) 2 Department of Biological, Chemical and Pharmaceutical Sciences and Technologies (STEBICEF), University of Palermo, Viale delle Scienze, 90128 Palermo, Italy; [email protected] 3 Department of Agricultural, Food and Environmental, Università degli Studi di Catania, via S. Sofia, 98-95123 Catania, Italy; [email protected] * Correspondence: [email protected]; Tel.: +39-091123861234 Received: 31 May 2020; Accepted: 18 June 2020; Published: 19 June 2020 Abstract: Some of the key components that contribute to the acceptance of high-quality fresh mangoes by consumers are its flavour, odour, texture and chemical constituents that depend mainly on level of maturity. In the European market, the demand for tree-ripened fruit has increased in recent decades. Nevertheless, the qualitative response and the marketable characteristics of tree-ripened mango fruit grown in the Mediterranean area are not yet studied. Tree-ripened fruits of cv Keitt, Glenn, Osteen, Maya, Kensington Pride and Tommy Atkins were submitted to analytical (fruit weight, transversal diameter, longitudinal diameter, flesh firmness, total soluble solid content, titratable acidity, seed weight, peel weight, percentage of flesh and fibre, ash content, fat content, carbohydrate content, riboflavin, niacin, thiamin, K, Na, Ca, Mg, Fe, Cu, Mn and Zn contents, ascorbic acid and vitamin A) and sensory evaluations. -

Changes in the Sensory Characteristics of Mango Cultivars During the Production of Mango Purée and Sorbet
DIFFERENCES IN SENSORY CHARACTERISTICS AMONG VARIOUS MANGO CULTIVARS IN THE FORM OF FRESH SLICED MANGO, MANGO PURÉE, AND MANGO SORBET by CHRISTIE N. LEDEKER B.S., University of Delaware, 2008 A THESIS submitted in partial fulfillment of the requirements for the degree MASTER OF SCIENCE Interdisciplinary Food Science Graduate Program Department of Human Nutrition KANSAS STATE UNIVERSITY Manhattan, Kansas 2011 Approved by: Major Professor Dr. Delores H. Chambers Abstract Fresh mangoes are highly perishable, and therefore, they are often processed to extend shelf-life and facilitate exportation. Studying the transformation that mango cultivars undergo throughout processing can aid in selecting appropriate varieties for products. In the 1st part of this study, the flavor and texture properties of 4 mango cultivars available in the United States (U.S.) were analyzed. Highly trained descriptive panelists in the U.S. evaluated fresh, purée, and sorbet samples prepared from each cultivar. Purées were made by pulverizing mango flesh, passing it through a china cap, and heating it to 85 °C for 15 s. For the sorbets, purées were diluted with water (1:1), sucrose was added, and the bases were frozen in a batch ice cream freezer. Much of the texture variation among cultivars was lost after fresh samples were transformed into purées, whereas much of the flavor and texture variation among cultivars was lost once fresh mangoes and mango purées were transformed into sorbets. Compared to the other cultivars, Haden and Tommy Atkins underwent greater transformations in flavor throughout sorbet preparation, and processing reduced the intensities of some unpleasant flavors in these cultivars. -

A New Approach for Analyzing and Interpreting Data on Fruit Drop In
HORTSCIENCE 49(12):1498–1505. 2014. of the physiological fruit drop’’ when fruits have attained 10% or 30% of final fruit size, respectively. The premature fruit drop stages A New Approach for Analyzing and have been named invariably and there is also no common agreement on the number of drop Interpreting Data on Fruit Drop stages as well as the onset and duration of each. Dahshan and Habib (1985) originally in Mango described three distinct stages of premature fruit drop of mango and this classification was Michael H. Hagemann1, Malte G. Roemer, Julian Kofler, also used in the review of Singh et al. (2005). Martin Hegele, and Jens N. Wunsche€ The first stage is referred to as ‘‘post-setting Section of Crop Physiology of Specialty Crops, University of Hohenheim, drop’’ and ceases 60 d after ‘‘fruit set’’ (BBCH-scale 619). The second stage is Emil-Wolff-Str. 25, 70599 Stuttgart, Germany termed ‘‘mid-season drop,’’ characterized by Additional index words. fruit retention, intercropping, irrigation, Mangifera indica, plant a duration of 15 d with lesser intensity than growth regulator during the ‘‘post-setting drop.’’ The third stage is the ‘‘pre-harvest drop’’ with only moderate Abstract. Mango yields are frequently reduced by premature fruit drop, induced by plant losses. stresses during the fruit set period in response to unsuitable climatic or crop management These descriptions of premature fruit drop, conditions. There are varying strategies for assessing premature fruit drop, which render commonly found in the literature, represent the comparison and interpretation of published data difficult to draw general conclu- some considerable limitations. -

Central Permitting Weekly Permits for 2/9/2020 to 2/15/2020
PASCO COUNTY, FLORIDA PERMITS ISSUED SINCE LAST RUN Page 1 of 97 CENTRAL PERMITTING SYSTEM (B42531) 2/9/2020 to 2/15/2020 RUN DATE: 2/17/2020 Totals 528 48,611,386.57 Totals 1 1,127,701.00 Permit # Issue Date Type of Work Issued From Total SF Living SF Stories Valuation 17B16875 02/11/2020 IIIB-Unprotected Combustible: 2 BCCCPW 13600 1,127,701.00 Hr. Exterior Walls, No fire resistance for structural frame, floors, ceilings, or roofs. JOB LOCATION: 10368 CHARLES BO HARRISON WAY SUBDIVISION: PARCEL NUMBER: 15 25 18 0000 00300 0000 OWNER: PASCO COUNTY ADDRESS: 7220 OSTEEN RD CITY: NEW PORT RICHEY ZIP: 34653 PHONE: CONTRACTOR: DILLON MGNGMENT ENTRP INC ADDRESS: 12212 SILK O CITY: HUDSON ZIP: 34667 PHONE: 0000000000 A01 Totals 108 37,946,854.00 A01 Permit # Issue Date Type of Work Issued From Total SF Living SF Stories Valuation 19B15306 02/14/2020 Block and Frame 4845 2 Floors or Less 557,175.00 JOB LOCATION: 12423 GULF PINE SPUR SUBDIVISION: PARCEL NUMBER: 16 26 17 0010 00200 0060 OWNER: HOMES BY WEST BAY LLC ADDRESS: 4065 CRESCENT PARK DR CITY: RIVERVIEW ZIP: 33578 PHONE: CONTRACTOR: HOMES BY WEST BAY LLC ADDRESS: 4065 Crescen CITY: Riverview ZIP: 33578 PHONE: A01 Permit # Issue Date Type of Work Issued From Total SF Living SF Stories Valuation 19B20152 02/11/2020 Block and Frame 2928 2 Floors or Less 380,640.00 JOB LOCATION: 2467 WHITTLER BRANCH SUBDIVISION: PARCEL NUMBER: 27 26 17 0130 01800 0040 OWNER: HOMES BY WEST BAY LLC ADDRESS: 4065 CRESCENT PARK DR CITY: RIVERVIEW ZIP: 33578 PHONE: CONTRACTOR: HOMES BY WEST BAY LLC ADDRESS: 4065 -
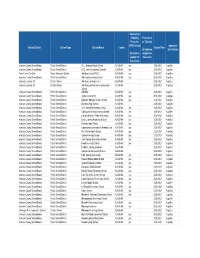
NSLP Schools Aug- Dec 2020
Community Eligibility Provision 2 Provision or 3 School (CEP) School Approved School District School Type School Name County School Year All children Time Period All children eligible for eligible for free lunch free lunch Alachua County School Board Public School District A. L. Mebane Middle School ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District A.Q. Jones Exceptional Student ALACHUA yes 2020-2021 Aug-Dec Pace Center For Girls Private Non-profit School Alachua County PACE ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Alachua Elementary School ALACHUA yes 2020-2021 Aug-Dec Alachua Learning Ctr. Charter School Alachua Learning Center ALACHUA 2020-2021 Aug-Dec Alachua Learning Ctr. Charter School Alachua Learning Center Elementary ALACHUA 2020-2021 Aug-Dec School Alachua County School Board Public School District AMI Kids ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Archer Community ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Boulware Springs Charter School ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Buchholz High School ALACHUA 2020-2021 Aug-Dec Alachua County School Board Public School District C.W. Norton Elementary School ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Caring and Sharing Learning School ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Carolyn Beatrice Parker Elementary ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Early Learning Academy at Duval ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Eastside High School ALACHUA yes 2020-2021 Aug-Dec Alachua County School Board Public School District Expressions Learning Arts Academy, Inc. -

Mangifera Indica CV. 'Nam Dok Mai Si Thong'
E3S Web of Conferences 187, 04006 (2020) https://doi.org/10.1051/e3sconf /202018704006 TSAE 2020 Overall precision test of near infrared spectroscopy on mango fruits (Mangifera indica CV. ‘Nam Dok Mai Si Thong’) by on-line and off-line systems Wachiraya Lekhawattana1*, and Panmanas Sirisomboon2 1King Mongkut’s Institute of Technology Ladkrabang, Department of Agricultural Engineering, Faculty of Engineering, Bangkok, Thailand. 2King Mongkut’s Institute of Technology Ladkrabang, NIR Spectroscopy Research Center for Agricultural Products and Foods, Department of Agricultural Engineering, Faculty of Engineering, Bangkok, Thailand. Abstract. The near infrared (NIR) spectroscopy both on-line and off-line scanning was applied on mango fruits (Mangifera indica CV. ‘Nam dok mai- si Thong’) for the overall precision test. The reference parameter was total soluble solids content (Brix value). The results showed that the off-line scanning had a higher accuracy than on-line scanning. The scanning repeatability of the off-line and on-line systems were 0.00199 and 0.00993, respectively. The scanning reproducibility of the off-line and online systems were 0.00279 and 0.00513, respectively. The reference of measurement ͦ repeatability was 0.2. The maximum coefficient of determination (R ΛΏΦ) of the reference measurement was 0.894. 1 Introduction Mango is an important economic crop, which can generate income for farmers in Thailand because of consumption demand in both domestic and international markets. According to the statistics of mangoes exports in 2017, The total production throughout was 2.017 million tons [2]. The most exported mango species include nam dok mai, Khiao Sawiei, Hnuk Klangwan, Chok Anan, Rad and Aok Rong, respectively. -
![Variability in Fruit Characteristics of Chokanan Mango (Mangifera Indica L.) [Kepelbagaian Ciri-Ciri Buah Mangga Chokanan (Mangifera Indica L.)]](https://docslib.b-cdn.net/cover/0669/variability-in-fruit-characteristics-of-chokanan-mango-mangifera-indica-l-kepelbagaian-ciri-ciri-buah-mangga-chokanan-mangifera-indica-l-1130669.webp)
Variability in Fruit Characteristics of Chokanan Mango (Mangifera Indica L.) [Kepelbagaian Ciri-Ciri Buah Mangga Chokanan (Mangifera Indica L.)]
J. Trop. Agric. and Fd. Sc. 46(1)(2018): 55 – 63 F. Abdullah Variability in fruit characteristics of Chokanan mango (Mangifera indica L.) [Kepelbagaian ciri-ciri buah mangga Chokanan (Mangifera indica L.)] F. Abdullah1 1Director General’s Office, MARDI Arau, Lot PT 3747, Jalan Tambun Tulang, 02600 Arau, Perlis, Malaysia Abstract This study was conducted with the aim to evaluate the characteristics of Chokanan mango at harvest. The Chokanan fruits were harvested from selected trees in commercial mango plot at Sintok MARDI Research Station, Kedah, Malaysia. Data on the fruit characteristics such as weight, length (L), width (W), thickness (T) and total soluble solid (TSS, °Brix) were measured and recorded for 13 weeks. The results revealed high significant differences (p <0.001) in terms of recorded weight, W, L, T, size (W x L x T) and TSS of the Chokanan fruits among the selected trees. The mean value of the fruits weight at harvest ranged from 120 to 380 g and TSS ranged from 14.5 ºBrix to 22.8 ºBrix. In the present study, the distribution of fruits weight was skewed to the left indicating larger percentage of smaller fruits, but normal distribution was recorded for the TSS. Apart from that, high significant correlation (R2 >0.80) was found in the weight and size, L, W and T of the fruits. However, the weight and size of Chokanan were inversely correlated with TSS. The coefficient of variation (cv) differed among the harvested trees with the highest were recorded on weight and size of fruits (cv = 9.5 and 11.4, respectively). -

Non-Destructive Assessment of Quality and Maturity of Mangoes Based on Image Analysis
MSc. Thesis (MSCV) Department of Applied Computer Science University of Bourgogne Non-destructive assessment of quality and maturity of mangoes based on image analysis Kumar Ankush A Thesis submitted in July 2020 for the Degree of MSc in Computer Vision (VIBOT/MSCV) Master thesis supervised by Dr. Emile Faye and Dr. Julien Sarron of the UPR HortSys of CIRAD. Abstract Quality and maturity estimation of mangoes are important for the organization of harvesting date and post-harvest conservation. Although extensive fruit quality estimations exist, they are mostly destructive in nature and available tools for non-destructive estimation are limited. Maturity estimation rely on visual inspection of the fruit, in-hand feel or destructive measure- ment based on quality assessment. Thus, non-destructive tools for an accurate estimation of the quality and the maturity of the fruit have yet to be developed, especially for smallhold- ers. The aim of this study was to develop a tool for non-destructive assessment of quality and maturity of mangoes based on image analysis. This experiment studied 1040 lateral RGB images of 520 mangoes of di↵erent stages of maturity and harvested in two orchards in West Africa. Upon performing digital image segmentation on the images of mangoes, six image fea- tures were calculated with the use of digital image processing functions in MATLAB and four destructive features were taken in consideration. Then, correlations between destructive and non-destructive features of mangoes were explored. No research is ever quite complete. It is the glory of a good bit of work that it opens the way for something still better, and this repeatedly leads to its own eclipse.. -

The 'Tommy Atkins' Mango Genome Reveals Candidate Genes for Fruit
Bally et al. BMC Plant Biology (2021) 21:108 https://doi.org/10.1186/s12870-021-02858-1 RESEARCH ARTICLE Open Access The ‘Tommy Atkins’ mango genome reveals candidate genes for fruit quality Mango Genome Consortium, Ian S. E. Bally1, Aureliano Bombarely2,3, Alan H. Chambers4* , Yuval Cohen5, Natalie L. Dillon1, David J. Innes6, María A. Islas-Osuna7, David N. Kuhn8, Lukas A. Mueller9, Ron Ophir5, Aditi Rambani9, Amir Sherman5 and Haidong Yan3 Abstract Background: Mango, Mangifera indica L., an important tropical fruit crop, is grown for its sweet and aromatic fruits. Past improvement of this species has predominantly relied on chance seedlings derived from over 1000 cultivars in the Indian sub-continent with a large variation for fruit size, yield, biotic and abiotic stress resistance, and fruit quality among other traits. Historically, mango has been an orphan crop with very limited molecular information. Only recently have molecular and genomics-based analyses enabled the creation of linkage maps, transcriptomes, and diversity analysis of large collections. Additionally, the combined analysis of genomic and phenotypic information is poised to improve mango breeding efficiency. Results: This study sequenced, de novo assembled, analyzed, and annotated the genome of the monoembryonic mango cultivar ‘Tommy Atkins’. The draft genome sequence was generated using NRGene de-novo Magic on high molecular weight DNA of ‘Tommy Atkins’, supplemented by 10X Genomics long read sequencing to improve the initial assembly. A hybrid population between ‘Tommy Atkins’ x ‘Kensington Pride’ was used to generate phased haplotype chromosomes and a highly resolved phased SNP map. The final ‘Tommy Atkins’ genome assembly was a consensus sequence that included 20 pseudomolecules representing the 20 chromosomes of mango and included ~ 86% of the ~ 439 Mb haploid mango genome.