Chapitre I. Etude De L'efficacite De La Peche Electrique
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

FAMILY Loricariidae Rafinesque, 1815
FAMILY Loricariidae Rafinesque, 1815 - suckermouth armored catfishes SUBFAMILY Lithogeninae Gosline, 1947 - suckermoth armored catfishes GENUS Lithogenes Eigenmann, 1909 - suckermouth armored catfishes Species Lithogenes valencia Provenzano et al., 2003 - Valencia suckermouth armored catfish Species Lithogenes villosus Eigenmann, 1909 - Potaro suckermouth armored catfish Species Lithogenes wahari Schaefer & Provenzano, 2008 - Cuao suckermouth armored catfish SUBFAMILY Delturinae Armbruster et al., 2006 - armored catfishes GENUS Delturus Eigenmann & Eigenmann, 1889 - armored catfishes [=Carinotus] Species Delturus angulicauda (Steindachner, 1877) - Mucuri armored catfish Species Delturus brevis Reis & Pereira, in Reis et al., 2006 - Aracuai armored catfish Species Delturus carinotus (La Monte, 1933) - Doce armored catfish Species Delturus parahybae Eigenmann & Eigenmann, 1889 - Parahyba armored catfish GENUS Hemipsilichthys Eigenmann & Eigenmann, 1889 - wide-mouthed catfishes [=Upsilodus, Xenomystus] Species Hemipsilichthys gobio (Lütken, 1874) - Parahyba wide-mouthed catfish [=victori] Species Hemipsilichthys nimius Pereira, 2003 - Pereque-Acu wide-mouthed catfish Species Hemipsilichthys papillatus Pereira et al., 2000 - Paraiba wide-mouthed catfish SUBFAMILY Rhinelepinae Armbruster, 2004 - suckermouth catfishes GENUS Pogonopoma Regan, 1904 - suckermouth armored catfishes, sucker catfishes [=Pogonopomoides] Species Pogonopoma obscurum Quevedo & Reis, 2002 - Canoas sucker catfish Species Pogonopoma parahybae (Steindachner, 1877) - Parahyba -

Systematic Index 881 SYSTEMATIC INDEX
systematic index 881 SYSTEMATIC INDEX Acanthodoras 28, 41, 544, 546-548 Anchoviella sp. 20, 152, 153, 158, 159 Acanthodoras cataphractus 28, 41, 544, 546-548 Ancistrinae 412, 438 ACESTRORHYNCHIDAE 24, 130, 168, 334-337 ANCISTRINI 412, 438 Acestrorhynchus 24, 72, 82, 84, 334-337 Ancistrus 438, 442-449 Acestrorhynchus falcatus 24, 334-336 Ancistrus aff. hoplogenys 26, 443-446 Acestrorhynchus guianensis 336 Ancistrus gr. leucostictus 26, 443, 446, 447 Acestrorhynchus microlepis 24, 82, 84, 334, 336, Ancistrus sp. ‘reticulate’ 26, 443, 446, 447 337 Ancistrus temminckii 26, 443, 448, 449 ACHIRIDAE 33, 77, 123, 794-799 Anostomidae 21, 33, 50, 131, 168, 184-201, 202 Achirus 4, 33, 794, 796, 797 Anostomus 131, 184, 185, 188-191 Achirus achirus 4, 33, 794, 796, 797 Anostomus anostomus 21, 185, 188, 189 Achirus declivis 33, 794, 796 Anostomus brevior 21, 185, 188, 189 Achirus lineatus 796 Anostomus ternetzi 21, 117, 185, 188-191 Acipenser 5 Aphyocharacidium melandetum 22, 232, 236, 237 Acnodon 23, 48, 288-292 APHYOCHARACINAE 23, 132, 304, 305 Acnodon oligacanthus 23, 48, 289-292 Aphyocharax erythrurus 23, 132, 304, 305 ACTINOPTERYGII 8 Apionichthys dumerili 33, 794, 796-798 Adontosternarchus 602 Apistogramma 720, 723, 728-731, 756 Aequidens 31, 724, 726-729, 750, 752 Apistogramma ortmanni 31, 723, 728-730 Aequidens geayi 750 Apistogramma steindachneri 31, 41, 69, 79, 723, Aequidens paloemeuensis 31, 724, 726, 727 730, 731 Aequidens potaroensis 726 apteronotidae 29, 124, 602-607 Aequidens tetramerus 31, 724, 728, 729 Apteronotus albifrons 4, 29, -

Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 Version Available for Download From
Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 version Available for download from http://www.ramsar.org/ris/key_ris_index.htm. Categories approved by Recommendation 4.7 (1990), as amended by Resolution VIII.13 of the 8th Conference of the Contracting Parties (2002) and Resolutions IX.1 Annex B, IX.6, IX.21 and IX. 22 of the 9th Conference of the Contracting Parties (2005). Notes for compilers: 1. The RIS should be completed in accordance with the attached Explanatory Notes and Guidelines for completing the Information Sheet on Ramsar Wetlands. Compilers are strongly advised to read this guidance before filling in the RIS. 2. Further information and guidance in support of Ramsar site designations are provided in the Strategic Framework and guidelines for the future development of the List of Wetlands of International Importance (Ramsar Wise Use Handbook 14, 3rd edition). A 4th edition of the Handbook is in preparation and will be available in 2009. 3. Once completed, the RIS (and accompanying map(s)) should be submitted to the Ramsar Secretariat. Compilers should provide an electronic (MS Word) copy of the RIS and, where possible, digital copies of all maps. 1. Name and address of the compiler of this form: FOR OFFICE USE ONLY. DD MM YY Beatriz de Aquino Ribeiro - Bióloga - Analista Ambiental / [email protected], (95) Designation date Site Reference Number 99136-0940. Antonio Lisboa - Geógrafo - MSc. Biogeografia - Analista Ambiental / [email protected], (95) 99137-1192. Instituto Chico Mendes de Conservação da Biodiversidade - ICMBio Rua Alfredo Cruz, 283, Centro, Boa Vista -RR. CEP: 69.301-140 2. -

A Rapid Biological Assessment of the Upper Palumeu River Watershed (Grensgebergte and Kasikasima) of Southeastern Suriname
Rapid Assessment Program A Rapid Biological Assessment of the Upper Palumeu River Watershed (Grensgebergte and Kasikasima) of Southeastern Suriname Editors: Leeanne E. Alonso and Trond H. Larsen 67 CONSERVATION INTERNATIONAL - SURINAME CONSERVATION INTERNATIONAL GLOBAL WILDLIFE CONSERVATION ANTON DE KOM UNIVERSITY OF SURINAME THE SURINAME FOREST SERVICE (LBB) NATURE CONSERVATION DIVISION (NB) FOUNDATION FOR FOREST MANAGEMENT AND PRODUCTION CONTROL (SBB) SURINAME CONSERVATION FOUNDATION THE HARBERS FAMILY FOUNDATION Rapid Assessment Program A Rapid Biological Assessment of the Upper Palumeu River Watershed RAP (Grensgebergte and Kasikasima) of Southeastern Suriname Bulletin of Biological Assessment 67 Editors: Leeanne E. Alonso and Trond H. Larsen CONSERVATION INTERNATIONAL - SURINAME CONSERVATION INTERNATIONAL GLOBAL WILDLIFE CONSERVATION ANTON DE KOM UNIVERSITY OF SURINAME THE SURINAME FOREST SERVICE (LBB) NATURE CONSERVATION DIVISION (NB) FOUNDATION FOR FOREST MANAGEMENT AND PRODUCTION CONTROL (SBB) SURINAME CONSERVATION FOUNDATION THE HARBERS FAMILY FOUNDATION The RAP Bulletin of Biological Assessment is published by: Conservation International 2011 Crystal Drive, Suite 500 Arlington, VA USA 22202 Tel : +1 703-341-2400 www.conservation.org Cover photos: The RAP team surveyed the Grensgebergte Mountains and Upper Palumeu Watershed, as well as the Middle Palumeu River and Kasikasima Mountains visible here. Freshwater resources originating here are vital for all of Suriname. (T. Larsen) Glass frogs (Hyalinobatrachium cf. taylori) lay their -
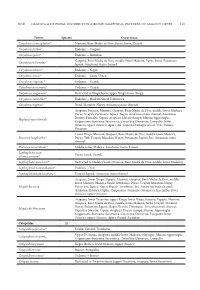
DAGOSTA & DE PINNA: DISTRIBUTION & BIOGEOGRAPHICAL PATTERNS of AMAZON FISHES Taxon Species Occurrence Corydoras Stenocep
2019 DAGOSTA & DE PINNA: DISTRIBUTION & BIOGEOGRAPHICAL PATTERNS OF AMAZON FISHES 113 Taxon Species Occurrence Corydoras stenocephalus* Mamoré, Beni-Madre de Dios, Purus, Juruá, Ucayali Corydoras sterbai* Endemic – Guaporé Corydoras sychri* Endemic – Marañon Guaporé, Beni-Madre de Dios, middle-lower Madeira, Purus, Juruá, Putumayo, Corydoras trilineatus* Japurá, Amazonas main channel Corydoras tukano* Endemic – Negro Corydoras urucu* Endemic – Coari-Urucu Corydoras virginiae* Endemic – Ucayali Corydoras weitzmani* Endemic – Ucayali Corydoras xinguensis* Restricted to Xingu basin (upper Xingu, lower Xingu) Corydoras zawadzkii* Endemic – Madeira Shield Tributaries Corydoras zygatus* Juruá, Marañon-Nanay, Amazonas main channel Araguaia, Juruena, Mamoré, Guaporé, Beni-Madre de Dios, middle-lower Madeira, Purus, Ucayali, Putumayo, Japurá, Negro, Amazonas main channel, Amazonas Estuary, Parnaíba, Capim, Araguari-Macari-Amapá, Maroni-Approuague, Hoplosternum littorale Coppename-Suriname-Saramacca, Corentyne-Demerara, Essequibo, lower Orinoco, upper Orinoco, Apure, Atl. Coastal Drainages of Col. Ven., Paraná- Paraguay Lower Xingu, Mamoré, Guaporé, Beni-Madre de Dios, middle-lower Madeira, Dianema longibarbis* Purus, Tefé, Ucayali, Marañon-Nanay, Putumayo, Japurá, Jari, Amazonas main channel Dianema urostriatum* Middle-lower Madeira, Amazonas main channel Lepthoplosternum Purus, Juruá, Ucayali altamazonicum* Lepthoplosternum beni* Restricted to Madeira basin (Mamoré, Beni-Madre de Dios, middle-lower Madeira) Lepthoplosternum stellatum* Endemic -

Redalyc.Checklist of the Freshwater Fishes of Colombia
Biota Colombiana ISSN: 0124-5376 [email protected] Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Colombia Maldonado-Ocampo, Javier A.; Vari, Richard P.; Saulo Usma, José Checklist of the Freshwater Fishes of Colombia Biota Colombiana, vol. 9, núm. 2, 2008, pp. 143-237 Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Bogotá, Colombia Available in: http://www.redalyc.org/articulo.oa?id=49120960001 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Biota Colombiana 9 (2) 143 - 237, 2008 Checklist of the Freshwater Fishes of Colombia Javier A. Maldonado-Ocampo1; Richard P. Vari2; José Saulo Usma3 1 Investigador Asociado, curador encargado colección de peces de agua dulce, Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Claustro de San Agustín, Villa de Leyva, Boyacá, Colombia. Dirección actual: Universidade Federal do Rio de Janeiro, Museu Nacional, Departamento de Vertebrados, Quinta da Boa Vista, 20940- 040 Rio de Janeiro, RJ, Brasil. [email protected] 2 Division of Fishes, Department of Vertebrate Zoology, MRC--159, National Museum of Natural History, PO Box 37012, Smithsonian Institution, Washington, D.C. 20013—7012. [email protected] 3 Coordinador Programa Ecosistemas de Agua Dulce WWF Colombia. Calle 61 No 3 A 26, Bogotá D.C., Colombia. [email protected] Abstract Data derived from the literature supplemented by examination of specimens in collections show that 1435 species of native fishes live in the freshwaters of Colombia. -

Biological Inventories P Rapid
biological R Rapid Biological Inventories apid Biological Inventories rapid inventories 11 Instituciones Participantes / Participating Institutions :11 The Field Museum Perú: Yavarí Centro de Conservación, Investigación y Manejo de Perú: Yavarí Áreas Naturales (CIMA–Cordillera Azul) Wildlife Conservation Society–Peru Durrell Institute of Conservation and Ecology Rainforest Conservation Fund Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos Financiado por / Partial funding by Gordon and Betty Moore Foundation The Field Museum Environmental & Conservation Programs 1400 South Lake Shore Drive Chicago, Illinois 60605-2496, USA T 312.665.7430 F 312.665.7433 www.fieldmuseum.org/rbi THE FIELD MUSEUM PERÚ: Yavarí fig.2 La planicie aluvial del Yavarí es un rico mosaico de bosques inundados y pantanos. Las comunidades de árboles de la reserva propuesta (línea punteada en blanco) se encuentran entre las más diversas del planeta. En esta imagen compuesta de satélite (1999/2001) resaltamos la Reserva Comunal Tamshiyacu-Tahuayo (línea punteada en gris) junto con los ríos y pueblos cercanos a los sitios del inventario biológico rápido. The Yavarí floodplain is a rich mosaic of flooded forest and swamps. Tree communities of the proposed reserve (dotted white line) are among the most diverse on the planet. In this composite satellite image of 1999/2001 we highlight the Reserva Comunal Tamshiyacu-Tahuayo (dotted grey line) along with the rivers and towns close to the rapid inventory sites. Iquitos río Manití río Orosa río Esperanza -

Copyrighted Material
Trim Size: 6.125in x 9.25ink Nelson bindex.tex V2 - 03/02/2016 12:09 A.M. Page 651 Index k Aaptosyax, 183 Acanthocleithron, 227 acanthopterygian, 280 k Abactochromis, 344 Acanthoclininae, 336 Acanthopterygii, 264, 265, Abadzekhia, 415 Acanthoclinus, 336, 337 279, 280, 284, 286, Abalistes, 523 Acanthocobitis, 192 302, 303, 353 abas, 160 Acanthocybium, 417 Acanthorhina,51 Abisaadia, 139 Acanthodes, 97, 100, 101 Acanthoscyllium,62 Abisaadichthys, 132 acanthodians, 43, 44, 96 Acanthosphex, 473 Ablabys, 471 ACANTHODIDAE, 101 Acanthostega, 111 Ablennes, 368 ACANTHODIFORMES, 97, Acanthostracion, 522 Aboma, 332 100 ACANTHOTHORACI- Aborichthys, 192 Acanthodii, 36, 40, 95, FORMES, 37 Abramis, 184 96, 98 Acanthuridae, 499, 500, 501 Abramites, 200 Acanthodopsis, 101 ACANTHURIFORMES, 420, Abudefduf, 339 Acanthodoras, 234 430, 452, 495, 497 Abyssoberyx, 310 Acanthodraco, 466 Acanthurinae, 502 Abyssobrotula, 318 Acanthogobius, 330 Acanthurini, 502 Abyssocottinae, 485, 492 Acantholabrus, 428 Acanthuroidei, 453, 462, Abyssocottus, 492 Acantholingua, 247 COPYRIGHTED MATERIAL496, 497, 498, 499 Acanthanectes, 347 Acantholiparis, 495 Acanthaphritis, 425 Acantholumpenus, 480 Acanthurus, 502 Acantharchus, 444, Acanthomorpha, 276, 278, Acantopsis, 190 445, 446 279, 280, 307 Acarobythites, 319 Acanthemblemaria, 351 acanthomorphs, 278 Acaronia, 344 Acanthistius, 446, 447 Acanthonus, 318 Acentrogobius, 332 Acanthobrama, 184 Acanthopagrus, 506 Acentronichthys, 236 Acanthobunocephalus, 233 Acanthophthalmus, 190 Acentronura, 408 Acanthocepola, 461 Acanthoplesiops, -
Checklist of the Ichthyofauna of the Rio Negro Basin in the Brazilian Amazon
A peer-reviewed open-access journal ZooKeys 881: 53–89Checklist (2019) of the ichthyofauna of the Rio Negro basin in the Brazilian Amazon 53 doi: 10.3897/zookeys.881.32055 CHECKLIST http://zookeys.pensoft.net Launched to accelerate biodiversity research Checklist of the ichthyofauna of the Rio Negro basin in the Brazilian Amazon Hélio Beltrão1, Jansen Zuanon2, Efrem Ferreira2 1 Universidade Federal do Amazonas – UFAM; Pós-Graduação em Ciências Pesqueiras nos Trópicos PPG- CIPET; Av. Rodrigo Otávio Jordão Ramos, 6200, Coroado I, Manaus-AM, Brazil 2 Instituto Nacional de Pesquisas da Amazônia – INPA; Coordenação de Biodiversidade; Av. André Araújo, 2936, Caixa Postal 478, CEP 69067-375, Manaus, Amazonas, Brazil Corresponding author: Hélio Beltrão ([email protected]) Academic editor: M. E. Bichuette | Received 30 November 2018 | Accepted 2 September 2019 | Published 17 October 2019 http://zoobank.org/B45BD285-2BD4-45FD-80C1-4B3B23F60AEA Citation: Beltrão H, Zuanon J, Ferreira E (2019) Checklist of the ichthyofauna of the Rio Negro basin in the Brazilian Amazon. ZooKeys 881: 53–89. https://doi.org/10.3897/zookeys.881.32055 Abstract This study presents an extensive review of published and unpublished occurrence records of fish species in the Rio Negro drainage system within the Brazilian territory. The data was gathered from two main sources: 1) litterature compilations of species occurrence records, including original descriptions and re- visionary studies; and 2) specimens verification at the INPA fish collection. The results reveal a rich and diversified ichthyofauna, with 1,165 species distributed in 17 orders (+ two incertae sedis), 56 families, and 389 genera. A large portion of the fish fauna (54.3% of the species) is composed of small-sized fishes < 10 cm in standard length. -

Rapport 2009 Muséum D'histoire Naturelle
RAPPORT 2009 MUSÉUM D’HISTOIRE NATURELLE ET MUSÉE D’HISTOIRE DES SCIENCES DE LA VILLE DE GENÈVE TABLE DES MATIÈRES L’ANNEE EN BREF.......................................................................................................................7 L’ORGANISATION .......................................................................................................................9 Organisation générale ......................................................................................................................11 Ressources humaines ......................................................................................................................11 Collaborateurs et collaboratrices......................................................................................................12 Membres correspondants ................................................................................................................17 Relations extérieures........................................................................................................................17 Bibliothèques scientifiques et ressources documentaires ................................................................18 Services généraux ............................................................................................................................19 Accueil des stagiaires.......................................................................................................................22 Infrastructures .................................................................................................................................23 -

As Abelhas Nativas “Sem- Ferrão” (Hymenoptera, Anthophila, Meliponini) E Sua Importância Para a Conservação Ambiental
DESENVOLVIMENTO SUSTENTÁVEL AMANÃ SUSTENTÁVEL DESENVOLVIMENTO DE RESERVA DA SOCIOBIODIVERSIDADE SOCIOBIODIVERSIDADE DA RESERVA DE DESENVOLVIMENTO SUSTENTÁVEL AMANÃ (1998-2018): (1998-2018) 20 anos de pesquisas : 20 anos de pesquisas Siga-nos: /institutomamiraua Doe para o Instituto Mamirauá mamiraua.org.br/doacao SOCIOBIODIVERSIDADE DA RESERVA DE DESENVOLVIMENTO SUSTENTÁVEL AMANÃ (1998-2018): 20 anos de pesquisas SOCIOBIODIVERSIDADE DO AMANÃ 3 GOVERNO DO BRASIL PRESIDENTE DA REPÚBLICA Jair Bolsonaro MINISTÉRIO DA CIÊNCIA, TECNOLOGIA, INOVAÇÕES E COMUNICAÇÕES Marcos Cesar Pontes INSTITUTO DE DESENVOLVIMENTO SUSTENTÁVEL MAMIRAUÁ DIRETOR GERAL João Valsecchi do Amaral DIRETORA ADMINISTRATIVA Joycimara Rocha de Sousa DIRETORA DE MANEJO E DESENVOLVIMENTO Dávila Suelen Souza Corrêa DIRETOR TÉCNICO-CIENTÍFICO Emiliano Esterci Ramalho 4 SOCIOBIODIVERSIDADE DO AMANÃ SOCIOBIODIVERSIDADE DA RESERVA DE DESENVOLVIMENTO SUSTENTÁVEL AMANÃ (1998-2018): 20 anos de pesquisas ORGANIZADORES Ana Claudeise Silva do Nascimento, Maria Isabel Figueiredo Pereira de Oliveira Martins, Maria Cecília Rosinski Lima Gomes, Jefferson Ferreira-Ferreira, Isabel Soares de Sousa, Caetano Lucas Borges Franco e Marília de Jesus da Silva e Souza TEFÉ/AM 2019 SOCIOBIODIVERSIDADE DO AMANÃ 5 SOCIOBIODIVERSIDADE DA RESERVA DE DESENVOLVIMENTO SUSTENTÁVEL AMANÃ (1998-2018): 20 anos de pesquisas FICHA TÉCNICA ORGANIZAÇÃO Ana Claudeise Silva do Nascimento Maria Isabel Figueiredo Pereira de Oliveira Martins Maria Cecília Rosinski Lima Gomes Jefferson Ferreira-Ferreira Isabel Soares de Sousa Caetano Lucas Borges Franco Marília de Jesus da Silva e Souza REVISÃO Marise Reis PROJETO GRÁFICO Doizum Comunicações FICHA CATALOGRÁFICA Graciete do Socorro da Silva Rolim COMITÊ EDITORIAL Helder Lima de Queiroz Joycimara Rocha de Sousa Isabel Soares de Sousa João Valsecchi do Amaral Eunice Venturi Dávila Suelen Souza Corrêa Emiliano Esterci Ramalho FOTO CAPA André Dib FOTO CONTRACAPA Marilene Ribeiro N244 Nascimento, Ana Claudeise Silva do et al. -

Checklist of the Freshwater Fishes of Colombia
Biota Colombiana 9 (2) 143 - 237, 2008 Checklist of the Freshwater Fishes of Colombia Javier A. Maldonado-Ocampo'; Richard P. Vari^; Jose Saulo Usma' 1 Investigador Asociado, curador encargado coleccion de peces de agua dulce, Institute de Investigacion de Recursos Biologicos Alexander von Humboldt. Claustro de San Agustin, Villa de Leyva, Boyaca, Colombia. Direccion actual: Universidade Federal do Rio de Janeiro, Museu Nacional, Departamento de Vertebrados, Quinta da Boa Vista, 20940- 040 Rio de Janeiro, RJ, Brasil. [email protected] 2 Division of Fishes, Department of Vertebrate Zoology, MRC—159, National Museum of Natural History, PO Box 37012, Smithsonian Institution, Washington, D.C. 20013 — 7012. [email protected] 3 Coordinador Programa Ecosistemas de Agua Dulce WWF Colombia. Calle 61 No 3 A 26, Bogota D.C, Colombia. [email protected] Abstract Data derived from the literature supplemented by examination of specimens in collections show that 1435 species of native fishes live in the freshwaters of Colombia. These species represent 14 orders and 47 families. Orders with the largest numbers of species in the Colombian continental ichthyofauna are the Characiformes (637 species), Siluriformes (524 species), Perciformes (124 species), and Gymnotiformes (74 species), with the remaining 10 orders having from 1 to 35 species. At the family level, the Characidae has the greatest number of species (399 species), with this followed by the Loricariidae (166 species), Cichlidae (114 species), Pimelodidae (54 species), and Trichomycteridae (54 species); the remaining 42 families having 1 to 52 species. Present data indicate that 311 of the species occur solely at locations within Colombia. Continued descriptions of new species from the continental waters of Colombia demonstrate that the present total underestimates the species-level diversity of the ichthyofauna.