Série Biodiversidade 23)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

ABSTRACT Title of Dissertation: PATTERNS IN
ABSTRACT Title of Dissertation: PATTERNS IN DIVERSITY AND DISTRIBUTION OF BENTHIC MOLLUSCS ALONG A DEPTH GRADIENT IN THE BAHAMAS Michael Joseph Dowgiallo, Doctor of Philosophy, 2004 Dissertation directed by: Professor Marjorie L. Reaka-Kudla Department of Biology, UMCP Species richness and abundance of benthic bivalve and gastropod molluscs was determined over a depth gradient of 5 - 244 m at Lee Stocking Island, Bahamas by deploying replicate benthic collectors at five sites at 5 m, 14 m, 46 m, 153 m, and 244 m for six months beginning in December 1993. A total of 773 individual molluscs comprising at least 72 taxa were retrieved from the collectors. Analysis of the molluscan fauna that colonized the collectors showed overwhelmingly higher abundance and diversity at the 5 m, 14 m, and 46 m sites as compared to the deeper sites at 153 m and 244 m. Irradiance, temperature, and habitat heterogeneity all declined with depth, coincident with declines in the abundance and diversity of the molluscs. Herbivorous modes of feeding predominated (52%) and carnivorous modes of feeding were common (44%) over the range of depths studied at Lee Stocking Island, but mode of feeding did not change significantly over depth. One bivalve and one gastropod species showed a significant decline in body size with increasing depth. Analysis of data for 960 species of gastropod molluscs from the Western Atlantic Gastropod Database of the Academy of Natural Sciences (ANS) that have ranges including the Bahamas showed a positive correlation between body size of species of gastropods and their geographic ranges. There was also a positive correlation between depth range and the size of the geographic range. -

Biodiversidade Marinha Da Baía Da Ilha Grande
BIODIVERSIDADE MARINHA DA BAÍA DA ILHA GRANDE Este livro é dedicado a memória de nosso colega Prof. Dr. Paulo Secchin Yong 1 República Federativa do Brasil Presidente LUIZ INÁCIO LULA DA SILVA Vice-Presidente JOSÉ ALENCAR GOMES DA SILVA Ministério do Meio Ambiente Ministra MARINA SILVA Secretaria Executiva Secretário JOÃO PAULO RIBEIRO CAPOBIANCO Secretaria Nacional de Biodiversidade e Florestas Secretária MARIA CECÍLIA WEY DE BRITO Departamento de Conservação da Biodiversidade Diretor BRAULIO FERREIRA DE SOUZA DIAS Gerência de Conservação da Biodiversidade Gerente DANIELA AMÉRICA SUÁREZ DE OLIVEIRA Ministério do Meio Ambiente – MMA Centro de Informação e Documentação Luís Eduardo Magalhães – CID Ambiental Esplanada dos Ministérios – Bloco B – térreo – CEP – 70068-900 Tel.: 5561 3317-1235 Fax: 55 61 3317-1980 – e-mail: [email protected] 2 Ministério do Meio Ambiente Secretaria Nacional de Biodiversidade e Florestas Departamento de Conservação da Biodiversidade BIODIVERSIDADE MARINHA DA BAÍA DA ILHA GRANDE Organizadores Joel C. Creed, Débora O. Pires e Marcia A. de O. Figueiredo BIODIVERSIDADE 23 Brasília 2007 3 Organizadores Joel C. Creed, Débora O. Pires e Marcia A. de O. Figueiredo Supervisão editorial Márcia Maria Noura Paes Revisão Final Maria Beatriz Maury de Carvalho Capa e diagramação Marcelo Soares de Sousa, Mayko Daniel Miranda Normalização Bibliográfica Helionídia C. de Oliveira Fotos da Capa Enrico Marone e Joel Creed Fotos gentilmente cedidas por: Ana Cláudia Brasil, André R. de Senna, Carlos E.L. Ferreira, Carlos Henrique Caetano, -

228100 N, Tomando El Camino De Los Conucos Hasta El Entronque
228100 N, tomando el camino de los Conucos hasta el entronque de Zapato en 101700 E, 231400 N, siguiendo por el camino de Zapato hasta el final en 100700 E, 231600 N, girando al N hasta el estero de Santa Catalina por el cual sale al mar en 100300 E, 234950 N, se continúa por la línea de costa hasta el nacimiento del estero Los Morros en 096800 E, 234900 N, el cual se dirige hasta el punto N de Barra Sorda en 094300 E, 235400 N, por la orilla NO de esta barra en su límite con los manglares hasta cruzar el camino de Faro Roncali al estero Palmarito en 091900 E, 231900 N, en dirección S a 150 m del terraplén del Sur hasta el Pantano de Caleta Larga en 092800 E, 229950 N, donde bordea el Pantano hasta 092600 E, 229850 N, siguiendo la línea recta virtual hasta 090800 E, 228750 N, punto inicial de este derrotero. • A los efectos de controlar adecuadamente las acciones que puedan repercutir negativamente sobre esta área protegida se establece una Zona de Amortiguamiento que comprende los 500 metros a partir del límite externo del área y que se indica en el Anexo Cartográfico. Anexo 3 Listado de especies de la flora Flora terrestre Flora marina División RHODOPHYTA Orden CORALLINALES Familia CORALLINACEA 1. Amphiroa beauvoisii Lamouroux 2. Amphiroa fragilissima (Linnaeus) Lamouroux 3. Amphiroa rigida Lamouroux 4. Haliptilon cubense (Montagne ex Kützing) Garbary et Johansen 5. Haliptilon subulatum (Ellis et Solander) Johansen 6. Hydrolithon farinosum (Lamouroux) Penrose et Chamberlain 7. Jania adhaerens Lamouroux 8. -
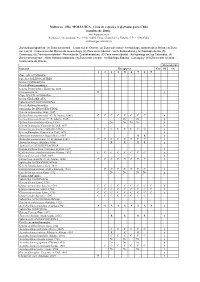
Moluscos - Filo MOLLUSCA
Moluscos - Filo MOLLUSCA. Lista de especies registradas para Cuba (octubre de 2006). José Espinosa Sáez Instituto de Oceanología, Ave 1ª No. 18406, Playa, Ciudad de La Habana, C.P. 11200, Cuba [email protected] Zonas biogeográficas: (1) Zona suroriental – Costa sur de Oriente, (2) Zona surcentral - Archipiélago Jardines de la Reina, (3) Zona sur central - Costa al sur del Macizo de Guamuhaya, (4) Zona suroccidental - Golfo de Batabanó y Archipiélago de los, (5) Canarreos, (6) Zona suroccidental - Península de Guanahacabibes, (7) Zona noroccidental - Archipiélago de Los Colorados, (8) Zona noroccidental - Norte Habana-Matanzas, (9) Zona norte-central - Archipiélago Sabana - Camagüey, (10) Zona norte-oriental - Costa norte de Oriente Abreviaturas Especies Bioegiones Cu Pl Oc 1 2 3 4 5 6 7 8 9 Clase APLACOPHORA Subclase SOLENOGASTRES Orden CAVIBELONIA Familia Proneomeniidae Género Proneomenia Hubrecht, 1880 Proneomenia sp . R x Clase POLYPLACOPHORA Orden NEOLORICATA Suborden ISCHNOCHITONINA Familia Ischnochitonidae Subfamilia ISCHNOCHITONINAE Género Ischnochiton Gray, 1847 Ischnochiton erythronotus (C. B. Adams, 1845) C C C C C C C C x Ischnochiton papillosus (C. B. Adams, 1845) Nc Nc x Ischnochiton striolatus (Gray, 1828) Nc Nc Nc Nc x Género Ischnoplax Carpenter in Dall, 1879 x Ischnoplax pectinatus (Sowerby, 1832) C C C C C C C C x Género Stenoplax Carpenter in Dall, 1879 x Stenoplax bahamensis Kaas y Belle, 1987 R R x Stenoplax purpurascens (C. B. Adams, 1845) C C C C C C C C x Stenoplax boogii (Haddon, 1886) R R R R x Subfamilia CALLISTOPLACINAE Género Callistochiton Carpenter in Dall, 1879 x Callistochiton shuttleworthianus Pilsbry, 1893 C C C C C C C C x Género Ceratozona Dall, 1882 x Ceratozona squalida (C. -

Stratigraphy, Structure and Early Paleozoic Gastropoda of the Callahan Area, Klameth Mountains, California
AN ABSTRACT OF THE THESIS OF David Malcolm Rohr for the degree of Doctor of Philosophy in Geology presented on 15 June 1977 Title:STRATIGRAPHY, STRUCTURE, AND EARLY PALEOZOIC GASTROPODA OF THE CALLAHAN AREA, KLAMATH MOUNTAINS, CALIFORNIA Redacted for Privacy Abstract approved: A. IV Boucot The sedimentary, metamorphic, and igneous rocks of the Callahan, California area formed on, or adjacent to, a Lower Paleo- zoic island arc complex which has since been tectonically disrupted. Sandstone, shale, lithic wacke, chert, banded quartzite, siliceous mudstone, conglomerate, and limestone of the eastern Klamath belt were deposited from the Middle Ordovician through the Early Devonian on top of the peridotite of the Early? Ordovician Trinity ophiolitic complex.Shallow water deposition began in the Middle Ordovician with the Facey Rock Limestone.Sandstone, siltstone, and shale of the Moffett Creek Formation probably formed as turbidity flows adjacent to the arc and were later disrupted, possibly at shallow depths in a subduction zone.Other units in the Callahan area (Calla- han Chert, Gazelle Formation, quartzite of Squaw Gulch, siliceous mudstone of Thompson Gulch) may have formed in basins on the Moffett Creek Formation. The Moffett Creek Formation was derived from a primarily plutonic-metamorphic terrane, possibly a deeply eroded arc complex, while the overlying Gazelle Formation was derived from a primarily calc-alkaline volcanic source. Amphibolite and impure marbles of the Grouse Ridge Formation, which have an Early or Middle Devonian age -

Parque Nacional Guanahacabibes Cuba
UNITED NATIONS EP United Nations Original: ENGLISH Environment Program Proposed areas for inclusion in the SPAW list ANNOTATED FORMAT FOR PRESENTATION REPORT FOR: Parque Nacional Guanahacabibes Cuba Date when making the proposal : 29/8/12 CRITERIA SATISFIED : Ecological criteria Cultural and socio-economic criteria Representativeness Productivity Conservation value Cultural and traditional use Rarity Socio-economic benefits Naturalness Critical habitats Diversity Connectivity/coherence Resilience I. IDENTIFICACIÓN 11. Completar todos los campos. *a – País: Cuba *b – Nombre del área: Parque Nacional Guanahacabibes *c – Región administrativa: Provincia de Pinar del Río, municipio Sandino *d – Fecha de establecimiento: 14 de diciembre de 2001 *e – Si otra, fecha de declaración legal: 14 de diciembre de 2001 *f – Localización geográfica (incluya un anexo separado con un mapa geográfico según se indica en la declaración legal del área) y coordenadas geográficas (X, Y para el punto central, WGS84, sistemas de proyección UTM)1: *g – Extensión (km2): 398.3 *h – Dirección de contacto (con dirección de sitio web, si existe): M. Sc. Susana Perera Valderrama, Especialista del Centro Nacional de Áreas Protegidas de Cuba. E-mail: [email protected] Lic. Lázaro Márquez Llauger, Director del Parque Nacional Guanahacabibes. E-mail: [email protected] M. Sc. Dorka Cobián Rojas, Responsable del Programa de Investigación Científica y Monitoreo del Parque Nacional Guanahacabibes. E-mail: [email protected] *i– Eco-región marina (según la clasificación de Eco-regiones Marinas del Mundo): 2 http:www.nature.org/tncscience/news/news2357.html II. RESUMEN EJECUTIVO 12. Presente brevemente el área propuesta y sus principales características y especifique los objetivos que motivaron su creación: El Parque Nacional Guanahacabibes constituye la zona núcleo de la Reserva de la Biosfera Península de Guanahacabibes. -

SCAMIT Newsletter Vol. 15 No. 2 1996 June
June, 1996 SCAMIT Newsletter vol. is, N0.2 NEXT MEETING: N.E. Pacific phyllodocids and syllids GUEST SPEAKER: Leslie Harris Natural History Museum of Los Angeles County DATE: July 8, 1996 TIME: 9:30AM - 3:30PM LOCATION: Worm Lab, Natural History Museum of Los Angeles County, 900 Exposition Blvd., Los Angeles JULY 8 MEETING The July meeting will be presented by Leslie Harris, and will reprise her presentation to NAMIT at their recent polychaete workshop. She will brief us on the workshop as well. Leslie has examined the type of Pilargis berkeleyae and has resolved the confusion between P. berkeleyae and P. maculata as a result. She requests you bring specimens of your Pilargis for comparison. Also any problem phyllodocids or syllids are welcome. Pilargis berkeleyae (from Hartman 1947) FUNDS FOR THIS PUBLICATION PROVIDED, IN PART, BY THE ARCO FOUNDATION, CHEVRON USA, AND TEXACO INC. SCAMIT Newsletter is not deemed to be a valid publication for formal taxonomic purposes. June, 1996 SCAMIT Newsletter Vol. 15, No. 2 very informative portion of the life of NEW LITERATURE gastropods: that in which the larvae metamorphose. She studied a Hawaiian turrid by Several newly received papers on ecology or hatching larvae in the laboratory; providing taxonomy were circulated at the meeting . access to numerous larvae throughout the critical metamorphosis period. Changes at the Desqueyroux-Faundez and Van Soest (1996) protoconch/teleoconch shell boundary were review the sponge families Iophonidae, examined by SEM, and showed details of the Myxillidae and Tedaniidae in the southeast process which may provide meaningful Pacific - primarily from Chile and Peru. -

SOUTHERN CALIFORNIA BIGHT 1998 REGIONAL MONITORING PROGRAM Vol
Benthic Macrofauna SOUTHERN CALIFORNIA BIGHT 1998 REGIONAL MONITORING PROGRAM Vol . VII Descriptions and Sources of Photographs on the Cover Clockwise from bottom right: (1) Benthic sediment sampling with a Van Veen grab; City of Los Angeles Environmental Monitoring Division. (2) Bight'98 taxonomist M. Lily identifying and counting macrobenthic invertebrates; City of San Diego Metropolitan Wastewater Department. (3) The phyllodocid polychaete worm Phyllodoce groenlandica (Orsted, 1843); L. Harris, Los Angeles County Natural History Museum. (4) The arcoid bivalve clam Anadara multicostata (G.B. Sowerby I, 1833); City of San Diego Metropolitan Wastewater Department. (5) The gammarid amphipod crustacean Ampelisca indentata (J.L. Barnard, 1954); City of San Diego Metropolitan Wastewater Department. Center: (6) Macrobenthic invertebrates and debris on a 1.0 mm sieve screen; www.scamit.org. Southern California Bight 1998 Regional Monitoring Program: VII. Benthic Macrofauna J. Ananda Ranasinghe1, David E. Montagne2, Robert W. Smith3, Tim K. Mikel4, Stephen B. Weisberg1, Donald B. Cadien2, Ronald G. Velarde5, and Ann Dalkey6 1Southern California Coastal Water Research Project, Westminster, CA 2County Sanitation Districts of Los Angeles County, Whittier, CA 3P.O. Box 1537, Ojai, CA 4Aquatic Bioassay and Consulting Laboratories, Ventura, CA 5City of San Diego, Metropolitan Wastewater Department, San Diego, CA 6City of Los Angeles, Environmental Monitoring Division March 2003 Southern California Coastal Water Research Project 7171 Fenwick Lane, Westminster, CA 92683-5218 Phone: (714) 894-2222 · FAX: (714) 894-9699 http://www.sccwrp.org Benthic Macrofauna Committee Members Donald B. Cadien County Sanitation Districts of Los Angeles County Ann Dalkey City of Los Angeles, Environmental Monitoring Division Tim K. -

Middle Miocene (Badenian) Gastropods from Korytnica, Poland; Part V Addenda Et Corrigenda Ad Prosobranchia
Acta Geologica Polonica, Vol. 56 (2006), No. 2, pp. 177-220 Middle Miocene (Badenian) gastropods from Korytnica, Poland; Part V Addenda et Corrigenda ad Prosobranchia WAC¸AW BA¸UK Institute of Geology, University of Warsaw, Al. ˚wirki i Wigury 93; Pl-02-089 Warszawa, Poland ABSTRACT: BA¸UK, W. 2006. Middle Miocene (Badenian) gastropods from Korytnica, Poland; Part V, Addenda et Corrigenda ad Prosobranchia. Acta Geologica Polonica, 56 (2), 177-220. Warszawa. This report is the fifth part of the monograph of the rich assemblage of gastropods occurring in the so-called Pleurotoma Clays of Middle Miocene (Badenian) age, exposed in the environs of Korytnica in the Holy Cross Mountains, Central Poland. Besides 73 species, described earlier, the report contains descriptions of 52 species omitted from the earlier parts; of which, 50 were not recorded previously from Korytnica. Five species are established as new: Cocculina (Dallia) unica sp.nov., Turritella (Peyrotia) circumcisa sp.nov., Caecum korytnicense sp.nov., Morula valdemari sp.nov., and Ocinebrina recognita sp.nov. A new name, Megalomphalus palazzii nom.nov. is proposed for Narica depressa BOETTGER, 1907 [=Megalomphalus depressus (BOETTGER, 1907)], which is a homonym of Megalomphalus depressus (SEGUENZA, 1876). Key words: Prosobranch gastropods, Middle Miocene, Korytnica. C O N T E N T S Species marked with an asterisk are species reported/announced in previous parts of this monograph INTRODUCTION 180 *Gibbula (Colliculus) boettgeri L. ILJINA, 1993 182 SYSTEMATIC ACCOUNT 180 Genus Granulifera -

Guida Semplice Ai Molluschi Marini Del Mare Mediterraneo
Guida semplice ai Molluschi Marini del Mar Mediterraneo Simple Guide to the Mediterranean Sea Molluscs Claudio Fanelli, Edoardo Perna, Ennio Squizzato members of the Teams of the International Teaching Malacology Project versione 02 .01 pagina 1 Questo lavoro è parte del Progetto Internazionale per l’Insegnamento della Malacologia ed è dedicato ad attività educative. Quindi non è per profitto a non può essere venduto o usato per fini commerciali. Dobbiamo un ringraziamento a tutti color che ci hanno messo a disposizione le loro foto. Queste sono usate esclusivamente per finalità educative all’interno del progetto e hanno requisiti scientifici, educativi e non per profitto. Le immagini usate rimangono di proprietà degli autori e a questo scopo sulle immagini del database fotografico del progetto è scritto il loro nome. In questo lavoro sono scritti solo i nomi diversi da quelli degli autori di questo volume. Questa prima edizione sarà sicuramente oggetto di revisioni effettuate, nell'ambito del progetto, sulla base di collaborazioni con gli altri paesi partecipanti. This work is part of the International Teaching Malacology Project and is dedicated to educational activities. It has therefore not for profit and may not be sold or used for commercial purposes . We owe thanks to all those from whom we took some photos. These were used exclusively for educational purposes within the project and meet the requirements in terms of scientific , educational and not for profit usage. The images used remain the property of the authors and for this purpose on the images of the photographic database of the project is written their name. -

Biogeography and Biodiversity of Gastropod Molluscs from the Eastern Brazilian Continental Shelf and Slope
Lat. Am. J. Aquat. Res., 37(2): 143-159, 2009 Biogeography and biodiversity of shelf gastropods 143 DOI: 10.3856/vol37-issue2-fulltext-3 Research Article Biogeography and biodiversity of gastropod molluscs from the eastern Brazilian continental shelf and slope Gabriela Benkendorfer1 & Abílio Soares-Gomes1 1Marine Biology Department, Universidade Federal Fluminense, P.O.Box 100.644, Niterói, RJ, Brazil ABSTRACT. Biogeographic distributional patterns of gastropods are proposed based on the species’ geo- graphic and bathymetric distribution. Samples were collected along the Brazilian continental margin between 18° S and 23° S, at 37 stations with depths from 20 m to 1,330 m. The analysis of the biogeographic distribu- tion patterns confirmed the existence of a transitional zone from tropical to subtropical waters in the area of both the continental shelf and slope, suggesting a relationship with water mass circulation. We observed a high species turnover rate between the shelf and slope. The analysis of gastropod species distribution revealed a similar pattern on the shelf and slope and a large difference between shallow and deep-water faunas. Keywords: macrobenthos, continental margins, geographical distribution, vertical distribution, soft bottoms, Brazil, southwestern Atlantic Ocean. Biogeografía y biodiversidad de moluscos gastrópodos de la plataforma y talud continental brasileño RESUMEN. Los patrones de distribución biogeográfica de gastrópodos fueron propuestos basados en la dis- tribución geográfica y batimétrica de las especies. Los muestreos fueron realizados en el margen continental brasileño entre 18°S y 23°S, en 37 estaciones de 20 m a 1.330 m de profundidad. El análisis de los patrones de distribución biogeográfica confirmó la existencia de una zona de transición de aguas tropicales a aguas subtro- picales, que se encuentra en la zona de la plataforma continental y también en la zona del talud continental, es- to puede sugerir una relación con la circulación de las masas de agua. -
Littorinidae
WMSDB - Worldwide Mollusc Species Data Base Family: LITTORINIDAE Author: Claudio Galli - [email protected] (updated 07/set/2015) Class: GASTROPODA --- Clade: CAENOGASTROPODA-HYPSOGASTROPODA-LITTORINIMORPHA-LITTORINOIDEA ------ Family: LITTORINIDAE Children, 1834 (Sea) - Alphabetic order - when first name is in bold the species has images Taxa=959, Genus=31, Subgenus=11, Species=239, Subspecies=16, Synonyms=661, Images=178 aberrans , Littoraria aberrans (R.A. Philippi, 1846) abjecta, Echinolittorina abjecta A. Adams, 1852 - syn of: Echinolittorina atrata (A. Adams, 1852) abyssicola, Lacuna abyssicola J.C. Melvill & R. Standen, 1912 abyssorum , Lacuna abyssorum É.A.A. Locard, 1896 - syn of: Benthonella tenella (J.G. Jeffreys, 1869) acuminata , Littorina acuminata A.A. Gould, 1849 - syn of: Littoraria undulata (J.E. Gray, 1839) acuta , Austrolittorina acuta R.A. Philippi, 1847 - syn of: Austrolittorina unifasciata (J.E. Gray, 1826) acutispira , Afrolittorina acutispira (E.A. Smith, 1892) acutispira , Nodilittorina acutispira E.A. Smith, 1892 - syn of: Afrolittorina acutispira (E.A. Smith, 1892) adonis , Palustorina adonis M. Yokoyama, 1927 - syn of: Littoraria sinensis (R.A. Philippi, 1847) adonis , Littorina adonis M. Yokoyama, 1927 - syn of: Littoraria sinensis (R.A. Philippi, 1847) aestualis , Laevilitorina aestualis H. Strebel, 1908 - syn of: Laevilitorina caliginosa (A.A. Gould, 1849) affinis , Tectarius affinis D'Orbigny, 1839 - syn of: Tectarius striatus (P.P. King, 1832) affinis , Littorina affinis D'Orbigny, 1840 - syn of: Tectarius striatus (P.P. King, 1832) africana , Afrolittorina africana (C.F.F. von Krauss in R.A. Philippi, 1847) africana , Nodilittorina africana C.F.F. von Krauss in R.A. Philippi, 1847 - syn of: Afrolittorina africana (C.F.F. von Krauss in R.A.