Cnidaria: Myxo
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Redalyc.Diet and Niche Breadth and Overlap in Fish Communities Within
Anais da Academia Brasileira de Ciências ISSN: 0001-3765 [email protected] Academia Brasileira de Ciências Brasil SÁ-OLIVEIRA, JÚLIO C.; ANGELINI, RONALDO; ISAAC-NAHUM, VICTORIA J. Diet and niche breadth and overlap in fish communities within the area affected by an Amazonian reservoir (Amapá, Brazil) Anais da Academia Brasileira de Ciências, vol. 86, núm. 1, enero-marzo, 2014, pp. 383-405 Academia Brasileira de Ciências Rio de Janeiro, Brasil Available in: http://www.redalyc.org/articulo.oa?id=32730090027 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Anais da Academia Brasileira de Ciências (2014) 86(1): 383-405 (Annals of the Brazilian Academy of Sciences) Printed version ISSN 0001-3765 / Online version ISSN 1678-2690 http://dx.doi.org/ 10.1590/0001-3765201420130053 www.scielo.br/aabc Diet and niche breadth and overlap in fish communities within the area affected by an Amazonian reservoir (Amapá, Brazil) JÚLIO C. SÁ-OLIVEIRA1, RONALDO ANGELINI2 and VICTORIA J. ISAAC-NAHUM3 1Laboratório de Limnologia e Ictiologia, Universidade Federal do Amapá/ UNIFAP, Campus Universitário Marco Zero do Equador, Rod. Juscelino Kubitscheck, Km 02, 68903-419 Macapá, AP, Brasil 2Departamento de Engenharia Civil, Universidade Federal do Rio Grande do Norte/ UFRN, BR 101, Campus Universitário, 59078-970 Natal, RN, Brasil 3Laboratório de Biologia Pesqueira, Universidade Federal do Pará/ UFPA, Campus Guamá, Rua Augusto Corrêa, 01, Guamá, 66075-110 Belém, PA, Brasil Manuscript received on February 13, 2013, accepted for publication on July 5, 2013 ABSTRACT We investigated the niche breadth and overlap of the fish species occurring in four environments affected by the Coaracy Nunes reservoir, in the Amapá Brazilian State. -

Los Peces Caribes De Venezuela.Pdf
Bol. Acad. C. Fís., Mat. y Nat. Vol. LXII No. 1 Marzo, 2002: 35-88. Antonio Machado-Allison: Los Peces Caribes de Venezuela LOS PECES CARIBES DE VENEZUELA: UNA APROXIMACIÓN A SU ESTUDIO TAXONÓMICO Antonio Machado Allison* El Trabajo presenta una sinopsis detallada de las diez y seis especies de caribes (pirañas) de Venezuela, incluidas en los géneros: Pygopristis (1 especie), Pristobrycon (4 especies), Pygocentrus (1 especie) y Serrasalmus (10 especies). Se discuten los aspectos histórico-taxonómico de cada especie, desde las Crónicas de Indias, los primeros naturalistas, hasta las contribuciones científicas más recientes. Se discute la validez de los nombres utilizados tradicionalmente y sus sinonimias. Se sugieren aspectos evolutivos y de relaciones filogenéticas intra y entre los diferentes géneros. Se ilustra cada especie con dibujos y fotografías y se incorporan claves para la identificación de los géneros y las especies. This paper present a detailed sinopsis of the piranha sixteen species of Venezuela, included in the genera: Pygopristis (1 species), Pristobrycon (4 species), Pygocentrus (1 species) y Serrasalmus (10 species). Discussions on historical-taxonomic aspects of each species are included from the Indian Crónicas de Indias, the first naturalists, to recent scientific contributions. Names traditionally used and sinonomies of each species are discussed. Suggestions on hypothesis of relationships and evolution inside groups and among genera are given. Each species is illustrated with drawings and photographs. Keys for the identification of species are included. Palabras Clave: Peces, Caribes, Venezuela, Clasificación Keywords: Fish, Piranha, Venezuela, Clasification I. INTRODUCCION mundial, gracias a la proliferación de historias, leyendas y fantasías muchas veces sin sentido. -

Zootaxa,Molecular Systematics of Serrasalmidae
Zootaxa 1484: 1–38 (2007) ISSN 1175-5326 (print edition) www.mapress.com/zootaxa/ ZOOTAXA Copyright © 2007 · Magnolia Press ISSN 1175-5334 (online edition) Molecular systematics of Serrasalmidae: Deciphering the identities of piranha species and unraveling their evolutionary histories BARBIE FREEMAN1, LEO G. NICO2, MATTHEW OSENTOSKI1, HOWARD L. JELKS2 & TIMOTHY M. COLLINS1,3 1Dept. of Biological Sciences, Florida International University, University Park, Miami, FL 33199, USA. 2United States Geological Survey, 7920 NW 71st St., Gainesville, FL 32653, USA. E-mail: [email protected] 3Corresponding author. E-mail: [email protected] Table of contents Abstract ...............................................................................................................................................................................1 Introduction ......................................................................................................................................................................... 2 Overview of piranha diversity and systematics .................................................................................................................. 3 Material and methods........................................................................................................................................................ 10 Results............................................................................................................................................................................... 16 Discussion -

Rockfish (Sebastes) That Are Evolutionarily Isolated Are Also
Biological Conservation 142 (2009) 1787–1796 Contents lists available at ScienceDirect Biological Conservation journal homepage: www.elsevier.com/locate/biocon Rockfish (Sebastes) that are evolutionarily isolated are also large, morphologically distinctive and vulnerable to overfishing Karen Magnuson-Ford a,b, Travis Ingram c, David W. Redding a,b, Arne Ø. Mooers a,b,* a Biological Sciences, Simon Fraser University, 8888 University Drive, Burnaby BC, Canada V5A 1S6 b IRMACS, Simon Fraser University, 8888 University Drive, Burnaby BC, Canada V5A 1S6 c Department of Zoology and Biodiversity Research Centre, University of British Columbia, #2370-6270 University Blvd., Vancouver, Canada V6T 1Z4 article info abstract Article history: In an age of triage, we must prioritize species for conservation effort. Species more isolated on the tree of Received 23 September 2008 life are candidates for increased attention. The rockfish genus Sebastes is speciose (>100 spp.), morpho- Received in revised form 10 March 2009 logically and ecologically diverse and many species are heavily fished. We used a complete Sebastes phy- Accepted 18 March 2009 logeny to calculate a measure of evolutionary isolation for each species and compared this to their Available online 22 April 2009 morphology and imperilment. We found that evolutionarily isolated species in the northeast Pacific are both larger-bodied and, independent of body size, morphologically more distinctive. We examined Keywords: extinction risk within rockfish using a compound measure of each species’ intrinsic vulnerability to Phylogenetic diversity overfishing and categorizing species as commercially fished or not. Evolutionarily isolated species in Extinction risk Conservation priorities the northeast Pacific are more likely to be fished, and, due to their larger sizes and to life history traits Body size such as long lifespan and slow maturation rate, they are also intrinsically more vulnerable to overfishing. -

Journal of the Helminthological Society of Washington 63(2) 1996
July 1996 Number 2 Of of Washington A semiannual journal of research devoted to Helminthology and all branches of Parasitology Supported in part by the Brayton H. Ransom Memorial Trust Fund D. C. KRITSKY, W. A. :B6EC3ER, AND M, JEGU. NedtropicaliMonogehoidea/lS. An- — cyrocephalinae (Dactylogyridae) of Piranha and Their Relatives (Teleostei, JSer- rasalmidae) from Brazil and French Guiana: Species of Notozothecium Boeger and Kritsky, 1988, and Mymarotheciumgem. n. ..__ _______ __, ________ ..x,- ______ .s.... A. KOHN, C. P. SANTOS, AND-B. LEBEDEV. Metacdmpiella euzeti gen. n., sp, n., and I -Hargicola oligoplites~(Hargis, 1951) (Monogenea: Allodiscpcotylidae) from Bra- " zilian Fishes . ___________ ,:...L".. _______ j __ L'. _______l _; ________ 1 ________ _ __________ ______ _ .' _____ . __.. 176 C. P. SANTO?, T. SOUTO-PADRGN, AND R. M. LANFREDI. Atriasterheterodus (Levedev and Paruchin, 1969) and Polylabris tubicimts (Papema and Kohn, 1964) (Mono- ' genea) from Diplodus argenteus (Val., 1830) (Teleostei: Sparidae) from Brazil 181 . I...N- CAIRA AND T. BARDOS. Further Information on :.Gymnorhynchus isuri (Trypa- i/:norhyncha: Gymnorhynchidae) from the Shortfin Make Shark ...,.'. ..^_.-"_~ ____. ; 188 O. M. AMIN AND W. L.'MmcKLEY. Parasites of Some Fisji Introduced into an Arizona Reservoir, with Notes on Introductions — . ____ : ______ . ___.i;__ L____ _ . ______ :___ _ .193 O. M. AMIN AND O. SEY. Acanthocephala from Arabian Gulf Fishes off Kuwait, with 'Descriptions of Neoechinorhynchus dimorphospinus sp. n. XNeoechinorhyrichi- dae), Tegorhyrichus holospinosus sp. n. (l\lio&&ntid&e),:Micracanthorynchina-ku- waitensis sp. n. (Rhadinorhynchidae), and Sleriidrorhynchus breviclavipraboscis gen. n., sp. p. (Diplosentidae); and Key to Species of the Genus Micracanthor- . -

CURRICULUM VITAE: William L
CURRICULUM VITAE: William L. Fink William L. Fink Museum of Zoology University of Michigan Ann Arbor, MI 48109 (313) 764-9928 [email protected] FAX (313) 763-4080 Home page http://www-personal.umich.edu/~wfink 1215 Shady Oaks Dr. Ann Arbor, MI 48103 (313) 665-4556 Education: B.S. University of Miami, Florida, 1967 M.S. University of Southern Mississippi, 1969 Ph.D. George Washington University, 1976 Appointments: Director, Museum of Zoology, University of Michigan, 2005- Professor of Ecology and Evolutionary Biology, Associate Professor, Assistant Professor of Biology/Curator, Associate Curator, Assistant Curator of Fishes, Museum of Zoology, University of Michigan, 1982-; Associate Chair, Department of Ecology and Evolutionary Biology, 2001-5 Associate Professor and Assistant Professor of Biology/Associate Curator and Assistant Curator of Fishes, Museum of Comparative Zoology, Harvard University, 1976-82 Military Service: United States Navy, Naval Medical Research Institute, Bethesda, Maryland, 1969-71. (Reserve through 1975) Grants and Awards: Dissemination Information Packages (DIPS) for Information Reuse (DIPIR), Institute of Museum and Library Services, 2011-2014 Intel Education Program, Workstations and Software for Morphometrics Course, 2001 Office of the Vice President for Research and H.H. Rackham School of Graduate Studies Spring/Summer Research Grant, 2000 LS&A Excellence in Education Award, 1999 NSF Grant DEB-9525763, "NEODAT II, An Inter-Institutional Database of Fish Biodiversity in the Neotropics" 1995-1998 NSF Grant DEB-9509195, "Systematics of Piranha Shape and Ontogeny" (with M. Zelditch), 1995-98 (REU Supplement, 1997) 1 CURRICULUM VITAE: William L. Fink University of Michigan, Office of the Vice President for Research Grant, "The evolution of parental care, mating systems and associated characters in the geophagine subfamily of the cichlid fishes" (with Peter Wimberger), 1992 NSF Grant DEB-9024797, "An inter-institutional database for fish biodiversity in the Neotropics" (with S. -

Community Ecology of Parasites in Four Species of Corydoras (Callichthyidae), Ornamental Fish Endemic to the Eastern Amazon (Brazil)
Anais da Academia Brasileira de Ciências (2019) 91(1): e20170926 (Annals of the Brazilian Academy of Sciences) Printed version ISSN 0001-3765 / Online version ISSN 1678-2690 http://dx.doi.org/10.1590/0001-3765201920170926 www.scielo.br/aabc | www.fb.com/aabcjournal Community ecology of parasites in four species of Corydoras (Callichthyidae), ornamental fish endemic to the eastern Amazon (Brazil) MAKSON M. FERREIRA1, RAFAEL J. PASSADOR2 and MARCOS TAVARES-DIAS3 1Graduação em Ciências Biológicas, Faculdade de Macapá/FAMA, Rodovia Duca Serra, s/n, Cabralzinho, 68906-801 Macapá, AP, Brazil 2Instituto Chico Mendes de Conservação da Biodiversidade/ICMBio, Rua Leopoldo Machado, 1126, Centro, 68900-067 Macapá, AP, Brazil 3Embrapa Amapá, Rodovia Juscelino Kubitschek, 2600, 68903-419 Macapá, AP, Brazil Manuscript received on April 2, 2018; accepted for publication on June 11, 2018 How to cite: FERREIRA MM AND PASSADOR RJ. 2019. Community ecology of parasites in four species of Corydoras (Callichthyidae), ornamental fish endemic to the eastern Amazon (Brazil). An Acad Bras Cienc 91: e20170926. DOI 10.1590/0001-3765201920170926. Abstract: This study compared the parasites community in Corydoras ephippifer, Corydoras melanistius, Corydoras amapaensis and Corydoras spilurus from tributaries from the Amapari River in State of Amapá (Brazil). A total of 151 fish of these four ornamental species were examined, of which 66.2% were parasitized by one or more species, and a total of 732 parasites were collected. Corydoras ephippifer (91.2%) and C. spilurus (98.8%) were the most parasitized hosts, while C. amapaensis (9.6%) was the least parasitized. A high similarity (≅ 75%) of parasite communities was found in the host species. -

Protozoa General Characters & Classification
PROTOZOA GENERAL CHARACTERS & CLASSIFICATION Dr. P. RAVI SEKHAR LECTURER IN ZOOLOGY GOVT. COLLEGE FOR MEN (AUTONOMOUS) KADAPA PROTOZOA GENERAL CHARACTERS & CLASSIFICATION The animals kingdom is often distinguished into two major categories, is based on a singular character, the notochord. Animals without notochord are called Non – Chordates. Animals possessing notochord are called Chordates. Major and minor Phyla • Invertebrates are divided into major and minor phyla. The concept of major and minor phyla depends upon two factors. 1. Number of species and individuals in the phyla 2. Participation of Phyla in ecological communities • On the basis of these two factors Major phyla : 9 Minor phyla : 21 Invertibrate Phyla and approximate Number S. No Phylum Major/ Number of S. No Phylum Major/ Number of Minor species Minor species 1 Protozoa Major 50,000 16 Spunculida Minor 275 2 Mesozoa Minor 50 17 Mollusca Major 80,000 3 Porifera Major 10,000 18 Echiurida Minor 60 4 Coelenterata Major 11,000 19 Annelida Major 7,000 5 Ctenophora Minor 90 20 Tardigrada Minor 180 6 Platyhelmenthes Major 15,000 21 Onychophora Minor 65 7 Nementinea Minor 750 22 Pentastomadia Minor 70 8 Acanthocephala Minor 300 23 Arthropoda Major 9,00,000 9 Entoprocta Minor 60 24 Phorronida Minor 15 10 Rotifera Minor 1900 25 Ectoprocta Minor 4,000 11 Gastrotricha Minor 175 26 Branchiopoda Minor 260 12 Kinorhtcha Minor 100 27 Echinodermata Major 6,000 13 Nematoda Major 10,000 28 Chactognatha Minor 50 14 Namatophora Minor 250 29 Pogonophora Minor 80 15 Priyapuluda Minor 8 30 Hemichordata Minor 80 Introduction • Protozoans are microscopic and acellular animalcules, without tissue and organs. -

Localized Depletion of Three Alaska Rockfish Species Dana Hanselman NOAA Fisheries, Alaska Fisheries Science Center, Auke Bay Laboratory, Juneau, Alaska
Biology, Assessment, and Management of North Pacific Rockfishes 493 Alaska Sea Grant College Program • AK-SG-07-01, 2007 Localized Depletion of Three Alaska Rockfish Species Dana Hanselman NOAA Fisheries, Alaska Fisheries Science Center, Auke Bay Laboratory, Juneau, Alaska Paul Spencer NOAA Fisheries, Alaska Fisheries Science Center, Resource Ecology and Fisheries Management (REFM) Division, Seattle, Washington Kalei Shotwell NOAA Fisheries, Alaska Fisheries Science Center, Auke Bay Laboratory, Juneau, Alaska Rebecca Reuter NOAA Fisheries, Alaska Fisheries Science Center, REFM Division, Seattle, Washington Abstract The distributions of some rockfish species in Alaska are clustered. Their distribution and relatively sedentary movement patterns could make localized depletion of rockfish an ecological or conservation concern. Alaska rockfish have varying and little-known genetic stock structures. Rockfish fishing seasons are short and intense and usually confined to small areas. If allowable catches are set for large management areas, the genetic, age, and size structures of the population could change if the majority of catch is harvested from small concentrated areas. In this study, we analyzed data collected by the North Pacific Observer Program from 1991 to 2004 to assess localized depletion of Pacific ocean perch (Sebastes alutus), northern rockfish S.( polyspinis), and dusky rockfish (S. variabilis). The data were divided into blocks with areas of approxi- mately 10,000 km2 and 5,000 km2 of consistent, intense fishing. We used two different block sizes to consider the size for which localized deple- tion could be detected. For each year, the Leslie depletion estimator was used to determine whether catch-per-unit-effort (CPUE) values in each 494 Hanselman et al.—Three Alaska Rockfish Species block declined as a function of cumulative catch. -

Long Term Evolutionary Responses to Whole Genome Duplication
Unicentre CH-1015 Lausanne http://serval.unil.ch Year : 2016 Long term evolutionary responses to whole genome duplication Sacha Laurent Sacha Laurent, 2016, Long term evolutionary responses to whole genome duplication Originally published at : Thesis, University of Lausanne Posted at the University of Lausanne Open Archive http://serval.unil.ch Document URN : urn:nbn:ch:serval-BIB_8E5536BAC6042 Droits d’auteur L'Université de Lausanne attire expressément l'attention des utilisateurs sur le fait que tous les documents publiés dans l'Archive SERVAL sont protégés par le droit d'auteur, conformément à la loi fédérale sur le droit d'auteur et les droits voisins (LDA). A ce titre, il est indispensable d'obtenir le consentement préalable de l'auteur et/ou de l’éditeur avant toute utilisation d'une oeuvre ou d'une partie d'une oeuvre ne relevant pas d'une utilisation à des fins personnelles au sens de la LDA (art. 19, al. 1 lettre a). A défaut, tout contrevenant s'expose aux sanctions prévues par cette loi. Nous déclinons toute responsabilité en la matière. Copyright The University of Lausanne expressly draws the attention of users to the fact that all documents published in the SERVAL Archive are protected by copyright in accordance with federal law on copyright and similar rights (LDA). Accordingly it is indispensable to obtain prior consent from the author and/or publisher before any use of a work or part of a work for purposes other than personal use within the meaning of LDA (art. 19, para. 1 letter a). Failure to do so will expose offenders to the sanctions laid down by this law. -

Fishes-Of-The-Salish-Sea-Pp18.Pdf
NOAA Professional Paper NMFS 18 Fishes of the Salish Sea: a compilation and distributional analysis Theodore W. Pietsch James W. Orr September 2015 U.S. Department of Commerce NOAA Professional Penny Pritzker Secretary of Commerce Papers NMFS National Oceanic and Atmospheric Administration Kathryn D. Sullivan Scientifi c Editor Administrator Richard Langton National Marine Fisheries Service National Marine Northeast Fisheries Science Center Fisheries Service Maine Field Station Eileen Sobeck 17 Godfrey Drive, Suite 1 Assistant Administrator Orono, Maine 04473 for Fisheries Associate Editor Kathryn Dennis National Marine Fisheries Service Offi ce of Science and Technology Fisheries Research and Monitoring Division 1845 Wasp Blvd., Bldg. 178 Honolulu, Hawaii 96818 Managing Editor Shelley Arenas National Marine Fisheries Service Scientifi c Publications Offi ce 7600 Sand Point Way NE Seattle, Washington 98115 Editorial Committee Ann C. Matarese National Marine Fisheries Service James W. Orr National Marine Fisheries Service - The NOAA Professional Paper NMFS (ISSN 1931-4590) series is published by the Scientifi c Publications Offi ce, National Marine Fisheries Service, The NOAA Professional Paper NMFS series carries peer-reviewed, lengthy original NOAA, 7600 Sand Point Way NE, research reports, taxonomic keys, species synopses, fl ora and fauna studies, and data- Seattle, WA 98115. intensive reports on investigations in fi shery science, engineering, and economics. The Secretary of Commerce has Copies of the NOAA Professional Paper NMFS series are available free in limited determined that the publication of numbers to government agencies, both federal and state. They are also available in this series is necessary in the transac- exchange for other scientifi c and technical publications in the marine sciences. -
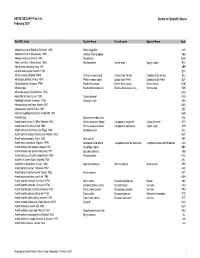
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste