Memoire Chekroud Hassina.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

La Flore Endémique Du Nord-Est Algérien Face À La Menace Des Espèces Envahissantes
Acta Botanica Malacitana 45 (2020). 67-79 Artículo DOI: http://dx.doi.org/10.24310/abm.v45i0.6138 La flore endémique du Nord-Est algérien face à la menace des espèces envahissantes Nora Sakhraoui 1 *, Ratiba Boussouak 1, Sophia Metallaoui 1 , Azzedine Chefrour 2 et Azzedine Hadef 1 1 * Département des Sciences de la Nature et de la Vie (SNV). Faculté des Sciences. Université 20 Aout 1955. BP 26 Route d‘El-Hadaiek. Skikda 21000 (Algérie). E-mail: [email protected] 2 Département de Biologie. Faculté des Sciences de la Nature et de la Vie. Université Mohamed Cherif Messaadia. Souk Ahras 41000 (Algérie). Correspondencia Résumé Nora Sakhraoui e-mail: [email protected] Recibido: 11 abril 2019 Nous avons établi pour la première fois dans la région de Skikda, les listes (liste Aceptado: 10 marzo 2020 actualisée et liste des taxons à rechercher) de la flore endémique et des espèces Publicado on-line: 17 julio 2020 naturalisées jugées envahissantes en méditerranée, représentant une menace Editado por: Teresa Navarro potentielle pour cette flore, en réalisant des prospections au niveau de douze communes. Cela a conduit à l’identification de 64 taxons endémiques dont plus de la moitié se trouve dans la liste actualisée (38 taxons). Ces plantes appartiennent à 26 familles, 46 genres et se répartissent en 50 espèces, 11 sous- espèces et 3 variétés. Les endémiques algéro-tunisiennes sont les plus abondantes (30 taxons). 11 espèces envahissantes en méditerranée sont naturalisées dans notre région dont 5 colonisent des milieux naturels particulièrement riches en espèces endémiques. L’Acacia saligna, Carpobrotus edulis et Opuntia ficus-indica sont les principales espèces menaçantes de cette richesse biologique. -

Le Cercueil Du Vivant ». Un Habitat Algérien Aux Limites De L
Document généré le 27 sept. 2021 14:57 Cahiers de géographie du Québec « Le cercueil du vivant ». Un habitat algérien aux limites de l’insupportable “The Coffin of the Living.” An Algerian Habitat Bordering on the Unbearable Karima Messaoudi Volume 51, numéro 143, septembre 2007 Résumé de l'article La dynamique de formation de nouvelles territorialités rurales, la manière URI : https://id.erudit.org/iderudit/016597ar dont est aujourd’hui habité le territoire rural, plus précisément la relation DOI : https://doi.org/10.7202/016597ar entre la morphologie de l’habitat et la dynamique du territoire dans lequel il s’inscrit, sont au centre de cet article. Dans la vallée du Saf-Saf (wilaya de Aller au sommaire du numéro Skikda), le territoire rural connaît aujourd’hui des problèmes de recomposition territoriale largement liés à l’état d’insécurité marquant la décennie 1990. Contraintes de quitter leurs terres et leurs demeures pour se rapprocher d’axes Éditeur(s) de développement plus sûrs, les populations rurales en ont été particulièrement touchées, dans leur mode de vie et d’habitat. À la diversité Département de géographie de l'Université Laval harmonieuse du territoire rural algérien s’est substituée une diversité confuse de territoires qu’interpénètrent les rejaillissements de la crise urbaine sur les ISSN campagnes et les répercutions humaines et spatiales des troubles de la période dite de tragédie nationale. 0007-9766 (imprimé) 1708-8968 (numérique) Découvrir la revue Citer cet article Messaoudi, K. (2007). « Le cercueil du vivant ». Un habitat algérien aux limites de l’insupportable. Cahiers de géographie du Québec, 51(143), 137–154. -
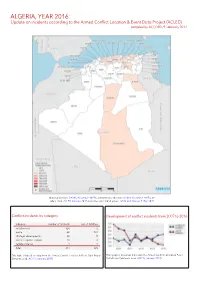
Algeria, Year 2016: Update on Incidents According to the Armed Conflict Location & Event Data Project (ACLED)
ALGERIA, YEAR 2016: Update on incidents according to the Armed Conflict Location & Event Data Project (ACLED) compiled by ACCORD, 9 February 2017 National borders: GADM, November 2015b; administrative divisions: GADM, November 2015a; in- cident data: ACLED, January 2017; coastlines and inland waters: Smith and Wessel, 1 May 2015 Conflict incidents by category Development of conflict incidents from 2007 to 2016 category number of incidents sum of fatalities riots/protests 324 2 battle 48 122 strategic developments 28 0 violence against civilians 10 4 remote violence 4 1 total 414 129 This table is based on data from the Armed Conflict Location & Event Data Project This graph is based on data from the Armed Conflict Location & Event (datasets used: ACLED, January 2017). Data Project (datasets used: ACLED, January 2017). ALGERIA, YEAR 2016: UPDATE ON INCIDENTS ACCORDING TO THE ARMED CONFLICT LOCATION & EVENT DATA PROJECT (ACLED) COMPILED BY ACCORD, 9 FEBRUARY 2017 LOCALIZATION OF CONFLICT INCIDENTS Note: The following list is an overview of the incident data included in the ACLED dataset. More details are available in the actual dataset (date, location data, event type, involved actors, information sources, etc.). In the following list, the names of event locations are taken from ACLED, while the administrative region names are taken from GADM data which serves as the basis for the map above. In Adrar, 11 incidents killing 0 people were reported. The following locations were affected: Adrar, Aougrout, Bordj Badji Mokhtar. In Alger, 34 incidents killing 0 people were reported. The following locations were affected: Ain Benian, Algiers, Bab El Oued, Draria, El Hamiz, Rouiba. -

Harmonisation Offre De Formation Master
RÉPUBLIQUE ALGÉRIENNE DÉMOCRATIQUE ET POPULAIRE MINISTERE DE L’ENSEIGNEMENT SUPERIEUR ET DE LA RECHERCHE SCIENTIFIQUE HARMONISATION OFFRE DE FORMATION MASTER Professionnel Établissement Faculté / Institut Département Sciences Université 20 Août 1955 Sciences Agronomiques Skikda Domaine : Sciences de la Nature et de la Vie Filière : Sciences Agronomique Spécialité : AMENAGEMENT HYDRO AGRICOLE Année universitaire : 2016/2017 Établissement : Université 20 Août 1955 Skikda Intitulé du master : AMENAGEMENT HYDRO AGRICOLE Page 1 Année universitaire : 2016/ 2017 ﺍﻟﺠﻤﻬﻭﺭﻴﺔ ﺍﻟﺠﺯﺍﺌﺭﻴﺔ ﺍﻟـﺩﻴﻤﻘﺭﺍﻁﻴـﺔ ﺍﻟـﺸﻌﺒﻴــﺔ ﻭﺯﺍﺭﺓ ﺍﻟﺘﻌﻠﻴــﻡ ﺍﻟﻌﺎﻟــﻲ ﻭﺍﻟﺒﺤــﺙ ﺍﻟﻌﻠﻤــﻲ ﻤﻭﺍﺀﻤﺔ ﻋﺭﺽ ﺘﻜﻭﻴﻥ ﻤﺎﺴﺘﺭ ﻤﻬﻨﻲ ﺍﻟﻤﺅﺴﺴﺔ ﺍﻟﻜﻠﻴﺔ/ ﺍﻟﻤﻌﻬﺩ ﺍﻟﻘﺴﻡ ﺠﺎﻤﻌﺔ 20 ﺃﻭﺕ 1955 ﺍﻟﻌﻠﻭﻡ ﺍﻟﻌﻠﻭﻡ ﺍﻟﻔﻼﺤﻴﺔ ﺴﻜﻴﻜﺩﺓ ﺍﻟﻤﻴﺩﺍﻥ : ﻋﻠﻡ ﺍﻟﻁﺒﻴﻌﺔ ﻭ ﺍﻟﺤﻴﺎﺓ ﺍﻟﺸﻌﺒﺔ: ﻋﻠﻭﻡ ﻓﻼﺤﻴﺔ ﺍﻟﺘﺨﺼﺹ: ﺘﻬﻴﺌﺔ ﺍﻟﺯﺭﺍﻋﺔ ﻭ ﺍﻟﺴﻘﻲ ﺍﻟﺴﻨﺔ ﺍﻟﺠﺎﻤﻌﻴﺔ: 2017/2016 Établissement : Université 20 Août 1955 Skikda Intitulé du master : AMENAGEMENT HYDRO AGRICOLE Page 2 Année universitaire : 2016/ 2017 SOMMAIRE I - Fiche d’identité du Master ------------------------------------------------------------------ 1 - Localisation de la formation ------------------------------------------------------------------ 2 - Partenaires de la formation--------------------------------------------------------------- 3 - Contexte et objectifs de la formation---------------------------------------------------------- A - Conditions d’accès ------------------------------------------------------------------ B - Objectifs de la formation --------------------------------------------------------- -

Algérie (République Algérienne Démocratique Et Populaire)
Algérie (République algérienne démocratique et populaire) I. Dispositions relatives à la transmission des actes Cadre juridique : Protocole judiciaire signé le 28 août 1962 entre le Gouvernement de la République française et l’Exécutif provisoire algérien (Décret n°62-1020 portant publication des Protocoles, Conventions et Accords signés le 28 août 1962 entre le Gouvernement de la République française et l’Exécutif provisoire algérien – Journal officiel du 30 août 1962) Le protocole prévoit un mode de transmission principal (article 21) : L’autorité française compétente (l’huissier de justice ou le greffe lorsqu’il est compétent), transmet sa demande au moyen du formulaire de transmission, accompagné de l’acte à notifier, directement au parquet dans le ressort duquel se trouve le destinataire de l’acte. Le protocole prévoit des modes de transmission alternatifs (articles 21 et 25) : - Notification par voie consulaire directe par les agents consulaires ou diplomatiques français aux ressortissants français (article 21 alinéa 2). L’acte est alors remis au parquet français territorialement compétent pour transmission au Ministère de la Justice (Bureau du droit de l’Union, du droit international privé et de l’entraide civile) au moyen du formulaire de transmission. - Faculté pour les intéressés résidant sur le territoire français de faire effectuer directement, par les soins des officiers ministériels algériens, des significations ou remises d’actes aux personnes résidant en Algérie (article 25). *** IMPORTANT : • Les dispositions du Protocole judiciaire précité ne prévoient pas de possibilité de no- tification d’acte par voie postale directement à son destinataire en Algérie. • Les dispositions du Protocole judiciaire précité n’exigent pas de traduction des actes transmis aux fins de notification. -

Case of Watersheds Kebir West Safsaf and Guebli Rivers, Skikda
View metadata, citation and similar papers at core.ac.uk brought to you by CORE provided by Springer - Publisher Connector Appl Water Sci (2013) 3:351–357 DOI 10.1007/s13201-013-0085-2 ORIGINAL ARTICLE Assessment and management of water resources in Northeastern Algeria: case of watersheds Kebir West Safsaf and Guebli rivers, Skikda Titi Benrabah Samia • Kherici Bousnoubra Houria • Kherici Nacer • Cote Marc Received: 24 April 2012 / Accepted: 28 January 2013 / Published online: 26 February 2013 Ó The Author(s) 2013. This article is published with open access at Springerlink.com Abstract In Algeria, as in many other parts of the world, Introduction population growth, rapid urbanization, and economic development weigh heavily on water resources. In order to Fresh water is essential to life, the environment, and to support better manage these resources, this paper reports a detailed productive activities, is not an infinite resource. It is unequally estimate of groundwater and superficial water of Skikda distributed by nature on the surface of the globe. Currently, 1.1 region, for an appropriate management and adequate use of billion people; (17 %) of the population lack access to safe this resource. Located in north east of Algeria, the study water while 2.4 billion people (40 %) lack adequate sanita- area is composed of three watersheds, covering an area of tion. The majority of affected people live in Africa and Asia. approximately 4,138 km2. The groundwater is abundant in Furthermore, population growth, rapid urbanization, and the region, represented mainly by the alluvial deposits economic development weigh heavily on water resources. -

Le Cercueil Du Vivant ». Un Habitat Algérien Aux Limites De L
Document generated on 10/02/2021 2:34 a.m. Cahiers de géographie du Québec « Le cercueil du vivant ». Un habitat algérien aux limites de l’insupportable “The Coffin of the Living.” An Algerian Habitat Bordering on the Unbearable Karima Messaoudi Volume 51, Number 143, septembre 2007 Article abstract The dynamic formation of new rural territori-alities and the way in which URI: https://id.erudit.org/iderudit/016597ar rural territorialities are inhabited today, more precisely the relationship DOI: https://doi.org/10.7202/016597ar between the morphology of the habitat and the dynamics of the territory in which it is located, are the focal issues of this article. In the valley of Saf-Saf See table of contents (wilaya of Skikda), rural territories are currently experiencing problems of territorial recomposition largely related to the state of insecurity marking the decade of the 1990s. Forced to leave their home ground and residences to Publisher(s) approach more secure axes of development, the rural populations were particularly victimized by this insecurity, both as regards their habitat and Département de géographie de l'Université Laval their way of life. The harmonious diversity of rural Algeria has been replaced by a confused diversity of territories whose reflections of the urban crisis ISSN interpenetrate in the countryside and reflect the human and spatial disorders of the “national tragedy.” 0007-9766 (print) 1708-8968 (digital) Explore this journal Cite this article Messaoudi, K. (2007). « Le cercueil du vivant ». Un habitat algérien aux limites de l’insupportable. Cahiers de géographie du Québec, 51(143), 137–154. -

Une Gestion a La Crise D'eau a Skikda
LE RENFORCEMENT DES CAPACITES DE STOCKAGE : UNE GESTION A LA CRISE D’EAU A SKIKDA (EST ALGERIEN) Tandjir Larbi Université du 20 Août 1955. Faculté des Sciences de l’Ingénieur. Département de Biologie. Laboratoire d’Eco Toxicologie -LET- B. P 26, Route El Hadaiek, 21000 Skikda -Algérie. Tél/Fax 038 70 10 16. E. mail [email protected] Mobile 07 96 17 70 96 RESUME En matière d’hydraulique, l’Algérie comprend cinq bassins Hydrographiques : 1. l’Oranie - Chott - Chergui, 2. l’Algérois - Hodna - Soumman, 3. le Constantinois - Mellégue - Seybousse, 4. le Cheliff - Zahrez, 5. et le Sahara. Pour minimiser les crises du manque d’eau, le Ministère des Ressources Hydriques a débloqué (2007) une enveloppe de 150 106 de dinars pour l'amélioration des infrastructures hydrauliques où la déperdition est évaluée à 40 %. Une partie est réservée à la construction de nouveaux barrages, la réduction de l'envasement des barrages, le traitement des eaux usées, la prévention des fuites et des gaspillages. A cela s’ajoutent 53. 109 de dinars pour réparer les quelques 30 % de conduites d'eau qui ne répondent pas aux critères de qualité des eaux. Des projets d’édification de réservoirs pourraient répondre à l'objectif du MRH de 12 109 m3 d'eau collectés chaque année servant à l’AEP. Parmi ces projets, la région de Skikda en bénéficie. Elle fait partie du 3e bassin hydrographique du Constantinois et reçoit une précipitation moyenne annuelle de 800 mm avec une évaporation avoisinant les 700 mm. Elle est dotée de deux anciens barrages retenant un volume d’eau régularisable pour : Zerdazas (32.106 m3 an-1) qui est envasé à 75 % et les eaux de Guenitra (48.106 m3 an-1) qui sont contaminées par les résidus métallifères de l’ex mine de fer de Sidi Kambar. -

(Lam.) Polyphenols Cicatrizing Activity on Experimental Thermal Burns in New Zealand Rabbits
OnLine Journal of Biological Sciences Original Research Paper Evaluation of the Cytisus Triflorus (Lam.) Polyphenols Cicatrizing Activity on Experimental Thermal Burns in New Zealand Rabbits 1Sihem Khadri, 1Nafissa Boutefnouchet, 2Youcef Hadef and 3,4 Zouhir Djerrou 1 Laboratory of Applied Microbiology and Biochemistry , Department of Biochemistry , Faculty of Sciences , Badji Mokhtar University , Annaba , Algeria 2 Chemistry Analytical Laboratory , Department of Pharmacy , Faculty of Medicine , Badji Mokhtar University , Annaba , Algeria 3 Pharmacotoxicology Laboratory , Institute of Veterinary Sciences , Mentouri Constantine University , Algeria 4 th Department of Nature and Life Sciences , Faculty of Sciences , University of August 20 , 1955 Skikda , Algeria Article history Abstract: The present study aimed to evaluate the healing properties of the Received: 25-01-2018 medicinal plant Cytisus triflorus widely used in the traditional treatment of Revised: 01-04-2018 wound healing. The principle of study is the application of the polyphenol Accepted: 11-05-2018 extract of this plant prepared with vaseline in the form of a dermal ointment on thermal burns of second deep degree (circular of 379.94mm 2 in Corresponding Author: diameter) previously caused experimentally by a hot cylindrical metal on Zouhir Djerrou Department of Nature and Life the backs of new Zealand rabbits. Each rabbit receives four burns two Sciences, Faculty of Sciences, dorsal and two lumbar which were treated immediately after burning with a University of August 20th, quantity of 0.5 g of vaseline (positive control), 0.5 g of commercial 1955 Skikda, Algeria ointment skin MEBO (reference), 0.5 g of poly phenolic extract and Email: [email protected] untreated burn served as a negative control. -

Évaluation De La Satisfaction Des Usages De L'eau D'un Point De Vue
Rev. Sci. Technol., Synthèse 33: 72 - 81 (2016) I. Mecibah & D. Zouini. Évaluation de la satisfaction des usages de l’eau d’un point de vue quantitatif et qualitatif du bassin versant d’Oued Guebli (Nord-Est algérien) Evaluation of satisfaction with water users from a quantitative and qualitative point of view in the Guebli river basin (North east Algeria) Ilyes Mecibah*, Derradji Zouini Laboratoire de Géologie, Université Badji Mokhtar Annaba, BP.12, Annaba, 23000, Algérie. Soumis le 18/04/2016 Révisé le 24/06/2016 Accepté le 08/09/2016 ملخص انهذف مه هذي انذراست هى تقييم معذل انرظا نتزويذ مستخذمي انمياي مه مياي صانحت نهشرب مياي انسقي ومياي راث استعمال صىاعي مه انىاحيت انكميت ومه انىاحيت انىىعيت. و بعذ هذي انذراست تبيه ان تقييم وحساب معذل انرظا مه مىظىر كمي و وىعي بانىسبت نهتزويذ بانمياي انصانحت نهشرب هى اﻻكثر متابعت و تحكما مه باقي اﻻستعماﻻث اﻷخري وﻻحظىا ان انبهذياث انجبهيت واتي تعتمذ عهً انمىابع بشكم اساسً وبعط انبهذياث انتي تعتمذ عهً انمياي انجىفيت هي انتي تسجم معذل رظا ظعيف في انتزويذ بانمياي انصانحت نهشرب عهً انمستىي انكمي حانيا ويزداد هذا انمعذل ظعفا عهً انمستىي انمتىسط خاصت ان هذي انمىاطق نم تبذأ حتً اﻻن في انبحث عهً مصادرجذيذة الكلمات المفتاحية : انحىض انهيذروغرافي - واد انقبهي - معذل انرظا- انتسيير انمتكامم - انمىارد انمائيت. Résumé L’objectif de cette étude est d’évaluer le taux de satisfaction des usages de l’eau du bassin versant de Guebli d’un point de vue quantitatif et qualitatif (les calculs ont été exécutés en utilisant le logiciel WEAP). L’analyse des résultats montre que l’utilisation la mieux suivie et qui a pu faire l’objet de propositions de méthodes demeure l’alimentation en eau potable. -

Centre Antipollution Marine À Skikda Analyse Thématique
République Algérienne Démocratique et Populaire Ministère de l‘Enseignement Supérieur et de la Recherche Scientifique UNIVERSITÉ ABOU BEKR BELKAID DE TLEMCEN FACULTÉ DE TECHNOLOGIE DÉPARTEMENT D‘ARCHITECTURE MÉMOIRE DE MASTER EN ARCHITECTURE OPTION : Architecture et technologie THEMATIQUE : Architecture et Risque dans le bâtiment CENTRE ANTIPOLLUTION MARINE A SKIKDA Soutenu le 03/07/2017 devant le jury composé de : Mr OUISSI N. Président Professeur Université de Tlemcen Mr KHATTABI L. Examinateur 1 MA(A) Université de Tlemcen Mr HAMDAN O. Examinateur 2 Archi Université de Tlemcen Dr HAMMA W. Encadreur MC(B) Université de Tlemcen Mr BENDIOUIS K. Co-encadreur Archi Université de Tlemcen Présenté par : Mme TEFIANI Naima Année académique: 2016-2017 Remerciements En premier lieu, j‘exprime toute ma gratitude à notre dieu, qui m‘a éclairé le chemin et m‘a offert la confiance et le courage pour accomplir ce modeste travail. Je tiens à remercier vivement et sincèrement mon encadreur, le docteur: HAMMA Walid pour avoir accepté de m‘encadrer, mon Co- encadreur Mr : BENDIOUIS Karim et pour leurs conseils et, surtout pour leurs compréhensions. Je tiens à remercier monsieur le président OUISSI N et monsieur KHETTABI L et monsieur HAMDAN O pour avoir accepté de présider et examiner mo travail. Je tiens à remercier: tous les enseignants du département d‘architecture, université ABOU BEKR BELKAID Tlemcen. A tous mes amies et mes collègues pour leurs soutiens moraux et leurs conseils surtout à Melle BOUDALIA Nadia, Melle YEBDRI Fadela et Mr DERFOUF Abdelkader. Je tiens à remercier, tous ceux qui m‘ont aidé de près ou de loin à faire ce travail. -

ALGERIA, FOURTH QUARTER 2016: Update on Incidents According to the Armed Conflict Location & Event Data Project (ACLED) Compiled by ACCORD, 8 February 2017
ALGERIA, FOURTH QUARTER 2016: Update on incidents according to the Armed Conflict Location & Event Data Project (ACLED) compiled by ACCORD, 8 February 2017 National borders: GADM, November 2015b; administrative divisions: GADM, November 2015a; in- cident data: ACLED, January 2017; coastlines and inland waters: Smith and Wessel, 1 May 2015 Development of conflict incidents from December Conflict incidents by category 2014 to December 2016 category number of incidents sum of fatalities riots/protests 124 0 strategic developments 7 0 battle 5 9 violence against civilians 3 4 total 139 13 This table is based on data from the Armed Conflict Location & Event Data Project (datasets used: ACLED, January 2017). This graph is based on data from the Armed Conflict Location & Event Data Project (datasets used: ACLED, January 2017). ALGERIA, FOURTH QUARTER 2016: UPDATE ON INCIDENTS ACCORDING TO THE ARMED CONFLICT LOCATION & EVENT DATA PROJECT (ACLED) COMPILED BY ACCORD, 8 FEBRUARY 2017 LOCALIZATION OF CONFLICT INCIDENTS Note: The following list is an overview of the incident data included in the ACLED dataset. More details are available in the actual dataset (date, location data, event type, involved actors, information sources, etc.). In the following list, the names of event locations are taken from ACLED, while the administrative region names are taken from GADM data which serves as the basis for the map above. In Adrar, 1 incident killing 0 people was reported. The following location was affected: Adrar. In Alger, 8 incidents killing 0 people were reported. The following locations were affected: Algiers, Draria, Rouiba. In Annaba, 3 incidents killing 0 people were reported.