TESIS Doctor En Ciencias
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-

The Recent Molluscan Marine Fauna of the Islas Galápagos
THE FESTIVUS ISSN 0738-9388 A publication of the San Diego Shell Club Volume XXIX December 4, 1997 Supplement The Recent Molluscan Marine Fauna of the Islas Galapagos Kirstie L. Kaiser Vol. XXIX: Supplement THE FESTIVUS Page i THE RECENT MOLLUSCAN MARINE FAUNA OF THE ISLAS GALApAGOS KIRSTIE L. KAISER Museum Associate, Los Angeles County Museum of Natural History, Los Angeles, California 90007, USA 4 December 1997 SiL jo Cover: Adapted from a painting by John Chancellor - H.M.S. Beagle in the Galapagos. “This reproduction is gifi from a Fine Art Limited Edition published by Alexander Gallery Publications Limited, Bristol, England.” Anon, QU Lf a - ‘S” / ^ ^ 1 Vol. XXIX Supplement THE FESTIVUS Page iii TABLE OF CONTENTS INTRODUCTION 1 MATERIALS AND METHODS 1 DISCUSSION 2 RESULTS 2 Table 1: Deep-Water Species 3 Table 2: Additions to the verified species list of Finet (1994b) 4 Table 3: Species listed as endemic by Finet (1994b) which are no longer restricted to the Galapagos .... 6 Table 4: Summary of annotated checklist of Galapagan mollusks 6 ACKNOWLEDGMENTS 6 LITERATURE CITED 7 APPENDIX 1: ANNOTATED CHECKLIST OF GALAPAGAN MOLLUSKS 17 APPENDIX 2: REJECTED SPECIES 47 INDEX TO TAXA 57 Vol. XXIX: Supplement THE FESTIVUS Page 1 THE RECENT MOLLUSCAN MARINE EAUNA OE THE ISLAS GALAPAGOS KIRSTIE L. KAISER' Museum Associate, Los Angeles County Museum of Natural History, Los Angeles, California 90007, USA Introduction marine mollusks (Appendix 2). The first list includes The marine mollusks of the Galapagos are of additional earlier citations, recent reported citings, interest to those who study eastern Pacific mollusks, taxonomic changes and confirmations of 31 species particularly because the Archipelago is far enough from previously listed as doubtful. -

(Approx) Mixed Micro Shells (22G Bags) Philippines € 10,00 £8,64 $11,69 Each 22G Bag Provides Hours of Fun; Some Interesting Foraminifera Also Included
Special Price £ US$ Family Genus, species Country Quality Size Remarks w/o Photo Date added Category characteristic (€) (approx) (approx) Mixed micro shells (22g bags) Philippines € 10,00 £8,64 $11,69 Each 22g bag provides hours of fun; some interesting Foraminifera also included. 17/06/21 Mixed micro shells Ischnochitonidae Callistochiton pulchrior Panama F+++ 89mm € 1,80 £1,55 $2,10 21/12/16 Polyplacophora Ischnochitonidae Chaetopleura lurida Panama F+++ 2022mm € 3,00 £2,59 $3,51 Hairy girdles, beautifully preserved. Web 24/12/16 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 30mm+ € 4,00 £3,45 $4,68 30/04/21 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 27.9mm € 2,80 £2,42 $3,27 30/04/21 Polyplacophora Ischnochitonidae Stenoplax limaciformis Panama F+++ 16mm+ € 6,50 £5,61 $7,60 Uncommon. 24/12/16 Polyplacophora Chitonidae Acanthopleura gemmata Philippines F+++ 25mm+ € 2,50 £2,16 $2,92 Hairy margins, beautifully preserved. 04/08/17 Polyplacophora Chitonidae Acanthopleura gemmata Australia F+++ 25mm+ € 2,60 £2,25 $3,04 02/06/18 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 41mm+ € 4,00 £3,45 $4,68 West Indian 'fuzzy' chiton. Web 24/12/16 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 32mm+ € 3,00 £2,59 $3,51 West Indian 'fuzzy' chiton. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 44mm+ € 5,00 £4,32 $5,85 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F++ 35mm € 2,50 £2,16 $2,92 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 29mm+ € 3,00 £2,59 $3,51 Caribbean. -

Further Records of Penaeoidea from the East Coast of South Africa
Further records of Penaeoidea from the East coast of South Africa w. Emmerson Department of Zoology, University of Port Elizabeth, Port Elizabeth Fifty-four specimens of ten penaeoid species were Identified. Apart from commercial operations, Penaeoidea have Of particular interest was the finding of pelagic juveniles of been described and collected from South African waters two species, Funchalia (Funchalia) vil/osa and Penaeus since the beginning of this century (Stebbing 1914; marginatus. CaIman 1925; Barnard 1947, 1950; Joubert & Davies S. Afr. J. Zool. 1981,16: 132 -136 1966; Kensley 1968, 1969, 1977; Champion 1973; Ivanov Vier-en-vyftig eksemplare van tien Penaeoldea-spesies is & Hassan 1976b)_ The aim of the present work is to ge"identifiseer. Die voorkoms van onvolwasse individue van die record new localities for a clearer knowledge of distribu twee spesies Funchalia (Funchalia) vil/osa en Penaeus tion, especially for recently recorded species such as marginatus was van besondere belang. Aristeus virilis and Funchalia (Funchalia) vi/losa (Kensley S.-Afr. Tydskr. Dlerk. 1981, 16: 132 -136 1977), and to contribute to juvenile pelagic penaeoid ecology, of which very little is known_ The specimens are lodged in the South African Museum, Cape Town. ) 0 1 0 Methods 2 d A number of penaeoids were collected between 1967 and e t a 1973, mainly by trawlers operating off Durban, at depths d ( between 92 and 700 m with mesh diameters of 2,5 (ex r e ploratory) to 12,5 (commercial) cm_ Fifty-four specimens h s i of 10 penaeoid species were identified. The classification l b system used was that established by Perez Farfante u P (1977a) where previous subfamilies are elevated to e families of the superfamily Penaeoidea. -

Proceedings of the United States National Museum
THE SHELLS OF THE TEES MARIAS AKD OTHER LOCAL- ITIES ALOM; THE SHORES OF L(JWER CALIFORNIA AND THE GULF OF CALIFORNIA. By Robert E. C. Stearns, Ph. D., Adjunct Curator of the Department of Mollusks. In the spring of 1876, Mr. W. J. Fisher, of San Francisco, who had previously, in 1873, been connected as Naturalist with the IT. S. S. Tuscarora Telegraph Sounding Expedition, under Commander George E. Belknap, conceived the idea of chartering or purchasing a small vessel and making an investigation of the shores and islauds of Lower California and the Gulf of California in the interest of natural history. Through the generosity of Mr. Fisher, the greater part of the mollusks collected by him were given to me, and became a part of the Stearns Collection, now incorporated into the greater collection of the IT. S. National Museum. Mr. Fisher's collection, though made, as it will be seen, many years ago, has not heretofore ))een brought to notice. Notwithstanding this lapse of time, its value, through the importance of the information it furnishes on the geographical distribution of most of the species enum- erated, has not been impaired by delay in publication, as no subsequent collector has touched at or visited so many localities around the shores of the Gulf and of Lower California, or if any such collection has been made it has not been made known. Many of the localities have not pre- viously been mentioned, either by collectors or authors. The impor- tance of Mr. Fisher's collection, in its bearing upon the Molhisca of the Tres Marias, is worthy of special mention; it would of itself justify the publication of the list, for it exhibits more fully the mollusk-fauna of this interesting and little-known group of islands, and includes a greater number of species than any and all previous publications. -

The Rock Shrimp Genus Sicyonia (Crustacea: Decapoda: Penaeoidea) in the Eastern Pacific
mr ^Sa^ TO w THE ROCK SHRIMP GENUS SICYONIA (CRUSTACEA: DECAPODA: PENAEOIDEA) IN THE EASTERN PACIFIC ISABEL PEREZ FARFANTE1 ABSTRACT The genus Sicyonia is redefined and the 12 species occurring between Monterey Bay, California, and off Pisco, Peru, are treated in detail. A key to species is followed by illustrated species accounts including descriptions, ranges of intraspecific variation with analyses of morphometric data (rostrum to carapace ratio graphically represented for 10 species), and color notes. The size ranges at which males and the minimum sizes at which females attain adulthood are summarized, and ecological notes together with maps illustrating the ranges of the species (six of which have been extended beyond limits previously reported) are included. Sicyonia disparri seems to be restricted to the south and gulf coasts of Baja California and waters offNayarit, Mexico; S. affinis to waters off Costa Rica, Panama, and Colombia; and S. penicillata occurs on the ocean side of Baja California Sur, Mexico, and from the Gulf of California to Costa Rica. Sicyonia ingentis ranges from Monterey Bay to Nayarit, including the Gulf of California. Sicyonia disedwardsi and S. martini occur along the ocean side of Baja California Sur, in the Gulf of California, and southward to Panama, and four others, S. aliaffinis,S. disdorsalis,S. mixta, and S. picta, frequent the same waters, but also reach as far south as Peru. Sicyonia laevigata and S. brevirostris are found on both sides of the Continent, the former at the southern end of the Gulf of California and from off Costa Rica to the Golfo de Panama in the Pacific, and from North Carolina to Santa Catarina, Brazil, in the Atlantic. -

SICYONIIDAE and Sicyonia Typica
click for previous page Sicyoniidae 279 SICYONIIDAE Rock shrimps iagnostic characters: Body robust, rigid, of stony appearance. Rostrum short (not over-reaching Dantennular peduncle, armed with dorsal teeth, ventral margin toothless); bases of eyestalks with styliform projections on their inner surfaces and without a tubercle on their mesial borders. Carapace without postorbital spines; cervical grooves very faint or absent. Last 2 pairs of pereiopods well developed. Sec- ond pair of pleopods in males bearing only appendix masculina;third and fourth pairs of pleopode sin- gle branched. Telson usually armed with a fixed spine on each side of tip. A single well-developed arthrobranch on penultimate thoracic segment. telson Habitat, biology, and fisheries: All of the representatives of this family are marine, but only 2 of the species occurring in the Western Central Atlantic are of economic interest. Remarks: One genus, Sicyonia H. Milne Edwards, 1830, and 43 species, all marine, have been recognized in this family; 2 species occurring in the Western Central Atlantic are of economic interest, Sicyonia brevirostris and Sicyonia typica. Similar families occurring in the area Solenoceridae, Aristeidae and Penaeidae: integument thinner and less rigid; abdomen without deep grooves or tubercles. Further distinguishing characters of these families are the following: Solenoceridae: carapace with postorbital spines; cervical grooves long, usually ending at or close to dorsal midline;endopods of second pair of pleopods in males bearing appendix masculina, appendix interna, and lat- eral projection; 2 well-developed arthrobranchs on penultimate thoracic segment. cervical cervical groove groove postorbital spine Solenoceridae Penaeidae 280 Shrimps Aristeidae: cervical grooves long, ending at or appendix close to dorsal midline; second pair of masculina pleopods in males bearing appendix masculina and appendix interna; spines on each side of tip of telson movable; 2 well-developed arthrobranchs on penultimate thoracic segment. -

Chec List Marine and Coastal Biodiversity of Oaxaca, Mexico
Check List 9(2): 329–390, 2013 © 2013 Check List and Authors Chec List ISSN 1809-127X (available at www.checklist.org.br) Journal of species lists and distribution ǡ PECIES * S ǤǦ ǡÀ ÀǦǡ Ǧ ǡ OF ×±×Ǧ±ǡ ÀǦǡ Ǧ ǡ ISTS María Torres-Huerta, Alberto Montoya-Márquez and Norma A. Barrientos-Luján L ǡ ǡǡǡǤͶǡͲͻͲʹǡǡ ǡ ȗ ǤǦǣ[email protected] ćĘęėĆĈęǣ ϐ Ǣ ǡǡ ϐǤǡ ǤǣͳȌ ǢʹȌ Ǥͳͻͺ ǯϐ ʹǡͳͷ ǡͳͷ ȋǡȌǤǡϐ ǡ Ǥǡϐ Ǣ ǡʹͶʹȋͳͳǤʹΨȌ ǡ groups (annelids, crustaceans and mollusks) represent about 44.0% (949 species) of all species recorded, while the ʹ ȋ͵ͷǤ͵ΨȌǤǡ not yet been recorded on the Oaxaca coast, including some platyhelminthes, rotifers, nematodes, oligochaetes, sipunculids, echiurans, tardigrades, pycnogonids, some crustaceans, brachiopods, chaetognaths, ascidians and cephalochordates. The ϐϐǢ Ǥ ēęėĔĉĚĈęĎĔē Madrigal and Andreu-Sánchez 2010; Jarquín-González The state of Oaxaca in southern Mexico (Figure 1) is and García-Madrigal 2010), mollusks (Rodríguez-Palacios known to harbor the highest continental faunistic and et al. 1988; Holguín-Quiñones and González-Pedraza ϐ ȋ Ǧ± et al. 1989; de León-Herrera 2000; Ramírez-González and ʹͲͲͶȌǤ Ǧ Barrientos-Luján 2007; Zamorano et al. 2008, 2010; Ríos- ǡ Jara et al. 2009; Reyes-Gómez et al. 2010), echinoderms (Benítez-Villalobos 2001; Zamorano et al. 2006; Benítez- ϐ Villalobos et alǤʹͲͲͺȌǡϐȋͳͻͻǢǦ Ǥ ǡ 1982; Tapia-García et alǤ ͳͻͻͷǢ ͳͻͻͺǢ Ǧ ϐ (cf. García-Mendoza et al. 2004). ǡ ǡ studies among taxonomic groups are not homogeneous: longer than others. Some of the main taxonomic groups ȋ ÀʹͲͲʹǢǦʹͲͲ͵ǢǦet al. -

THE FESTIVUS ISSN: 0738-9388 a Publication of the San Diego Shell Club
(?mo< . fn>% Vo I. 12 ' 2 ? ''f/ . ) QUfrl THE FESTIVUS ISSN: 0738-9388 A publication of the San Diego Shell Club Volume: XXII January 11, 1990 Number: 1 CLUB OFFICERS SCIENTIFIC REVIEW BOARD President Kim Hutsell R. Tucker Abbott Vice President David K. Mulliner American Malacologists Secretary (Corres. ) Richard Negus Eugene V. Coan Secretary (Record. Wayne Reed Research Associate Treasurer Margaret Mulliner California Academy of Sciences Anthony D’Attilio FESTIVUS STAFF 2415 29th Street Editor Carole M. Hertz San Diego California 92104 Photographer David K. Mulliner } Douglas J. Eernisse MEMBERSHIP AND SUBSCRIPTION University of Michigan Annual dues are payable to San Diego William K. Emerson Shell Club. Single member: $10.00; American Museum of Natural History Family membership: $12.00; Terrence M. Gosliner Overseas (surface mail): $12.00; California Academy of Sciences Overseas (air mail): $25.00. James H. McLean Address all correspondence to the Los Angeles County Museum San Diego Shell Club, Inc., c/o 3883 of Natural History Mt. Blackburn Ave., San Diego, CA 92111 Barry Roth Research Associate Single copies of this issue: $5.00. Santa Barbara Museum of Natural History Postage is additional. Emily H. Vokes Tulane University The Festivus is published monthly except December. The publication Meeting date: third Thursday, 7:30 PM, date appears on the masthead above. Room 104, Casa Del Prado, Balboa Park. PROGRAM TRAVELING THE EAST COAST OF AUSTRALIA Jules and Carole Hertz will present a slide program on their recent three week trip to Queensland and Sydney. They will also bring a display of shells they collected Slides of the Club Christmas party will also be shown. -

Documents Félix A
Click Here & Upgrade Expanded Features PDF Unlimited Pages CompleteDocuments Félix A. Grana Raffucci. Junio, 2007. NOMENCLATURA DE LOS ORGANISMOS ACUÁTICOS Y MARINOS DE PUERTO RICO E ISLAS VÍRGENES. Volumen 4: Moluscos de Puerto Rico e Islas Vírgenes. Parte 3. Clase Gastropoda Órden Caenogastropoda Familias Eulimidae a Conidae Click Here & Upgrade Expanded Features PDF Unlimited Pages CompleteDocuments CLAVE DE COMENTARIOS: M= organismo reportado de ambientes marinos E= organismo reportado de ambientes estuarinos D= organismo reportado de ambientes dulceacuícolas int= organismo reportado de ambientes intermareales T= organismo reportado de ambientes terrestres L= organismo pelágico B= organismo bentónico P= organismo parasítico en alguna etapa de su vida F= organismo de valor pesquero Q= organismo de interés para el acuarismo A= organismo de interés para artesanías u orfebrería I= especie exótica introducida p=organismo reportado específicamente en Puerto Rico u= organismo reportado específicamente en las Islas Vírgenes de Estados Unidos b= organismo reportado específicamente en las Islas Vírgenes Británicas números= profundidades, en metros, en las que se ha reportado la especie Click Here & Upgrade Expanded Features PDF Unlimited Pages CompleteDocuments INDICE DE FAMILIAS EN ESTE VOLUMEN Aclididae Aclis Buccinidae Antillophos Bailya Belomitra Colubraria Engina Engoniophos Manaria Monostiolum Muricantharus Parviphos Pisania Pollia Cerithiopsidae Cerithiopsis Horologica Retilaskeya Seila Cancellariidae Agatrix Cancellaria Trigonostoma -

The Family Penaeidae(Excluding Genus Penaeus)
SOUTH AFRICAN ASSOCIATION FOR MARINE BIOLOGICAL RESEARCH OCEANOGRAPHIC RESEARCH INSTITUTE Investigational Report No. 58 Th£ Penaeoidea of southeast Africa — The Family Penaeidae (excluding Genus Penaeus) by A.J. de Freitas The Investigational Report series of the Oceanographic Research Institute presents the detailed results of marine biological research. Reports have appeared at irregular intervals since 1961. All manuscripts are submitted for peer review, to national or overseas referees. The Bulletin series of the South African Association for. Marine Biological Research is of general interest and reviews the research and curatorial activities of the Oceanographic Research Institute, Aquarium and Dolphinarium. It is published annually. Both series are available in exchange for relevant publications of other scientific institutions anywhere in the world. All correspondence in this regard should be directed to: The Librarian, Oceanographic Research Institute. P.O. Box 10712. Marine Parade. 4056. Durban. South Africa. SOUTH AFRICAN ASSOCIATION FOR MARINE BIOLOGICAL RESEARCH OCEANOGRAPHIC RESEARCH INSTITUTE Investigational Report No.58 The Penaeoidea of southeast Africa. The Family Penaeidae (excluding Genus Penaeus) by A.J. de Freitas Published by THE OCEANOGRAPHIC RESEARCH INSTITUTE P.O. BOX 10712, MARINE PARADE DURBAN, 4056 SOUTH AFRICA November 1987 Copyright ISBN 0 86989 034 4 ISSN 0078-320X THE PENAEOIDEA OF SOUTHEAST AFRICA: III. The Family Penaeidae (excluding Genus Penaeus) by A.J. DE FREITAS ABSTRACT This is the third monograph of a series of five on the Penaeoidea of southeast Africa and, together with monograph four, deals with the family Penaeidae. The family is represented by nine genera of which eight, with a total of 15 species, are dealt with in this article. -

Australian Species Oe Aristeidae and Benthesicymidae (Penaeoidea: Decapoda)
AUSTRALIAN SPECIES OE ARISTEIDAE AND BENTHESICYMIDAE (PENAEOIDEA: DECAPODA) W. DALL Dall, W. 2001 06 30: Australian species of Aristeidae and Benthesicymidae (Penaeoidea: Decapoda). Memoirs of the Queensland Museum 46(2): 409-441. Brisbane. ISSN 0079-8835. Twelve species of Aristeidae from Australian seas, representing all genera in the family, have been identified (indicates new records): Aristaeomorpha foliacea, Aristaeopsis edwardsiana,*Aristeus mabahissae, A. virilis, Austropenaeus nitidus, *Hemipenaeus carpenteri, *Hepomadus tener, *Parahepomadus vaubani, *Plesiopenaeus armatus, *P. coruscans, *Pseudaristeus kathleenae, *P. sibogae. (Aristeus semidentatus has also been recorded from Australia, but its identity could not be confirmed in existing museum collections). In the Benthesicymidae ten species have been identified: Benthesicymus investigator is, B. urinator, Gennadas bouveri, G. capensis, G. gilchristi, G. incertus, G. kempi, G. propinquus, G. scutatus, G. tinayrei, plus a new subspecies Benthesicymus urinator howensis. Definitions of the 2 families and the genera represented, with keys, are included. Keys to the Indo-West Pacific species are given, together with diagnoses of the Australian species. Zoogeography of the 2 families is discussed briefly. • Indo-West Pacific, Aristeidae, Benthesicymidae, Australia, diagnoses, distribution, zoogeography. W. Dall, Queensland Museum, PO Box 3300, South Brisbane, Queensland4101, Australia; 1 November 2000. Up to the late 19th century all penaeoid deca- Upper antennular flagellum of similar length to the lower pods were included in the Penaeidae. It was and attached apically to the third segment of the peduncle; prosartema well developed and foliaceous recognised, however, that there were major dif- Penaeidae ferences between some groups and Wood-Mason * In some solenocerid genera this could be identified as a (1891) identified 3 distinct deep-water groups in postantennal spine. -
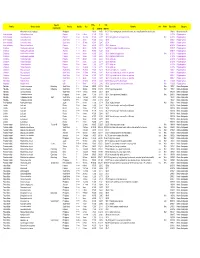
Approx) (Approx) Mixed Micro Shells (22G Bags) Philippines € 10,00 £8,56 $11,71 Each 22G Bag Provides Hours of Fun; Some Interesting Foraminifera Also Included
Special Price £ US$ Family Genus, species Country Quality Size Remarks w/o Photo Date added Category characteristic (€) (approx) (approx) Mixed micro shells (22g bags) Philippines € 10,00 £8,56 $11,71 Each 22g bag provides hours of fun; some interesting Foraminifera also included. 17/06/21 Mixed micro shells Ischnochitonidae Callistochiton pulchrior Panama F+++ 89mm € 1,80 £1,54 $2,11 21/12/16 Polyplacophora Ischnochitonidae Chaetopleura lurida Panama F+++ 2022mm € 3,00 £2,57 $3,51 Hairy girdles, beautifully preserved. Web 24/12/16 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 30mm+ € 4,00 £3,42 $4,68 30/04/21 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 27.9mm € 2,80 £2,40 $3,28 30/04/21 Polyplacophora Ischnochitonidae Stenoplax limaciformis Panama F+++ 16mm+ € 6,50 £5,57 $7,61 Uncommon. 24/12/16 Polyplacophora Chitonidae Acanthopleura gemmata Philippines F+++ 25mm+ € 2,50 £2,14 $2,93 Hairy margins, beautifully preserved. 04/08/17 Polyplacophora Chitonidae Acanthopleura gemmata Australia F+++ 25mm+ € 2,60 £2,23 $3,05 02/06/18 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 41mm+ € 4,00 £3,42 $4,68 West Indian 'fuzzy' chiton. Web 24/12/16 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 32mm+ € 3,00 £2,57 $3,51 West Indian 'fuzzy' chiton. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 44mm+ € 5,00 £4,28 $5,86 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F++ 35mm € 2,50 £2,14 $2,93 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 29mm+ € 3,00 £2,57 $3,51 Caribbean.