Crustacés De La Réunion Décapodes Et Stomatopodes
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Establishment of a New Genus for Arete Borradailei
Zoological Studies 46(4): 454-472 (2007) Establishment of a New Genus for Arete borradailei Coutière, 1903 and Athanas verrucosus Banner and Banner, 1960, with Redefinitions of Arete Stimpson, 1860 and Athanas Leach, 1814 (Crustacea: Decapoda: Alpheidae) Arthur Anker1,* and Ming-Shiou Jeng2 1Smithsonian Tropical Research Institute, Naos Unit 0948, APO AA 34002-0948, USA. E-mail:[email protected] 2Research Center for Biodiversity, Academia Sinica, Taipei 115, Taiwan. E-mail:[email protected] (Accepted October 5, 2006) Arthur Anker and Ming-Shiou Jeng (2007) Establishment of a new genus for Arete borradailei Coutière, 1903 and Athanas verrucosus Banner and Banner, 1960, with redefinitions of Arete Stimpson, 1860 and Athanas Leach, 1814 (Crustacea: Decapoda: Alpheidae). Zoological Studies 46(4): 454-472. Arete borradailei Coutière, 1903 and Athanas verrucosus Banner and Banner, 1960 are transferred to Rugathanas gen. nov., based on several unique features on the chelipeds, 3rd pereiopods, antennules, and mouthparts. The estab- lishment of Rugathanas enables the redefinition of Athanas Leach, 1814 and Arete Stimpson, 1860, and a for- mal revalidation of Arete, formerly a synonym of Athanas. Two important features, the number of pereiopodal epipods and the number of carpal segments of the 2nd pereiopod, are variable within Rugathanas gen. nov., but may be used to distinguish Athanas from Arete. The distribution ranges of R. borradailei (Coutière, 1903) comb. nov. and R. verrucosus (Banner and Banner, 1960) comb. nov. are considerably extended based on recently collected material from the Ryukyu Is., Japan; Kenting, southern Taiwan; and Norfolk I., off eastern Australia. http://zoolstud.sinica.edu.tw/Journals/46.4/454.pdf Key words: Alpheidae, New genus, Athanas, Arete, Indo-Pacific. -
W7192e19.Pdf
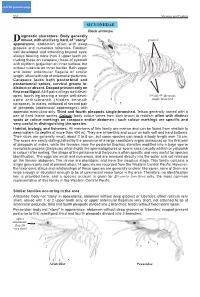
click for previous page 952 Shrimps and Prawns Sicyoniidae SICYONIIDAE Rock shrimps iagnostic characters: Body generally Drobust, with shell very hard, of “stony” grooves appearance; abdomen often with deep grooves and numerous tubercles. Rostrum well developed and extending beyond eyes, always bearing more than 3 upper teeth (in- cluding those on carapace); base of eyestalk with styliform projection on inner surface, but without tubercle on inner border. Both upper and lower antennular flagella of similar length, attached to tip of antennular peduncle. 1 Carapace lacks both postorbital and postantennal spines, cervical groove in- distinct or absent. Exopod present only on first maxilliped. All 5 pairs of legs well devel- 2 oped, fourth leg bearing a single well-devel- 3rd and 4th pleopods 4 single-branched oped arthrobranch (hidden beneath 3 carapace). In males, endopod of second pair 5 of pleopods (abdominal appendages) with appendix masculina only. Third and fourth pleopods single-branched. Telson generally armed with a pair of fixed lateral spines. Colour: body colour varies from dark brown to reddish; often with distinct spots or colour markings on carapace and/or abdomen - such colour markings are specific and very useful in distinguishing the species. Habitat, biology, and fisheries: All members of this family are marine and can be found from shallow to deep waters (to depths of more than 400 m). They are all benthic and occur on both soft and hard bottoms. Their sizes are generally small, about 2 to 8 cm, but some species can reach a body length over 15 cm. The sexes are easily distinguished by the presence of a large copulatory organ (petasma) on the first pair of pleopods of males, while the females have the posterior thoracic sternites modified into a large sperm receptacle process (thelycum) which holds the spermatophores or sperm sacs (usually whitish or yellowish in colour) after mating. -

Guam Crown-Of-Thorns Outbreak Response Plan December 2017 Guam COTS Outbreak Response Plan 1
Guam Crown-of-Thorns Outbreak Response Plan December 2017 Guam COTS Outbreak Response Plan 1 Overview The Guam Crown-of-Thorns sea star (COTS) Outbreak Response Plan was DevelopeD collaboratively by multiple local anD feDeral agencies, incluDing the Bureau of Statistics anD Plans (BSP) anD the Guam Coastal Management Program (GCMP), the Guam Department of Agriculture’s (GDOAG) Division of Aquatic anD WilDlife Resources (DAWR), the Guam Environmental Protection Agency (GEPA), the University of Guam Marine Laboratory (UOGML), the National Oceanic anD Atmospheric Association (NOAA), the National Park Service (NPS), Joint Region Marianas (JRM), anD the U.S. Fish & WilDlife Service (USFWS). The COTS Outbreak Response Plan exists to maximize effectiveness of activities conDucted by the Guam Coral Reef Response Team anD ensure efficient use of resources anD human capital by proviDing a stanDarDizeD framework for responDing to COTS outbreaks. This Document, designed as a working draft that will be continuously updated, includes an in-depth description of Guam’s early warning system for COTS outbreaks, stanDarD operating procedures for response implementation incluDing Detailed assessment anD mitigation protocols, anD recommenDations for post-outbreak management, reef recovery, and restoration approaches. This Document is intenDed for use by coral reef managers anD scientists on Guam, but may also be useful to inDividuals anD groups in other locations impacteD by COTS outbreaks, especially those who are interesteD in Developing COTS outbreak response plans. Objectives of the Guam COTS Response Plan: 1. Summarize impacts of past COTS outbreaks on Guam. 2. ProviDe up-to-date standard operating procedures to be followed before, during, and after COTS outbreaks, including lists of agency assets anD necessary supplies anD Delineation of agency roles. -

109 Annotated Checklist Of
THE RAFFLES BULLETIN OF ZOOLOGY 2010 Supplement No. 23: 109–129 Date of Publication: 31 Oct.2010 © National University of Singapore ANNOTATED CHECKLIST OF ANOMURAN DECAPOD CRUSTACEANS OF THE WORLD (EXCLUSIVE OF THE KIWAOIDEA AND FAMILIES CHIROSTYLIDAE AND GALATHEIDAE OF THE GALATHEOIDEA) PART II – PORCELLANIDAE Masayuki Osawa Research Center for Coastal Lagoon and Environments, Shimane University, 1060 Nishikawatsu-cho, Matsue, Shimane 690-8504, Japan Email: [email protected] Patsy A. McLaughlin Shannon Point Marine Center, Western Washington University, 1900 Shannon Point Road, Anacortes, WA 98221-4042, USA Email: hermit@fi dalgo.net INTRODUCTION Porcellanidae Haworth, 1825 = Porcellaniens H. Milne Edwards, 1837 Ng et al. (2008) and McLaughlin et al. (this volume) referred = Porcellaniadae Randall, 1840 to the “windows” to the literature and the “springboards” for = Porcellanodea Henderson 1888 associating species with their scientifi c names that provided = Porcellainea Holmes, 1900 the foundations for subsequent brachyuran, paguroid and lithodoid research. For the porcellanids, one treatise in particular has provided a similar base upon which virtually all DESCRIPTIVE TERMS AND CURRENT STATUS subsequent porcellanid reports have been patterned. Despite its regional focus, Haig’s (1960) monograph of eastern General morphology. – The general body shape is crab- Pacifi c species included 87 of the 225 species estimated to like and the carapace is well calcifi ed. Regions of the dorsal be present worldwide at the time (Chace, 1951). During the integument are not usually well defi ned. The anterior margin last half century the number of genera has increased from of the carapace is produced into a short rostrum or rostral 14 prior to Haig’s (1960) monograph to 30 and the number lobe. -

Prawn Fauna (Crustacea: Decapoda) of India - an Annotated Checklist of the Penaeoid, Sergestoid, Stenopodid and Caridean Prawns
Available online at: www.mbai.org.in doi: 10.6024/jmbai.2012.54.1.01697-08 Prawn fauna (Crustacea: Decapoda) of India - An annotated checklist of the Penaeoid, Sergestoid, Stenopodid and Caridean prawns E. V. Radhakrishnan*1, V. D. Deshmukh2, G. Maheswarudu3, Jose Josileen 1, A. P. Dineshbabu4, K. K. Philipose5, P. T. Sarada6, S. Lakshmi Pillai1, K. N. Saleela7, Rekhadevi Chakraborty1, Gyanaranjan Dash8, C.K. Sajeev1, P. Thirumilu9, B. Sridhara4, Y Muniyappa4, A.D.Sawant2, Narayan G Vaidya5, R. Dias Johny2, J. B. Verma3, P.K.Baby1, C. Unnikrishnan7, 10 11 11 1 7 N. P. Ramachandran , A. Vairamani , A. Palanichamy , M. Radhakrishnan and B. Raju 1CMFRI HQ, Cochin, 2Mumbai RC of CMFRI, 3Visakhapatnam RC of CMFRI, 4Mangalore RC of CMFRI, 5Karwar RC of CMFRI, 6Tuticorin RC of CMFRI, 7Vizhinjam RC of CMFRI, 8Veraval RC of CMFRI, 9Madras RC of CMFRI, 10Calicut RC of CMFRI, 11Mandapam RC of CMFRI *Correspondence e-mail: [email protected] Received: 07 Sep 2011, Accepted: 15 Mar 2012, Published: 30 Apr 2012 Original Article Abstract Many penaeoid prawns are of considerable value for the fishing Introduction industry and aquaculture operations. The annual estimated average landing of prawns from the fishery in India was 3.98 The prawn fauna inhabiting the marine, estuarine and lakh tonnes (2008-10) of which 60% were contributed by freshwater ecosystems of India are diverse and fairly well penaeid prawns. An additional 1.5 lakh tonnes is produced from known. Significant contributions to systematics of marine aquaculture. During 2010-11, India exported US $ 2.8 billion worth marine products, of which shrimp contributed 3.09% in prawns of Indian region were that of Milne Edwards (1837), volume and 69.5% in value of the total export. -

17 the Crabs Belonging to the Grapsoidea Include a Lot Of
17 SUPERFAMILY GRAPSOIDEA The crabs belonging to the Grapsoidea include a lot of ubiquitous species collected in the mangrove and/or along the coastline. As a result, most of the species listed here under the ‘Coastal Rock-rubble’ biotope of table 2b could be reasonably listed also with marine species. This is particularly true for the Grapsidae: Grapsus, Pachygrapsus, Pseudograpsus, and Thalassograpsus. FAMILY GECARCINIDAE Cardisoma carnifex (Herbst, 1796). Figure 12. – Cardisoma carnifex - Guinot, 1967: 289 (Checklist of WIO species, with mention of Grande Comore and Mayotte). - Bouchard, 2009: 6, 8, Mayotte, Malamani mangrove, 16 April 2008, St. 1, 12°55.337 S, 44°09.263 E, upper mangrove in shaded area, burrow, about 1.5 m depth, 1 male 61×74 mm (MNHN B32409). - KUW fieldwork November 2009, St. 6, Petite Terre, Badamiers spillway, upper littoral, 1 female 53×64 mm (MNHN B32410), 1 male 65×75.5 mm (MNHN B32411); St. 29, Ngouja hotel, Mboianatsa beach, in situ photographs only. Distribution. – Widespread in the IWP. Red Sea, Somalia, Kenya, Tanzania, Mozambique, South Africa, Europa, Madagascar, Comoros, Seychelles, Réunion, Mauritius, India, Taiwan, Japan, Australia, New Caledonia, Fiji, Wallis & Futuna, French Polynesia. Comment. – Gecarcinid land crabs are of large size and eaten in some places (West Indies, Wallis & Futuna, and French Polynesia). In Mayotte, however, they are not much prized for food and are not eaten. Figure 12. Cardisoma carnifex. Mayotte, KUW 2009 fieldwork: A) aspect of station 29, upper littoral Ngouja hotel, Mboianatsa beach; B) same, detail of a crab at the entrance of its burrow; C) St. 6, 1 female 53×64 mm (MNHN B32410); D) probably the same specimen, in situ at St. -

Neopetrolisthes Maculatus
ISSN: 2635 - 2826 Journal of Clinical & Biomedical Research Research Article Open Access Relative Concentrations of Amino Acids in the Exoskeleton of Male and Female Neopetrolisthes Maculatus Adeyeye EI 1*, Idowu OT 2, Akinsola AF 3, Olatunya AM 1, Popoola OK 1, Ayodele O 3 and Gbolagade AY 4 1Department of Chemistry (Analytical Chemistry Unit), Ekiti State University, P.M.B. 5363, Ado-Ekiti, Nigeria 2Department of Chemistry, Afe Babalola University, Ado-Ekiti, Ekiti State, Nigeria 3Department of Industrial Chemistry, Ekiti State University, P.M.B. 5363, Ado-Ekiti, Nigeria 4Central Laboratory, Ekiti State University, P.M.B. 5363, Ado-Ekiti, Nigeria ABSTRACT Amino acid levels in the exoskeleton of the heterosexual samples of Neopetrolisthes maculatus were evaluated. Twenty parameters were reported on; 13 of these values were greater in the female than the male (i.e. 13/20 or 65.0%). Values in female > male were observed in Val, Thr, Lys, Met, Phe, Trp, Gly, Ala, Asp, Arg, Cys, total amino acids and protein. The variations between the male and female amino acid values were low having coefficient of variation percent range of 0.0579-16.9. The amino acid levels were significantly different between the heterosexuals at 0.01r= . Limiting amino acids on the various scoring standards were egg (Cys=0.3172 and 0.3511), provisional essential amino acid scoring pattern (Lys = 0.4145 and 0.4746), preschool child requirements (Lys =0.3930 and 0.4501) and all the three scores were significantly different at 0.01r= . The EAAI1 (compared to soybean) were 1.18 (male) and 1.16 (female), EAAI2 (compared to egg) were 88.5 (male) and 88.3 (female); their corresponding BV were 84.7 and 84.5. -

A Comparative Analysis of Morphological, Physiological, And
AN ABSTRACT OF THE THESIS OF Jonathon Harris Stillman for the degree of Doctor of Philosophy in Zoology presented on December 4, 1998. Title: A Comparative Analysis of Morphological, Physiological, and Biochemical Adaptation to Abiotic Stress in Intertidal Porcelain Crabs, Genus Petrolisthes. Redacted for Privacy Abstract approved: George N. Somero Organismal tolerance to abiotic environmental stresses contributes significantly to setting the distribution limits of organisms, as demonstrated by vertical zonation patterns in the marine intertidal zone. In this thesis, the ultimate (evolutionary) and proximate (mechanistic) causes of tolerance to temperature and emersion stresses associated with the intertidal zone were examined using porcelain crabs, genus Petrolisthes. Species of Petrolisthes from intertidal and subtidal microhabitats of four biogeographic regions of the Eastern Pacific were used in phylogenetically-based comparative analyses of morphological, physiological, and biochemical adaptation to environmental stress. A phylogenetic tree based on the sequence of the 16sRNA gene was developed to facilitate these analyses. Organismal thermal tolerance limits are adapted to match maximal microhabitat temperatures. Acclimation of thermal tolerance limits suggests that temperate intertidal zone species are living close to their thermal maximum in nature. Respiratory responses to emersion vary among species from different vertical zones. Experimental examination of oxygen consumption rates and lactate accumulation during emersion suggests that intertidal species are able to respire in air using thin membranous regions on the ventral meral segments of their legs (leg membranes). Leg membrane size is positively correlated with body size across species, but not within a single species. Evolutionary analyses indicate that leg membranes may not have evolved for purposes of aerial respiration, but their presence may have allowed intertidal and subtidal species to achieve larger body sizes and higher metabolic rates. -

Download-The-Data (Accessed on 12 July 2021))
diversity Article Integrative Taxonomy of New Zealand Stenopodidea (Crustacea: Decapoda) with New Species and Records for the Region Kareen E. Schnabel 1,* , Qi Kou 2,3 and Peng Xu 4 1 Coasts and Oceans Centre, National Institute of Water & Atmospheric Research, Private Bag 14901 Kilbirnie, Wellington 6241, New Zealand 2 Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; [email protected] 3 College of Marine Science, University of Chinese Academy of Sciences, Beijing 100049, China 4 Key Laboratory of Marine Ecosystem Dynamics, Second Institute of Oceanography, Ministry of Natural Resources, Hangzhou 310012, China; [email protected] * Correspondence: [email protected]; Tel.: +64-4-386-0862 Abstract: The New Zealand fauna of the crustacean infraorder Stenopodidea, the coral and sponge shrimps, is reviewed using both classical taxonomic and molecular tools. In addition to the three species so far recorded in the region, we report Spongicola goyi for the first time, and formally describe three new species of Spongicolidae. Following the morphological review and DNA sequencing of type specimens, we propose the synonymy of Spongiocaris yaldwyni with S. neocaledonensis and review a proposed broad Indo-West Pacific distribution range of Spongicoloides novaezelandiae. New records for the latter at nearly 54◦ South on the Macquarie Ridge provide the southernmost record for stenopodidean shrimp known to date. Citation: Schnabel, K.E.; Kou, Q.; Xu, Keywords: sponge shrimp; coral cleaner shrimp; taxonomy; cytochrome oxidase 1; 16S ribosomal P. Integrative Taxonomy of New RNA; association; southwest Pacific Ocean Zealand Stenopodidea (Crustacea: Decapoda) with New Species and Records for the Region. -

The Crabs from Mayotte Island (Crustacea, Decapoda, Brachyura)
THE CRABS FROM MAYOTTE ISLAND (CRUSTACEA, DECAPODA, BRACHYURA) Joseph Poupin, Régis Cleva, Jean-Marie Bouchard, Vincent Dinhut, and Jacques Dumas Atoll Research Bulletin No. 617 1 May 2018 Washington, D.C. All statements made in papers published in the Atoll Research Bulletin are the sole responsibility of the authors and do not necessarily represent the views of the Smithsonian Institution or of the editors of the bulletin. Articles submitted for publication in the Atoll Research Bulletin should be original papers and must be made available by authors for open access publication. Manuscripts should be consistent with the “Author Formatting Guidelines for Publication in the Atoll Research Bulletin.” All submissions to the bulletin are peer reviewed and, after revision, are evaluated prior to acceptance and publication through the publisher’s open access portal, Open SI (http://opensi.si.edu). Published by SMITHSONIAN INSTITUTION SCHOLARLY PRESS P.O. Box 37012, MRC 957 Washington, D.C. 20013-7012 https://scholarlypress.si.edu/ The rights to all text and images in this publication are owned either by the contributing authors or by third parties. Fair use of materials is permitted for personal, educational, or noncommercial purposes. Users must cite author and source of content, must not alter or modify the content, and must comply with all other terms or restrictions that may be applicable. Users are responsible for securing permission from a rights holder for any other use. ISSN: 0077-5630 (online) This work is dedicated to our friend Alain Crosnier, great contributor for crab sampling in Mayotte region between 1958-1971 and author of several important taxonomic contributions in the region. -

Crustacea: Decapoda: Gnathophyllidae)
Memoirs of Museum Victoria 60(2): 237-242 (2003) ISSN 1447-2546 (Print) 1447-2554 (On-line) http://www.museum.vic.gov.au/memoirs Gnathophyllum taylori, a new species of caridean shrimp from south-eastern Australia (Crustacea: Decapoda: Gnathophyllidae) S h a n e T. Ah y o n g Department of Marine Invertebrates, Australian Museum, 6 College St, Sydney, NSW 2010, Australia (shanea@ austmus.gov.au) A b stra c t Ahyong, S. T. 2003. Gnathophyllum taylori, a new species of caridean shrimp from south-eastern Australia (Crustacea: Decapoda: Gnathophyllidae). Memoirs o f Museum Victoria 60(2): 237-242. Anew species of caridean shrimp, Gnathophyllum taylori sp.nov., is described from south-eastern Australia. The new species most closely resembles two Atlantic species, G. modestum Hay, 1917, and G. elegans Risso, 1816, but is readily distinguished by its banded rather than spotted body colour pattern. Gnathophyllum taylori is the third Indo-West Pacific species to be recognised. It differs from G. americanum, with which it can be sympatric, by having fewer and narrower dark bands on the body as well as by the rostral dentition, morphology of the orbit and dactyli of the walking legs. The identity of G. fasciolatum Stimpson, 1860, a junior synonym of G. americanum, is fixed by neotype selection. K eyw ords Crustacea, Decapoda, Caridea, Gnathophyllum taylori, new species Introduction Gnathophyllum taylori sp. nov. The most recent treatment of the caridean genus Figures 1-2 Gnathophyllum Latreille, 1819, recognised eight species Gnathophyllum americanum.—Healy and Yaldwyn, 1970: 46, fig. worldwide with two in the Indo-West Pacific - G. -

Establishment of a New Genus for Arete Borradailei Coutière, 1903
Zoological Studies 46(4): 454-472 (2007) Establishment of a New Genus for Arete borradailei Coutière, 1903 and Athanas verrucosus Banner and Banner, 1960, with Redefinitions of Arete Stimpson, 1860 and Athanas Leach, 1814 (Crustacea: Decapoda: Alpheidae) Arthur Anker1,* and Ming-Shiou Jeng2 1Smithsonian Tropical Research Institute, Naos Unit 0948, APO AA 34002-0948, USA. E-mail:[email protected] 2Research Center for Biodiversity, Academia Sinica, Taipei 115, Taiwan. E-mail:[email protected] (Accepted October 5, 2006) Arthur Anker and Ming-Shiou Jeng (2007) Establishment of a new genus for Arete borradailei Coutière, 1903 and Athanas verrucosus Banner and Banner, 1960, with redefinitions of Arete Stimpson, 1860 and Athanas Leach, 1814 (Crustacea: Decapoda: Alpheidae). Zoological Studies 46(4): 454-472. Arete borradailei Coutière, 1903 and Athanas verrucosus Banner and Banner, 1960 are transferred to Rugathanas gen. nov., based on several unique features on the chelipeds, 3rd pereiopods, antennules, and mouthparts. The estab- lishment of Rugathanas enables the redefinition of Athanas Leach, 1814 and Arete Stimpson, 1860, and a for- mal revalidation of Arete, formerly a synonym of Athanas. Two important features, the number of pereiopodal epipods and the number of carpal segments of the 2nd pereiopod, are variable within Rugathanas gen. nov., but may be used to distinguish Athanas from Arete. The distribution ranges of R. borradailei (Coutière, 1903) comb. nov. and R. verrucosus (Banner and Banner, 1960) comb. nov. are considerably extended based on recently collected material from the Ryukyu Is., Japan; Kenting, southern Taiwan; and Norfolk I., off eastern Australia. http://zoolstud.sinica.edu.tw/Journals/46.4/454.pdf Key words: Alpheidae, New genus, Athanas, Arete, Indo-Pacific.