Variability and Diversity in the Skin of Healthy Dogs: Microbiome, Genome and Environment
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-

Characterization of the Aerobic Anoxygenic Phototrophic Bacterium Sphingomonas Sp
microorganisms Article Characterization of the Aerobic Anoxygenic Phototrophic Bacterium Sphingomonas sp. AAP5 Karel Kopejtka 1 , Yonghui Zeng 1,2, David Kaftan 1,3 , Vadim Selyanin 1, Zdenko Gardian 3,4 , Jürgen Tomasch 5,† , Ruben Sommaruga 6 and Michal Koblížek 1,* 1 Centre Algatech, Institute of Microbiology, Czech Academy of Sciences, 379 81 Tˇreboˇn,Czech Republic; [email protected] (K.K.); [email protected] (Y.Z.); [email protected] (D.K.); [email protected] (V.S.) 2 Department of Plant and Environmental Sciences, University of Copenhagen, Thorvaldsensvej 40, 1871 Frederiksberg C, Denmark 3 Faculty of Science, University of South Bohemia, 370 05 Ceskˇ é Budˇejovice,Czech Republic; [email protected] 4 Institute of Parasitology, Biology Centre, Czech Academy of Sciences, 370 05 Ceskˇ é Budˇejovice,Czech Republic 5 Research Group Microbial Communication, Technical University of Braunschweig, 38106 Braunschweig, Germany; [email protected] 6 Laboratory of Aquatic Photobiology and Plankton Ecology, Department of Ecology, University of Innsbruck, 6020 Innsbruck, Austria; [email protected] * Correspondence: [email protected] † Present Address: Department of Molecular Bacteriology, Helmholtz-Centre for Infection Research, 38106 Braunschweig, Germany. Abstract: An aerobic, yellow-pigmented, bacteriochlorophyll a-producing strain, designated AAP5 Citation: Kopejtka, K.; Zeng, Y.; (=DSM 111157=CCUG 74776), was isolated from the alpine lake Gossenköllesee located in the Ty- Kaftan, D.; Selyanin, V.; Gardian, Z.; rolean Alps, Austria. Here, we report its description and polyphasic characterization. Phylogenetic Tomasch, J.; Sommaruga, R.; Koblížek, analysis of the 16S rRNA gene showed that strain AAP5 belongs to the bacterial genus Sphingomonas M. Characterization of the Aerobic and has the highest pairwise 16S rRNA gene sequence similarity with Sphingomonas glacialis (98.3%), Anoxygenic Phototrophic Bacterium Sphingomonas psychrolutea (96.8%), and Sphingomonas melonis (96.5%). -

Validation of the Asaim Framework and Its Workflows on HMP Mock Community Samples
Validation of the ASaiM framework and its workflows on HMP mock community samples The ASaiM framework and its workflows have been tested and validated on two mock metagenomic data of an artificial community (with 22 known microbial strains). The datasets are available on EBI metagenomics database (project accession number: SRP004311). First we checked that the targeted abundances (based on number of PCR product) from both mock datasets were similar to the effective abundance (by mapping reads on reference genomes). Second, taxonomic and functional results produced by the ASaiM framework have been extensively analyzed and compared to expectations and to results obtained with the EBI metagenomics pipeline (S. Hunter et al. 2014). For these datasets, the ASaiM framework produces accurate and precise taxonomic assignations, different functional results (gene families, pathways, GO slim terms) and results combining taxonomic and functional information. Despite almost 1.4 million of raw metagenomic sequences, these analyses were executed in less than 6h on a commodity computer. Hence, the ASaiM framework and its workflows are proven to be relevant for the analysis of microbiota datasets. 1Data On EBI metagenomics database, two mock community samples for Human Microbiome Project (HMP) are available. Both samples contain a genomic mixture of 22 known microbial strains. Relative abundance of each strain has been targeted using the number of PCR product of their respective 16S sequences (Table 1). In first sample (SRR072232), the targeted 16S copies of the strains vary by up to four orders of magnitude between the strains (Table 1), whereas in second sample (SRR072233) the same 16S copy number is targeted for each strain (Table 1). -

High Quality Permanent Draft Genome Sequence of Chryseobacterium Bovis DSM 19482T, Isolated from Raw Cow Milk
Lawrence Berkeley National Laboratory Recent Work Title High quality permanent draft genome sequence of Chryseobacterium bovis DSM 19482T, isolated from raw cow milk. Permalink https://escholarship.org/uc/item/4b48v7v8 Journal Standards in genomic sciences, 12(1) ISSN 1944-3277 Authors Laviad-Shitrit, Sivan Göker, Markus Huntemann, Marcel et al. Publication Date 2017 DOI 10.1186/s40793-017-0242-6 Peer reviewed eScholarship.org Powered by the California Digital Library University of California Laviad-Shitrit et al. Standards in Genomic Sciences (2017) 12:31 DOI 10.1186/s40793-017-0242-6 SHORT GENOME REPORT Open Access High quality permanent draft genome sequence of Chryseobacterium bovis DSM 19482T, isolated from raw cow milk Sivan Laviad-Shitrit1, Markus Göker2, Marcel Huntemann3, Alicia Clum3, Manoj Pillay3, Krishnaveni Palaniappan3, Neha Varghese3, Natalia Mikhailova3, Dimitrios Stamatis3, T. B. K. Reddy3, Chris Daum3, Nicole Shapiro3, Victor Markowitz3, Natalia Ivanova3, Tanja Woyke3, Hans-Peter Klenk4, Nikos C. Kyrpides3 and Malka Halpern1,5* Abstract Chryseobacterium bovis DSM 19482T (Hantsis-Zacharov et al., Int J Syst Evol Microbiol 58:1024-1028, 2008) is a Gram-negative, rod shaped, non-motile, facultative anaerobe, chemoorganotroph bacterium. C. bovis is a member of the Flavobacteriaceae, a family within the phylum Bacteroidetes. It was isolated when psychrotolerant bacterial communities in raw milk and their proteolytic and lipolytic traits were studied. Here we describe the features of this organism, together with the draft genome sequence and annotation. The DNA G + C content is 38.19%. The chromosome length is 3,346,045 bp. It encodes 3236 proteins and 105 RNA genes. The C. bovis genome is part of the Genomic Encyclopedia of Type Strains, Phase I: the one thousand microbial genomes study. -

1 Supplementary Information Ugly Ducklings – the Dark Side of Plastic
Supplementary Information Ugly ducklings – The dark side of plastic materials in contact with potable water Lisa Neu1,2, Carola Bänziger1, Caitlin R. Proctor1,2, Ya Zhang3, Wen-Tso Liu3, Frederik Hammes1,* 1 Eawag, Swiss Federal Institute of Aquatic Science and Technology, Dübendorf, Switzerland 2 Department of Environmental Systems Science, Institute of Biogeochemistry and Pollutant Dynamics, ETH Zürich, Zürich, Switzerland 3 Department of Civil and Environmental Engineering, University of Illinois at Urbana-Champaign, USA Table of contents Table S1 Exemplary online blog entries on biofouling in bath toys Figure S1 Images of all examined bath toys Figure S2 Additional images of bath toy biofilms by OCT Figure S3 Additional images on biofilm composition by SEM Figure S4 Number of bacteria and proportion of intact cells in bath toy biofilms Table S2 Classification of shared OTUs between bath toys Table S3 Shared and ‘core’ communities in bath toys from single households Table S4 Richness and diversity Figure S5 Classification of abundant OTUs in real bath toy biofilms Table S5 Comparison of most abundant OTUs in control bath toy biofilms Figure S6 Fungal community composition in bath toy biofilms Table S6 Conventional plating results for indicator bacteria and groups Table S7 Bioavailability of migrating carbon from control bath toys’ material Water chemistry Method and results (Table S8) Table S9 Settings for Amplification PCR and Index PCR reactions 1 Table S1: Exemplary online blog entries on biofouling inside bath toys Issue - What is the slime? Link Rub-a-dub-dub, https://www.babble.com/baby/whats-in-the-tub/ what’s in the tub? What’s the black stuff http://blogs.babycenter.com/momstories/whats-the-black- in your squeeze toys? stuff-in-your-squeeze-toys/ Friday Find: NBC’s http://www.bebravekeepgoing.com/2010/03/friday-find-nbcs- Today Show segment: today-show-segment-do.html Do bath toys carry germs? Yuck. -

WO 2018/064165 A2 (.Pdf)
(12) INTERNATIONAL APPLICATION PUBLISHED UNDER THE PATENT COOPERATION TREATY (PCT) (19) World Intellectual Property Organization International Bureau (10) International Publication Number (43) International Publication Date WO 2018/064165 A2 05 April 2018 (05.04.2018) W !P O PCT (51) International Patent Classification: Published: A61K 35/74 (20 15.0 1) C12N 1/21 (2006 .01) — without international search report and to be republished (21) International Application Number: upon receipt of that report (Rule 48.2(g)) PCT/US2017/053717 — with sequence listing part of description (Rule 5.2(a)) (22) International Filing Date: 27 September 2017 (27.09.2017) (25) Filing Language: English (26) Publication Langi English (30) Priority Data: 62/400,372 27 September 2016 (27.09.2016) US 62/508,885 19 May 2017 (19.05.2017) US 62/557,566 12 September 2017 (12.09.2017) US (71) Applicant: BOARD OF REGENTS, THE UNIVERSI¬ TY OF TEXAS SYSTEM [US/US]; 210 West 7th St., Austin, TX 78701 (US). (72) Inventors: WARGO, Jennifer; 1814 Bissonnet St., Hous ton, TX 77005 (US). GOPALAKRISHNAN, Vanch- eswaran; 7900 Cambridge, Apt. 10-lb, Houston, TX 77054 (US). (74) Agent: BYRD, Marshall, P.; Parker Highlander PLLC, 1120 S. Capital Of Texas Highway, Bldg. One, Suite 200, Austin, TX 78746 (US). (81) Designated States (unless otherwise indicated, for every kind of national protection available): AE, AG, AL, AM, AO, AT, AU, AZ, BA, BB, BG, BH, BN, BR, BW, BY, BZ, CA, CH, CL, CN, CO, CR, CU, CZ, DE, DJ, DK, DM, DO, DZ, EC, EE, EG, ES, FI, GB, GD, GE, GH, GM, GT, HN, HR, HU, ID, IL, IN, IR, IS, JO, JP, KE, KG, KH, KN, KP, KR, KW, KZ, LA, LC, LK, LR, LS, LU, LY, MA, MD, ME, MG, MK, MN, MW, MX, MY, MZ, NA, NG, NI, NO, NZ, OM, PA, PE, PG, PH, PL, PT, QA, RO, RS, RU, RW, SA, SC, SD, SE, SG, SK, SL, SM, ST, SV, SY, TH, TJ, TM, TN, TR, TT, TZ, UA, UG, US, UZ, VC, VN, ZA, ZM, ZW. -

Supplemental Material S1.Pdf
Phylogeny of Selenophosphate synthetases (SPS) Supplementary Material S1 ! SelD in prokaryotes! ! ! SelD gene finding in sequenced prokaryotes! We downloaded a total of 8263 prokaryotic genomes from NCBI (see Supplementary Material S7). We scanned them with the program selenoprofiles (Mariotti 2010, http:// big.crg.cat/services/selenoprofiles) using two SPS-family profiles, one prokaryotic (seld) and one mixed eukaryotic-prokaryotic (SPS). Selenoprofiles removes overlapping predictions from different profiles, keeping only the prediction from the profile that seems closer to the candidate sequence. As expected, the great majority of output predictions in prokaryotic genomes were from the seld profile. We will refer to the prokaryotic SPS/SelD !genes as SelD, following the most common nomenclature in literature.! To be able to inspect results by hand, and also to focus on good-quality genomes, we considered a reduced set of species. We took the prok_reference_genomes.txt list from ftp://ftp.ncbi.nlm.nih.gov/genomes/GENOME_REPORTS/, which NCBI claims to be a "small curated subset of really good and scientifically important prokaryotic genomes". We named this the prokaryotic reference set (223 species - see Supplementary Material S8). We manually curated most of the analysis in this set, while we kept automatized the !analysis on the full set.! We detected SelD proteins in 58 genomes (26.0%) in the prokaryotic reference set (figure 1 in main paper), which become 2805 (33.9%) when considering the prokaryotic full set (figure SM1.1). The difference in proportion between the two sets is due largely to the presence of genomes of very close strains in the full set, which we consider redundant. -

Das Mikrobiom Periimplantärer Läsionen Der Nachweis Dysbiotischer Veränderungen in Assoziation Mit Dem Schweregrad Der Erkrankung
Das Mikrobiom periimplantärer Läsionen Der Nachweis dysbiotischer Veränderungen in Assoziation mit dem Schweregrad der Erkrankung Inaugural-Dissertation zur Erlangung des Doktorgrades der Hohen Medizinischen Fakultät der Rheinischen Friedrich-Wilhelms-Universität Bonn Annika Therese Kröger aus Aachen 2020 Angefertigt mit der Genehmigung der Medizinischen Fakultät der Universität Bonn 1. Gutachter: Prof. Dr. med. dent. Moritz Kebschull 2. Gutachter: Prof. Dr. Achim Hörauf Tag der Mündlichen Prüfung: 07.10.2020 Aus der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde Direktor: Prof. Dr. med. Dr. med. dent. Søren Jepsen Meinen Eltern 5 Inhaltsverzeichnis Abkürzungsverzeichnis 7 1. Einleitung 8 1.1 Periimplantitis 8 1.1.1 Dentale Implantate und umgebendes Gewebe in periimplantären gesunden Situationen 8 1.1.2 Periimplantitis 10 1.1.3 Periimplantitis versus Parodontitis 14 1.2 Das Mikrobiom bei Periimplantitis und Parodontitis 17 1.3 16s rRNA Sequenzierung 18 1.3.1 Hochdurchsatzsequenziermethodiken 18 1.3.2 Das 16s Gen 18 1.4 Hypothese und Fragestellung dieser Studie 19 2. Material und Methoden 21 2.1 Studienpopulation 21 2.1.1 Allgemeines 21 2.1.2 Ein- und Ausschlusskriterien 21 2.1.3 Dokumentierte Parameter 22 2.2 Probengewinnung und -aufbereitung 23 2.3 16s rRNA Sequenzierung und Datenaufbereitung 24 2.3.1 ‚Paired-End‘-Hochdurchsatz-Sequenzierung der V3-V4 Region des 16s rRNA Genes 25 2.3.2 Post-Sequenzierungs-Prozesse 28 2.4 Statistische Analyse 32 2.4.1 Assoziation mit PD 32 2.4.2 Netzwerkanalyse 33 2.4.3 Mikrobieller Dysbiose Index 34 2.4.4 Signifikante Unterschiede der bakteriellen Charakteristika 34 6 3. Ergebnisse 35 3.1 Studienpopulation (Tab. -
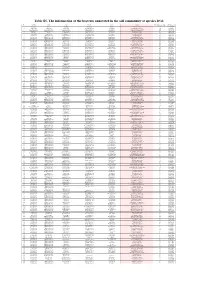
Table S5. the Information of the Bacteria Annotated in the Soil Community at Species Level
Table S5. The information of the bacteria annotated in the soil community at species level No. Phylum Class Order Family Genus Species The number of contigs Abundance(%) 1 Firmicutes Bacilli Bacillales Bacillaceae Bacillus Bacillus cereus 1749 5.145782459 2 Bacteroidetes Cytophagia Cytophagales Hymenobacteraceae Hymenobacter Hymenobacter sedentarius 1538 4.52499338 3 Gemmatimonadetes Gemmatimonadetes Gemmatimonadales Gemmatimonadaceae Gemmatirosa Gemmatirosa kalamazoonesis 1020 3.000970902 4 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas indica 797 2.344876284 5 Firmicutes Bacilli Lactobacillales Streptococcaceae Lactococcus Lactococcus piscium 542 1.594633558 6 Actinobacteria Thermoleophilia Solirubrobacterales Conexibacteraceae Conexibacter Conexibacter woesei 471 1.385742446 7 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas taxi 430 1.265115184 8 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas wittichii 388 1.141545794 9 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas sp. FARSPH 298 0.876754244 10 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sorangium cellulosum 260 0.764953367 11 Proteobacteria Deltaproteobacteria Myxococcales Polyangiaceae Sorangium Sphingomonas sp. Cra20 260 0.764953367 12 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas panacis 252 0.741416341 -

Ice-Nucleating Particles Impact the Severity of Precipitations in West Texas
Ice-nucleating particles impact the severity of precipitations in West Texas Hemanth S. K. Vepuri1,*, Cheyanne A. Rodriguez1, Dimitri G. Georgakopoulos4, Dustin Hume2, James Webb2, Greg D. Mayer3, and Naruki Hiranuma1,* 5 1Department of Life, Earth and Environmental Sciences, West Texas A&M University, Canyon, TX, USA 2Office of Information Technology, West Texas A&M University, Canyon, TX, USA 3Department of Environmental Toxicology, Texas Tech University, Lubbock, TX, USA 4Department of Crop Science, Agricultural University of Athens, Athens, Greece 10 *Corresponding authors: [email protected] and [email protected] Supplemental Information 15 S1. Precipitation and Particulate Matter Properties S1.1 Precipitation Categorization In this study, we have segregated our precipitation samples into four different categories, such as (1) snows, (2) hails/thunderstorms, (3) long-lasted rains, and (4) weak rains. For this categorization, we have considered both our observation-based as well as the disdrometer-assigned National Weather Service (NWS) 20 code. Initially, the precipitation samples had been assigned one of the four categories based on our manual observation. In the next step, we have used each NWS code and its occurrence in each precipitation sample to finalize the precipitation category. During this step, a precipitation sample was categorized into snow, only when we identified a snow type NWS code (Snow: S-, S, S+ and/or Snow Grains: SG). Likewise, a precipitation sample was categorized into hail/thunderstorm, only when the cumulative sum of NWS codes for hail was 25 counted more than five times (i.e., A + SP ≥ 5; where A and SP are the codes for soft hail and hail, respectively). -
![The Skin Microbiome of Cow-Nose Rays ([I]Rhinoptera Bonasus[I])](https://docslib.b-cdn.net/cover/2927/the-skin-microbiome-of-cow-nose-rays-i-rhinoptera-bonasus-i-792927.webp)
The Skin Microbiome of Cow-Nose Rays ([I]Rhinoptera Bonasus[I])
The skin microbiome of cow-nose rays (Rhinoptera bonasus) in an aquarium touch-tank exhibit Patrick J Kearns Corresp., 1 , Jennifer L Bowen 1 , Michael F Tlusty 2, 3 1 Biology Department, University of Massachusetts Boston, Boston, Massachusetts, USA 2 John H. Prescott Marine Lab, Anderson Cabot Center for Ocean Life, New England Aquarium, Boston, MA, USA 3 School for the Environment, University of Massachusetts Boston, Boston, MA, USA Corresponding Author: Patrick J Kearns Email address: [email protected] Public aquarium exhibits offer numerous educational opportunities for visitors while touch tank exhibits offer guests the ability to directly interact with marine life. However, despite the popularity of these exhibits, the effect of human interactions on the host-associated microbiome or the habitat microbiome remains unclear. Microbial communities, both host- associated and habitat associated can have great implications for host health and habitat function. To better understand the link between human interactions and the microbiome of a touch tank we used high-throughput sequencing of the 16S rRNA gene to analyze the microbial community on the dorsal and ventral surfaces of cow-nose rays (Rhinoptera bonasus) as well as its environment in a frequently visited touch tank exhibit at the New England Aquarium. Our analyses revealed a distinct microbial community associated with the skin of the ray that had lower diversity than the surrounding habitat. The ray skin was dominated by three orders: Burkholderiales (~55%), Flavobacteriales (~19%) and Pseudomonadales (~12%), suggesting a potentially important role of these taxa in ray health. Further, there was no difference between dorsal and ventral surface of the ray in terms of microbial composition or diversity, and a very low presence of common human- associated microbial taxa (<1.5%). -

A New Symbiotic Lineage Related to Neisseria and Snodgrassella Arises from the Dynamic and Diverse Microbiomes in Sucking Lice
bioRxiv preprint doi: https://doi.org/10.1101/867275; this version posted December 6, 2019. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted bioRxiv a license to display the preprint in perpetuity. It is made available under aCC-BY-NC-ND 4.0 International license. A new symbiotic lineage related to Neisseria and Snodgrassella arises from the dynamic and diverse microbiomes in sucking lice Jana Říhová1, Giampiero Batani1, Sonia M. Rodríguez-Ruano1, Jana Martinů1,2, Eva Nováková1,2 and Václav Hypša1,2 1 Department of Parasitology, Faculty of Science, University of South Bohemia, České Budějovice, Czech Republic 2 Institute of Parasitology, Biology Centre, ASCR, v.v.i., České Budějovice, Czech Republic Author for correspondence: Václav Hypša, Department of Parasitology, University of South Bohemia, České Budějovice, Czech Republic, +42 387 776 276, [email protected] Abstract Phylogenetic diversity of symbiotic bacteria in sucking lice suggests that lice have experienced a complex history of symbiont acquisition, loss, and replacement during their evolution. By combining metagenomics and amplicon screening across several populations of two louse genera (Polyplax and Hoplopleura) we describe a novel louse symbiont lineage related to Neisseria and Snodgrassella, and show its' independent origin within dynamic lice microbiomes. While the genomes of these symbionts are highly similar in both lice genera, their respective distributions and status within lice microbiomes indicate that they have different functions and history. In Hoplopleura acanthopus, the Neisseria-related bacterium is a dominant obligate symbiont universally present across several host’s populations, and seems to be replacing a presumably older and more degenerated obligate symbiont. -

Characteristics of Bacterial Community in Cloud Water at Mt. Tai: Similarity and Disparity Under Polluted and Non-Polluted Cloud Episodes
Characteristics of bacterial community in cloud water at Mt. Tai: similarity and disparity under polluted and non-polluted cloud episodes Min Wei 1, Caihong Xu1, Jianmin Chen1,2,*, Chao Zhu1, Jiarong Li1, Ganglin Lv 1 5 1 Environment Research Institute, School of Environmental Science and Engineering, Shandong University, Ji’nan 250100, China 2 Shanghai Key Laboratory of Atmospheric Particle Pollution and Prevention (LAP), Fudan Tyndall Centre, Department of Environmental Science & Engineering, Fudan University, Shanghai 200433, China 10 Correspondence to: JM.Chen ([email protected]) Abstract: Bacteria are widely distributed in atmospheric aerosols and are indispensable components of clouds, playing an important role in the atmospheric hydrological cycle. However, limited information is 15 available about the bacterial community structure and function, especially for the increasing air pollution in the North China Plain. Here, we present a comprehensive characterization of bacterial community composition, function, variation and environmental influence for cloud water collected at Mt. Tai from 24 Jul to 23 Aug 2014. Using Miseq 16S rRNA gene sequencing, the highly diverse bacterial community in cloud water and the predominant phyla of Proteobacteria, Bacteroidetes, 20 Cyanobacteria and Firmicutes were investigated. Bacteria that survive at low temperature, radiation, and poor nutrient conditions were found in cloud water, suggesting adaptation to an extreme environment. The bacterial gene functions predicted from the 16S rRNA gene using