Boletín En Versión
Total Page:16
File Type:pdf, Size:1020Kb

Load more
Recommended publications
-
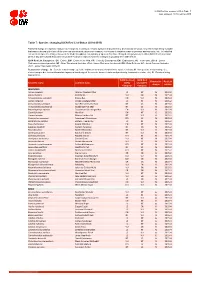
Table 7: Species Changing IUCN Red List Status (2014-2015)
IUCN Red List version 2015.4: Table 7 Last Updated: 19 November 2015 Table 7: Species changing IUCN Red List Status (2014-2015) Published listings of a species' status may change for a variety of reasons (genuine improvement or deterioration in status; new information being available that was not known at the time of the previous assessment; taxonomic changes; corrections to mistakes made in previous assessments, etc. To help Red List users interpret the changes between the Red List updates, a summary of species that have changed category between 2014 (IUCN Red List version 2014.3) and 2015 (IUCN Red List version 2015-4) and the reasons for these changes is provided in the table below. IUCN Red List Categories: EX - Extinct, EW - Extinct in the Wild, CR - Critically Endangered, EN - Endangered, VU - Vulnerable, LR/cd - Lower Risk/conservation dependent, NT - Near Threatened (includes LR/nt - Lower Risk/near threatened), DD - Data Deficient, LC - Least Concern (includes LR/lc - Lower Risk, least concern). Reasons for change: G - Genuine status change (genuine improvement or deterioration in the species' status); N - Non-genuine status change (i.e., status changes due to new information, improved knowledge of the criteria, incorrect data used previously, taxonomic revision, etc.); E - Previous listing was an Error. IUCN Red List IUCN Red Reason for Red List Scientific name Common name (2014) List (2015) change version Category Category MAMMALS Aonyx capensis African Clawless Otter LC NT N 2015-2 Ailurus fulgens Red Panda VU EN N 2015-4 -

Gastropoda, Caenogastropoda: Rissoidae; Cingulopsidae; Barleeidae;
BASTERIA, 70:141-151, 2006 New records and of new species marine molluscs (Gastropoda, Caenogastropoda: Rissoidae; Cingulopsidae; Barleeidae; Tjaernoeiidae) from Mauritaniaand Senegal E. Rolán Museo de Historia Natural, Campus Universitario Sur, E 15782 Santiago de Compostela, Spain; [email protected] & J.M. Hernández E 35460 Capitan Quesada, 41, Gaidar, Gran Canaria, Spain Some species of marine micromolluscs of the families Rissoidae, Cingulopsidae, Barleeidae, and from Africa studied. Tjaernoeiidae West (Mauritaniaand Senegal) are New information on the taxa is Setia Eatonina Barleeia minuscula following reported: nomeae, matildae, (which is con- sidered a valid and Four the Setia species) Tjaernoeia exquisita. new species belonging to genera (1),Crisilla (1) and Eatonina (2) are described. Key words: Gastropoda, Caenogastropoda, Rissoidae, Setia, Crisilla, Cingulopsidae, Eatonina, Barleeidae, Barleeia, Tjaernoeiidae, Tjaernoeia, taxonomy, West Africa. INTRODUCTION For many years West African molluscs have been studied and described, but priority to those of size. small was always given large Only recently, very molluscs have come to the attention of authors. some They are now better known but many of them are still in awaiting study. Concerning the Rissoidae the study area and nearby, we must mention the of Verduin Amati papers (1984), (1987), Ponder (1989), Gofas (1995), Giannuzzi-Savelli et al. and Ardovini (1996), & Cossignani (2004), amongothers. MATERIAL AND METHODS in In some trips of the authors to Dakar, Senegal, 2002and 2003, numerous sediments ofbeach drift and small live species were collected.Additionalmaterialof sediments was loanedby Jacques Pelorce from 2001-2003. This was studied and compared with material from Mauritania, visited the author in 1996 in by senior companyof Jose Templado and Federico Rubio. -

Scarica Il Notiziario S.I.M
NOTIZIARIOPubblicazione semestrale della Società Italiana di Malacologia - c/o Museo di ScienzeS.I.M. Planetarie, via Galcianese 20H - 59100 Prato Anno 31 · n. 2 · luglio-dicembre 2013 Supplemento del Bollettino Malacologico vol. 49 n. 2 Vita societaria a cura di Paolo Crovato e Maurizio Forli Sommario Vita sociale molluschi marini del Mediterraneo. Volume V. A cura di P. Crovato 2 In memoriam Mauro Pizzini (13 luglio 1946 - 4 novembre 2013) 16 Salemi M., 2013 Lumache tropicali- Tropical snail. A cura di M. Forli 4 Verbale della riunione del Consiglio Direttivo tenuta in Montesilvano (PE) il 14 settembre 2013 5 Convocazione dell’Assemblea ordinaria dei soci Eventi S.I.M., Napoli, 7.04.2014 17 San Felice Circeo (RM), 7° Convegno Malacologico 6 Elenco delle pubblicazioni S.I.M. disponibili 17 Prato, Mirabilia, Le Conchiglie - Mostra Mercato 7 Nota del Presidente 18 Cambridge 7-11 settembre 2014, 7° Congresso delle Società Europee di Malacologia 8 Segnalazioni bibliografiche 18 Cefalù-Castelbuono, 16-18 maggio 2014, Presentazione libri e recensioni 2° Congresso Internazionale 18 Mostre e Borse 2014 15 Cecalupo A. & Perugia I., 2013. The Cerithiopsidae (Caenogastropoda: Triphoroidea) of Espiritu Santo - Vanuatu (South Pacific Ocean). Varie A cura di P. Crovato 19 Aggiunte e correzioni all’elenco dei soci 15 Scaperrotta M., Bartolini S. & Bogi C., 2013. Accrescimenti. Stadi di accrescimento dei 20 Quote Sociali 2014 In memoriam Mauro Pizzini (13 luglio 1946 – 4 novembre 2013) Vita sociale Mauro Pizzini ci ha lasciato pochi giorni fa. Martedì 5 novembre è arrivata la notizia che in molti temevamo: un’e-mail di sua figlia Chiara annunciava che Mauro era morto il giorno prima. -

The Recent Molluscan Marine Fauna of the Islas Galápagos
THE FESTIVUS ISSN 0738-9388 A publication of the San Diego Shell Club Volume XXIX December 4, 1997 Supplement The Recent Molluscan Marine Fauna of the Islas Galapagos Kirstie L. Kaiser Vol. XXIX: Supplement THE FESTIVUS Page i THE RECENT MOLLUSCAN MARINE FAUNA OF THE ISLAS GALApAGOS KIRSTIE L. KAISER Museum Associate, Los Angeles County Museum of Natural History, Los Angeles, California 90007, USA 4 December 1997 SiL jo Cover: Adapted from a painting by John Chancellor - H.M.S. Beagle in the Galapagos. “This reproduction is gifi from a Fine Art Limited Edition published by Alexander Gallery Publications Limited, Bristol, England.” Anon, QU Lf a - ‘S” / ^ ^ 1 Vol. XXIX Supplement THE FESTIVUS Page iii TABLE OF CONTENTS INTRODUCTION 1 MATERIALS AND METHODS 1 DISCUSSION 2 RESULTS 2 Table 1: Deep-Water Species 3 Table 2: Additions to the verified species list of Finet (1994b) 4 Table 3: Species listed as endemic by Finet (1994b) which are no longer restricted to the Galapagos .... 6 Table 4: Summary of annotated checklist of Galapagan mollusks 6 ACKNOWLEDGMENTS 6 LITERATURE CITED 7 APPENDIX 1: ANNOTATED CHECKLIST OF GALAPAGAN MOLLUSKS 17 APPENDIX 2: REJECTED SPECIES 47 INDEX TO TAXA 57 Vol. XXIX: Supplement THE FESTIVUS Page 1 THE RECENT MOLLUSCAN MARINE EAUNA OE THE ISLAS GALAPAGOS KIRSTIE L. KAISER' Museum Associate, Los Angeles County Museum of Natural History, Los Angeles, California 90007, USA Introduction marine mollusks (Appendix 2). The first list includes The marine mollusks of the Galapagos are of additional earlier citations, recent reported citings, interest to those who study eastern Pacific mollusks, taxonomic changes and confirmations of 31 species particularly because the Archipelago is far enough from previously listed as doubtful. -

(Approx) Mixed Micro Shells (22G Bags) Philippines € 10,00 £8,64 $11,69 Each 22G Bag Provides Hours of Fun; Some Interesting Foraminifera Also Included
Special Price £ US$ Family Genus, species Country Quality Size Remarks w/o Photo Date added Category characteristic (€) (approx) (approx) Mixed micro shells (22g bags) Philippines € 10,00 £8,64 $11,69 Each 22g bag provides hours of fun; some interesting Foraminifera also included. 17/06/21 Mixed micro shells Ischnochitonidae Callistochiton pulchrior Panama F+++ 89mm € 1,80 £1,55 $2,10 21/12/16 Polyplacophora Ischnochitonidae Chaetopleura lurida Panama F+++ 2022mm € 3,00 £2,59 $3,51 Hairy girdles, beautifully preserved. Web 24/12/16 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 30mm+ € 4,00 £3,45 $4,68 30/04/21 Polyplacophora Ischnochitonidae Ischnochiton textilis South Africa F+++ 27.9mm € 2,80 £2,42 $3,27 30/04/21 Polyplacophora Ischnochitonidae Stenoplax limaciformis Panama F+++ 16mm+ € 6,50 £5,61 $7,60 Uncommon. 24/12/16 Polyplacophora Chitonidae Acanthopleura gemmata Philippines F+++ 25mm+ € 2,50 £2,16 $2,92 Hairy margins, beautifully preserved. 04/08/17 Polyplacophora Chitonidae Acanthopleura gemmata Australia F+++ 25mm+ € 2,60 £2,25 $3,04 02/06/18 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 41mm+ € 4,00 £3,45 $4,68 West Indian 'fuzzy' chiton. Web 24/12/16 Polyplacophora Chitonidae Acanthopleura granulata Panama F+++ 32mm+ € 3,00 £2,59 $3,51 West Indian 'fuzzy' chiton. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 44mm+ € 5,00 £4,32 $5,85 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F++ 35mm € 2,50 £2,16 $2,92 Caribbean. 24/12/16 Polyplacophora Chitonidae Chiton tuberculatus Panama F+++ 29mm+ € 3,00 £2,59 $3,51 Caribbean. -

THE LISTING of PHILIPPINE MARINE MOLLUSKS Guido T
August 2017 Guido T. Poppe A LISTING OF PHILIPPINE MARINE MOLLUSKS - V1.00 THE LISTING OF PHILIPPINE MARINE MOLLUSKS Guido T. Poppe INTRODUCTION The publication of Philippine Marine Mollusks, Volumes 1 to 4 has been a revelation to the conchological community. Apart from being the delight of collectors, the PMM started a new way of layout and publishing - followed today by many authors. Internet technology has allowed more than 50 experts worldwide to work on the collection that forms the base of the 4 PMM books. This expertise, together with modern means of identification has allowed a quality in determinations which is unique in books covering a geographical area. Our Volume 1 was published only 9 years ago: in 2008. Since that time “a lot” has changed. Finally, after almost two decades, the digital world has been embraced by the scientific community, and a new generation of young scientists appeared, well acquainted with text processors, internet communication and digital photographic skills. Museums all over the planet start putting the holotypes online – a still ongoing process – which saves taxonomists from huge confusion and “guessing” about how animals look like. Initiatives as Biodiversity Heritage Library made accessible huge libraries to many thousands of biologists who, without that, were not able to publish properly. The process of all these technological revolutions is ongoing and improves taxonomy and nomenclature in a way which is unprecedented. All this caused an acceleration in the nomenclatural field: both in quantity and in quality of expertise and fieldwork. The above changes are not without huge problematics. Many studies are carried out on the wide diversity of these problems and even books are written on the subject. -

Frugivory and Seed Dispersal in the Endemic Cactus Eulychnia Acida: Extending the Anachronism Hypothesis to the Chilean Mediterranean Ecosystem Rocío A
Cares et al. Revista Chilena de Historia Natural (2018) 91:9 Revista Chilena de https://doi.org/10.1186/s40693-018-0079-4 Historia Natural SHORTREPORT Open Access Frugivory and seed dispersal in the endemic cactus Eulychnia acida: extending the anachronism hypothesis to the Chilean Mediterranean ecosystem Rocío A. Cares1†, Consuelo Sáez-Cordovez1†, Alfonso Valiente-Banuet2, Rodrigo Medel1* and Carezza Botto-Mahan1 Abstract Background: Eulychnia acida is an endemic Chilean cactus species whose fruits show several traits that, taken as a whole, are compatible with a seed dispersal syndrome by large herbivore vertebrates. Since only a few large native mammals exist in Chile at present, cactus fruit consumption and seed dispersal may be coopted by introduced mammals as predicted by Janzen and Martin’s (1982) hypothesis for tropical ecosystems. Findings: We describe the current frugivore species of E. acida in a protected semiarid-Mediterranean ecosystem using field measurements and feeding experiments. In addition, to examine a potential role as seed dispersers of the cactus species, we offered fruits and performed germination tests on seeds defecated by Lama guanicoe and the introduced goat Capra a. hircus under captivity conditions. Our data indicate that while fruits of E. acida are pecked by the Chilean tinamou, Nothoprocta perdicaria, and the Chilean mockingbird, Mimus thenca, and eaten by the brush-tailed rodent, Octodon degus, none of these species could be considered a legitimate seed disperser. Unlike L. guanicoe, the goat C. a. hircus did not reduce seed germination, having a neutral effect. Conclusions: Results from this study indicate that introduced C. a. hircus was the only species showing a potential role in the seed dispersal process of E. -

Kew Science Publications for the Academic Year 2017–18
KEW SCIENCE PUBLICATIONS FOR THE ACADEMIC YEAR 2017–18 FOR THE ACADEMIC Kew Science Publications kew.org For the academic year 2017–18 ¥ Z i 9E ' ' . -,i,c-"'.'f'l] Foreword Kew’s mission is to be a global resource in We present these publications under the four plant and fungal knowledge. Kew currently has key questions set out in Kew’s Science Strategy over 300 scientists undertaking collection- 2015–2020: based research and collaborating with more than 400 organisations in over 100 countries What plants and fungi occur to deliver this mission. The knowledge obtained 1 on Earth and how is this from this research is disseminated in a number diversity distributed? p2 of different ways from annual reports (e.g. stateoftheworldsplants.org) and web-based What drivers and processes portals (e.g. plantsoftheworldonline.org) to 2 underpin global plant and academic papers. fungal diversity? p32 In the academic year 2017-2018, Kew scientists, in collaboration with numerous What plant and fungal diversity is national and international research partners, 3 under threat and what needs to be published 358 papers in international peer conserved to provide resilience reviewed journals and books. Here we bring to global change? p54 together the abstracts of some of these papers. Due to space constraints we have Which plants and fungi contribute to included only those which are led by a Kew 4 important ecosystem services, scientist; a full list of publications, however, can sustainable livelihoods and natural be found at kew.org/publications capital and how do we manage them? p72 * Indicates Kew staff or research associate authors. -

Gastropoda: Caenogastropoda: Eulimidae) from Japan, with a Revised Diagnosis of the Genus
VENUS 78 (3–4): 71–85, 2020 ©The Malacological Society of Japan DOI: http://doi.org/10.18941/venus.78.3-4_71Three New Species of Hemiliostraca September 25, 202071 Three New Species of Hemiliostraca and a Redescription of H. conspurcata (Gastropoda: Caenogastropoda: Eulimidae) from Japan, with a Revised Diagnosis of the Genus Haruna Matsuda1*, Daisuke Uyeno2 and Kazuya Nagasawa3 1Center for Faculty-wide General Education, Shikoku University, 123-1, Ebisuno, Furukawa, Ojin-cho, Tokushima-shi, Tokushima 771-1192, Japan 2Graduate School of Science and Engineering, Kagoshima University, 1-21-35, Korimoto, Kagoshima 890-0065, Japan 3Aquaparasitology Laboratory, 365-61 Kusanagi, Shizuoka 424-0886, Japan Abstract: Three new species of the eulimid gastropod genus Hemiliostraca Pilsbry, 1917, i.e., H. capreolus n. sp., H. tenuis n. sp., and H. maculata n. sp., are described and H. conspurcata (A. Adams, 1863) is redescribed based on newly obtained material from Japan. The diagnosis of the genus is also revised. Hemiliostraca capreolus n. sp. was previously misidentied as H. samoensis in museum collections and in literature. This new species was collected from Okinawa-jima Island and Amami-Oshima Island, southern Japan, and can be distinguished from H. samoensis by its distinct color patterns and markings. A recently collected specimen from an unidentied species of ophiuroid from Wakayama Prefecture, central Japan, is herein conrmed to be identiable with H. conspurcata, which has not been recorded since its originally description from central Japan in 1863. Hemiliostraca tenuis n. sp. was collected from an unidentied species of sponge and the ophiuroid Ophiarachnella septemspinosa from Kume-jima Island, southern Japan. -

TREATISE ONLINE Number 48
TREATISE ONLINE Number 48 Part N, Revised, Volume 1, Chapter 31: Illustrated Glossary of the Bivalvia Joseph G. Carter, Peter J. Harries, Nikolaus Malchus, André F. Sartori, Laurie C. Anderson, Rüdiger Bieler, Arthur E. Bogan, Eugene V. Coan, John C. W. Cope, Simon M. Cragg, José R. García-March, Jørgen Hylleberg, Patricia Kelley, Karl Kleemann, Jiří Kříž, Christopher McRoberts, Paula M. Mikkelsen, John Pojeta, Jr., Peter W. Skelton, Ilya Tëmkin, Thomas Yancey, and Alexandra Zieritz 2012 Lawrence, Kansas, USA ISSN 2153-4012 (online) paleo.ku.edu/treatiseonline PART N, REVISED, VOLUME 1, CHAPTER 31: ILLUSTRATED GLOSSARY OF THE BIVALVIA JOSEPH G. CARTER,1 PETER J. HARRIES,2 NIKOLAUS MALCHUS,3 ANDRÉ F. SARTORI,4 LAURIE C. ANDERSON,5 RÜDIGER BIELER,6 ARTHUR E. BOGAN,7 EUGENE V. COAN,8 JOHN C. W. COPE,9 SIMON M. CRAgg,10 JOSÉ R. GARCÍA-MARCH,11 JØRGEN HYLLEBERG,12 PATRICIA KELLEY,13 KARL KLEEMAnn,14 JIřÍ KřÍž,15 CHRISTOPHER MCROBERTS,16 PAULA M. MIKKELSEN,17 JOHN POJETA, JR.,18 PETER W. SKELTON,19 ILYA TËMKIN,20 THOMAS YAncEY,21 and ALEXANDRA ZIERITZ22 [1University of North Carolina, Chapel Hill, USA, [email protected]; 2University of South Florida, Tampa, USA, [email protected], [email protected]; 3Institut Català de Paleontologia (ICP), Catalunya, Spain, [email protected], [email protected]; 4Field Museum of Natural History, Chicago, USA, [email protected]; 5South Dakota School of Mines and Technology, Rapid City, [email protected]; 6Field Museum of Natural History, Chicago, USA, [email protected]; 7North -

Marine Ecology Progress Series 228:153
MARINE ECOLOGY PROGRESS SERIES Vol. 228: 153–163, 2002 Published March 6 Mar Ecol Prog Ser Carnivore/non-carnivore ratios in northeastern Pacific marine gastropods James W. Valentine1,*, Kaustuv Roy2, David Jablonski3 1Department of Integrative Biology and Museum of Paleontology, University of California, Berkeley, California 94720, USA 2Ecology, Behavior and Evolution Section, Division of Biology, University of California at San Diego, 9500 Gilman Drive, La Jolla, California 92093-0116, USA 3Department of Geophysical Sciences, University of Chicago, 5734 Ellis Avenue, Chicago, Illinois 60637, USA ABSTRACT: For 2321 species of shelled gastropods of the northeastern Pacific, the ratio of carnivo- rous to non-carnivorous species (C/NC ratio), computed for each degree of latitude, reveals striking spatial changes, with tropical and arctic areas characterized by high values and with the mid- latitudes having the lowest ratios. This latitudinal trend is markedly different from trends for terres- trial clades. The zonal variation in C/NC ratios within bins is largely due to differences in geographic ranges of the groups; for example, tropical carnivorous species range farther than non-carnivorous ones, thus overlapping them in more latitudinal bins. Differences in the distribution and diversity of carnivorous and non-carnivorous species may arise from a number of sources, including variability of primary production in the tropical eastern Pacific, patchiness of substrates to which non-carnivores are adapted, narrow dietary specializations of tropical carnivores, and higher provinciality found in extratropical regions. KEY WORDS: Trophic ratios · Latitudinal diversity trends · Provinciality · Variable productivity Resale or republication not permitted without written consent of the publisher INTRODUCTION diversities (Faaborg 1985, Jeffries & Lawton 1985, Karr et al. -

Low Phylogeographic Structure of Rhinella Arunco (Anura: Bufonidae)
Vásquez et al. Zoological Studies 2013, 52:35 http://www.zoologicalstudies.com/content/52/1/35 RESEARCH Open Access Low phylogeographic structure of Rhinella arunco (Anura: Bufonidae), an endemic amphibian from the Chilean Mediterranean hotspot Dayana Vásquez1, Claudio Correa1,2*, Luis Pastenes1, R Eduardo Palma2 and Marco A Méndez1 Abstract Background: The Mediterranean zone of central Chile (30° to 38°S) is one of the 25 diversity hotspots in the world. However, there are few phylogeographic studies which identify the factors that have influenced population diversification in the fauna of this area. In this study, we investigated the phylogeographic structure of Rhinella arunco, an anuran endemic to Mediterranean Chile, using 160 individuals from 23 localities representative of its entire distribution (32° to 38°S). Results: The haplotype network revealed four haplogroups, three of which overlap geographically and only one of which has an exclusive geographic distribution. An analysis of molecular variance indicated that neither watershed limits nor the main rivers in the current distribution of this species have been important geographic barriers against the dispersion of individuals. Finally, the Geneland analysis showed three population units, one of which concurs with one of the haplogroups found in the haplotype network. Together, these analyses indicated a low level of phylogeographic structure for this species. On the other hand, the highest levels of intrapopulational genetic variation were concentrated in the central part of the distribution (33° to 34°S), which may indicate an effect of Pleistocene glaciations on the genetic diversity of the populations in the extreme south of its range. Conclusions: The low phylogeographic structure observed in R.