Diversité Des Populations De Xanthomonas Phaseoli Pv
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Common Bacterial Blight (Xanthomonas Axonopodis Pv
atholog P y & nt a M Belete and Bastas, J Plant Pathol Microbiol 2017, 8:3 l i P c f r o o b DOI: 10.4172/2157-7471.1000403 l i Journal of a o l n o r g u y o J ISSN: 2157-7471 Plant Pathology & Microbiology Review Article Article Open Access Common Bacterial Blight (Xanthomonas axonopodis pv. phaseoli) of Beans with Special Focus on Ethiopian Condition Belete T1* and Bastas KK2 1Department of Plant Sciences and Horticulture, College of Dry Land Agriculture, Samara University, Samara, Ethiopia 2Department of Plant protection, Faculty of Agriculture, Selcuk University, Campus/Konya, Turkey Abstract Common bacterial blight (CBB) is the most devastating factor that affects common bean crops in all common bean growing areas. This review was to review with an objective of reviewing the biology, economic importance of CBB of common bean crop disease and its management options, with an emphasis on the future research direction and priorities. CBB disease, caused by the gram-negative bacterial pathogen Xanthomonas axonopodis pv. phaseoli (Xap) and its fuscans variant Xanthomonas fuscans subsp. fuscans (Xff) is the major bottleneck in bean production in the world as well as in Ethiopia. It is a serious bacterial disease of common bean which causes lesions on the leaves, stems, pods and seeds of the plant. The disease affects seed quality and can reduce yield by up to 45%, may be more in susceptible cultivars. CBB is very difficult to control due to seed-borne nature of the bacteria and its capacity to produce huge amounts of secondary inoculum. -

Horizontal Gene Transfer Plays a Major Role in the Pathological Convergence of Xanthomonas Lineages on Common Bean Nicolas W
Chen et al. BMC Genomics (2018) 19:606 https://doi.org/10.1186/s12864-018-4975-4 RESEARCHARTICLE Open Access Horizontal gene transfer plays a major role in the pathological convergence of Xanthomonas lineages on common bean Nicolas W. G. Chen1†, Laurana Serres-Giardi1†, Mylène Ruh1, Martial Briand1, Sophie Bonneau1, Armelle Darrasse1, Valérie Barbe2, Lionel Gagnevin3,4, Ralf Koebnik4 and Marie-Agnès Jacques1* Abstract Background: Host specialization is a hallmark of numerous plant pathogens including bacteria, fungi, oomycetes and viruses. Yet, the molecular and evolutionary bases of host specificity are poorly understood. In some cases, pathological convergence is observed for individuals belonging to distant phylogenetic clades. This is the case for Xanthomonas strains responsible for common bacterial blight of bean, spread across four genetic lineages. All the strains from these four lineages converged for pathogenicity on common bean, implying possible gene convergences and/or sharing of a common arsenal of genes conferring the ability to infect common bean. Results: To search for genes involved in common bean specificity, we used a combination of whole-genome analyses without a priori, including a genome scan based on k-mer search. Analysis of 72 genomes from a collection of Xanthomonas pathovars unveiled 115 genes bearing DNA sequences specific to strains responsible for common bacterial blight, including 20 genes located on a plasmid. Of these 115 genes, 88 were involved in successive events of horizontal gene transfers among the four genetic lineages, and 44 contained nonsynonymous polymorphisms unique to the causal agents of common bacterial blight. Conclusions: Our study revealed that host specificity of common bacterial blight agents is associated with a combination of horizontal transfers of genes, and highlights the role of plasmids in these horizontal transfers. -

Avances En El Manejo Integrado De Cyrtomenus Bergi, Chinche
Contributions Towards the Knowledge on the Biology, Behavior and Distribution of the Cassava Stem Borer, Chilomima clarkei (Lepidoptera:Pyralidae) in Tolima, Colombia Centro Internacional de Agricultura Tropical International Center for Tropical Agriculture *C. Ramirez, **C.J. Herrera, ***P. Chavarriaga, ***J. Tohme & **A.C. Bellotti *Department of Agronomic Engineering Univ. Tolima, Ibagué, Col. ** Integrated Pest Management Project *** Biotechnology Research Unit. International Center for Tropical Agriculture – CIAT. A.A. 6713 Cali, Colombia Introduction Integrated Pest Management In the department of Tolima, like in most The stem borer is usually more susceptible during the first four larval instars departments of Colombia, cassava is mostly when it stays out of the stem. Although the larval capsule may provide some grown as a marginal crop. It yields better than protection, high temperatures cause high mortality during these stages (LÖHR, many other crops under poor environmental 1983). Control of the stem borer after the fifth instar is more difficult since it conditions (Lopez, et al. 1996) due to its bores into the stem. IPM becomes then an alternative for an effective control of adaptability to, i.e., poor soil and drought. Pests the insect. CIAT currently works on genetic transformation of cassava to are threatening cassava yields in this and other introduce cry genes (from Bacillus thuringiensis) to obtain transgenic, insect- departments. One of them, the cassava stem resistant plants that may be integrated ton IMP strategy to control the stem borer (Chilomima clarkei), has been spreading borer. over the country since its was first reported in the eastern planes during the 80’s. Data from the northern coast have shown that C. -

The Debate on Plant and Crop Biodiversity and Biotechnology
The Debate on Plant and Crop Biodiversity and Biotechnology Klaus Ammann, [email protected] Version from December 15, 2017, 480 full text references, 117 pp. ASK-FORCE contribution No. 11 Nearly 470 references on biodiversity and Agriculture need still to be screened and selected. Contents: 1. Summary ........................................................................................................................................................................... 3 2. The needs for biodiversity – the general case ................................................................................................................ 3 3. Relationship between biodiversity and ecological parameters ..................................................................................... 5 4. A new concept of sustainability ....................................................................................................................................... 6 4.1. Revisiting the original Brundtland definition of sustainable development ...............................................................................................................7 4.2. Redefining Sustainability for Agriculture and Technology, see fig. 1 .........................................................................................................................8 5. The Issue: unnecessary stigmatization of GMOs .......................................................................................................... 12 6. Types of Biodiversity ...................................................................................................................................................... -
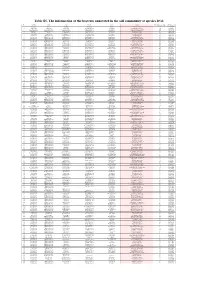
Table S5. the Information of the Bacteria Annotated in the Soil Community at Species Level
Table S5. The information of the bacteria annotated in the soil community at species level No. Phylum Class Order Family Genus Species The number of contigs Abundance(%) 1 Firmicutes Bacilli Bacillales Bacillaceae Bacillus Bacillus cereus 1749 5.145782459 2 Bacteroidetes Cytophagia Cytophagales Hymenobacteraceae Hymenobacter Hymenobacter sedentarius 1538 4.52499338 3 Gemmatimonadetes Gemmatimonadetes Gemmatimonadales Gemmatimonadaceae Gemmatirosa Gemmatirosa kalamazoonesis 1020 3.000970902 4 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas indica 797 2.344876284 5 Firmicutes Bacilli Lactobacillales Streptococcaceae Lactococcus Lactococcus piscium 542 1.594633558 6 Actinobacteria Thermoleophilia Solirubrobacterales Conexibacteraceae Conexibacter Conexibacter woesei 471 1.385742446 7 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas taxi 430 1.265115184 8 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas wittichii 388 1.141545794 9 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas sp. FARSPH 298 0.876754244 10 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sorangium cellulosum 260 0.764953367 11 Proteobacteria Deltaproteobacteria Myxococcales Polyangiaceae Sorangium Sphingomonas sp. Cra20 260 0.764953367 12 Proteobacteria Alphaproteobacteria Sphingomonadales Sphingomonadaceae Sphingomonas Sphingomonas panacis 252 0.741416341 -

Genome Mining Reveals the Genus Xanthomonas to Be A
Royer et al. BMC Genomics 2013, 14:658 http://www.biomedcentral.com/1471-2164/14/658 RESEARCH ARTICLE Open Access Genome mining reveals the genus Xanthomonas to be a promising reservoir for new bioactive non-ribosomally synthesized peptides Monique Royer1, Ralf Koebnik2, Mélanie Marguerettaz1, Valérie Barbe3, Guillaume P Robin2, Chrystelle Brin4, Sébastien Carrere5, Camila Gomez1, Manuela Hügelland6, Ginka H Völler6, Julie Noëll1, Isabelle Pieretti1, Saskia Rausch6, Valérie Verdier2, Stéphane Poussier7, Philippe Rott1, Roderich D Süssmuth6 and Stéphane Cociancich1* Abstract Background: Various bacteria can use non-ribosomal peptide synthesis (NRPS) to produce peptides or other small molecules. Conserved features within the NRPS machinery allow the type, and sometimes even the structure, of the synthesized polypeptide to be predicted. Thus, bacterial genome mining via in silico analyses of NRPS genes offers an attractive opportunity to uncover new bioactive non-ribosomally synthesized peptides. Xanthomonas is a large genus of Gram-negative bacteria that cause disease in hundreds of plant species. To date, the only known small molecule synthesized by NRPS in this genus is albicidin produced by Xanthomonas albilineans. This study aims to estimate the biosynthetic potential of Xanthomonas spp. by in silico analyses of NRPS genes with unknown function recently identified in the sequenced genomes of X. albilineans and related species of Xanthomonas. Results: We performed in silico analyses of NRPS genes present in all published genome sequences of Xanthomonas spp., as well as in unpublished draft genome sequences of Xanthomonas oryzae pv. oryzae strain BAI3 and Xanthomonas spp. strain XaS3. These two latter strains, together with X. albilineans strain GPE PC73 and X. -

CAPITULO 1.Indd
CHAPTER 13 Potential for Biological Control in the Management of Cassava Pests* Elsa Liliana Melo and Carlos Alberto Ortega1 Biological Control direct methods for using, manipulating, or conserving natural enemies. In the first phases, the fundamental Biological control, in the ecological sense, as a phase aspects studied are taxonomy, biology, physiology, of natural control, may be defined as the regulation of genetics, ecology, demography, behavior, and nutrition the population density of a pest organism by natural of pests and their enemies (DeBach 1975). enemies (parasites, parasitoids, predators, or pathogens) at a level that would be equal or greater If necessary, a pest and its enemies are identified by than would have been reached by means of another a specialist, as the organism’s name and classification alternative. Applied biological control supposes are key to all existing knowledge on it, and thus professional activity or human manipulation that understanding and controlling it if it is pest, or using it if promotes the effectiveness of natural enemies it is a natural enemy (Cave 1995b). (DeBach 1977). Natural Enemies In a broad sense, biological control may also be defined as mortality or suppression of pest organisms In biological control, various natural enemies participate, by any biotic factor. In this wider sense, it is the direct for example, parasites, parasitoids, predators, and action of parasites, parasitoids, predators, and microorganisms. These organisms must be able to pathogens (i.e., natural enemies) and of competition respond quickly to the pest’s population dynamics, so with other species for natural resources (i.e., that proportionately more natural enemies are present antagonists) that regulate an organism’s population as the pest population increases. -

Insects and Mites Causing Yield Losses in Cassava*
CH A P TER 11 Insects and Mites Causing Yield Losses in Cassava* Anthony C. Bellotti1, Bernardo Arias V.2, Octavio Vargas H.3, and Jorge E. Peña4 Introduction • Those that attack fresh roots, damaging their culinary and industrial qualities (subterranean Farmers in the tropics frequently cultivate cassava for burrower bug, mealybugs, and white grubs). subsistence. This crop is regarded as hardy, as it is usually free of arthropod pests. Crop yields have • Those that attack stored dried cassava (weevils exceeded 70 t/ha in experiments at the Centro attacking flour, cassava chips, and cassava Internacional de Agricultura Tropical (CIAT)5, whereas starch). commercial production in regions of Colombia reaches 40 t/ha. World average, however, is 10 to 15 t/ha. At CIAT, studies on yield losses have been These figures indicate that several factors limit conducted for over 25 years to help identify research production, including pests as a significant constraint. priorities in the Cassava Program. This research has helped determine the true potential that key or primary Cassava pests include a broad range of arthropods pests have for causing losses, while at the same time, (Bellotti and Schoonhoven 1978a). According to the evaluate the susceptibility, resistance, or tolerance of crop’s stage of development in which they attack (crop many cultivars to pest attack. This research was phenology), pests can be divided into four categories: developed in different ecosystems, particularly in sites where the targeted pest is endemic, as in the case of • Those that attack planting materials, affecting mites in the Atlantic Coast, whiteflies in the plants in the field and stored stakes (fruit flies, Department of Tolima, and mealybugs in the Eastern stemborers, scale insects, white grubs, and Plains. -

Integrated Pest and Disease Management in Major
Activity 1. Arthropod taxonomic activities on cassava and other crops. Introduction The IPDM project provides a service of identifying arthropod pests collected from different crops, but especially those crops related to CIAT’s mandate and activities. These collections also include natural enemies related to crop pests, and much of this information is found in the subsequent activities in this report. A database is maintained of all collections and this is available to collaborating institutions and national research and extension programs. One of the activities of the CIAT convened “Global Whitefly IPM Project” is to provide taxonomic support for whiteflies and their natural enemies collected from the different agroecosystems of Latin America (Neotropics). Project collaborators located in the numerous countries involved in the project (about 16 in Latin America) continue to send shipments of specimens collected for processing, monitoring and identification. These identifications are of vital importance for the development and implementation of IPM projects in these countries. Collected specimens are conserved on microscope slides and documented in the whitefly database that is accessible through “Access.” This service is also extended to parasitoids as well as other species collected from associated crops (i.e. crops associated with cassava) and made available to all collaborating institutions and countries. During the past year training in collecting, monitoring, and identification of whiteflies has been extended to scientists, students and collaborators from numerous institutions. In addition to conventional morphological taxonomy techniques, during this year we have implemented in the cassava entomology laboratory, the application of molecular techniques based on PCR, especially for the identification of whiteflies and their parasitoids. -

Assessing Arthropod...Fening Et Al.Indd
Assessing arthropod pests and disease occurrence in cassa- va (Manihot esculenta Crantz) and cowpea (Vigna unguicu- lata L. Walp) intercropping system in the Ashanti Region, Ghana K. O. FENING*, J. N. L. LAMPTEY, M. B. MOCHIAH, B.W. AMOABENG, I. ADAMA, J. A. MANU-ADUENING & B. ADIYIAH (K. O. F: Soil and Irrigation Research Centre, Kpong, Institute of Agricultural Research, College of Agriculture and Consumer Sciences, University of Ghana, P. O. Box LG. 68, Accra, Ghana; J. N. L. L., M. B. M., I. A. & J. A.M: CSIR-Crops Research Institute, P. O. Box 3785, Kumasi, Ghana; B. A.: CSIR- Soil Research Institute, Academy Post Office, Kwadaso, Kumasi, Ghana) * Corresponding author’s email: [email protected] ABSTRACT On-station trials were conducted at CSIR-Crops Research Institute’s research farms at Kwadaso and Ejura, Ashanti Region, Ghana, during 2010/2011 cropping season, to assess the pests and disease occurrence in cassava-cowpea intercrop farming systems and their effect on yield of produce. Three improved cassava varieties and a local variety were intercropped with an im- proved cowpea variety, and cowpea only constituted the treatments. Abundance of Bemisia ta- baci was comparable between sole cassava and cassava-cowpea intercrop, but was significantly less on the sole cowpea. The incidence and severity of cassava mosaic disease was higher on the local variety than on the improved varieties. Root yield of cassava did not differ between sole and intercropped cassava with cowpea. However, Kwadaso had higher root yield than Ejura. Dry grain yield of cowpea was similar at Kwadaso and Ejura for both sole and intercrop scenarios. -

Bacteria-Killing Type IV Secretion Systems
fmicb-10-01078 May 18, 2019 Time: 16:6 # 1 REVIEW published: 21 May 2019 doi: 10.3389/fmicb.2019.01078 Bacteria-Killing Type IV Secretion Systems Germán G. Sgro1†, Gabriel U. Oka1†, Diorge P. Souza1‡, William Cenens1, Ethel Bayer-Santos1‡, Bruno Y. Matsuyama1, Natalia F. Bueno1, Thiago Rodrigo dos Santos1, Cristina E. Alvarez-Martinez2, Roberto K. Salinas1 and Chuck S. Farah1* 1 Departamento de Bioquímica, Instituto de Química, Universidade de São Paulo, São Paulo, Brazil, 2 Departamento de Genética, Evolução, Microbiologia e Imunologia, Instituto de Biologia, University of Campinas (UNICAMP), Edited by: Campinas, Brazil Ignacio Arechaga, University of Cantabria, Spain Reviewed by: Bacteria have been constantly competing for nutrients and space for billions of years. Elisabeth Grohmann, During this time, they have evolved many different molecular mechanisms by which Beuth Hochschule für Technik Berlin, to secrete proteinaceous effectors in order to manipulate and often kill rival bacterial Germany Xiancai Rao, and eukaryotic cells. These processes often employ large multimeric transmembrane Army Medical University, China nanomachines that have been classified as types I–IX secretion systems. One of the *Correspondence: most evolutionarily versatile are the Type IV secretion systems (T4SSs), which have Chuck S. Farah [email protected] been shown to be able to secrete macromolecules directly into both eukaryotic and †These authors have contributed prokaryotic cells. Until recently, examples of T4SS-mediated macromolecule transfer equally to this work from one bacterium to another was restricted to protein-DNA complexes during ‡ Present address: bacterial conjugation. This view changed when it was shown by our group that many Diorge P. -

J Ácaros, Plagas En El Cultivo De La Yuca (Manihot Esculenta ,Crantz )
Revista de la Facultad de Agronomia. Volumen 4, Número 1, Septiembre-Diciembre 1977. 63 - 95 Universidad del Zulia, Maracaíbo, Venezuela. Estudio preliminar de olgunos insectos ~j ácaros, plagas en el cultivo de la yuca (Manihot esculenta ,Crantz ) en el Estado ZuUa, Venezuela 1 MAGALLV nUlRos L. 2 COMPENDIO Se presenta un estudio preliminar de varios insectos y ácaros encontrados en el cultivo de la yuca, Manihot esculenta Crantz. A tal fin se realizaron 32 visitas a fincas o granjas y asentamientos campesinos de los Distritos Maracaibo, Mara, Páez, Perijá, Baralt y Colón del Estado Zulia, durante los meses comprendidos entre Abril de 1972 a Septiembre de 1973. Fueron identificados un total de 18 artrópodos fitófagos y 11 entre parásitos y depredadores. De acuerdo a la literatura consultada se da otra lista de insectos y ácaros fitófagos en Venezuela y otros países que han realizado estudios al respecto. Se incluyen algunas notas sobre la descripción, hábitos, daños e impor tancia económica de cada uno de los especímenes fitófagos, así como la metodología seguida en el campo y laboratorio durante la conducción de este trabajo. De las observaciones hechas se pueden inducir que existen insectos y ácaros de verdadera importancia económica tales como Chilom;ma darke; (Amsel), la cual está ampliamente distribuída en el Estado; Mononychellus caribbeanae (McGregor) y varias especies del Género Tetranychus, arácnidos éstos que causan daños importantes sobre todo en época de sequía. Comúnmente se reportan daños de Erinnyis ello (Linné) que pueden en algunos casos devorar una plantación cuando se manifiestan en gran número. Existen otras plagas que son potencialmente dañinas al cultivo de la yuca y las cuales se reportan en el presente estudio.