E – Esskastanien
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

CHESTNUT (CASTANEA Spp.) CULTIVAR EVALUATION for COMMERCIAL CHESTNUT PRODUCTION
CHESTNUT (CASTANEA spp.) CULTIVAR EVALUATION FOR COMMERCIAL CHESTNUT PRODUCTION IN HAMILTON COUNTY, TENNESSEE By Ana Maria Metaxas Approved: James Hill Craddock Jennifer Boyd Professor of Biological Sciences Assistant Professor of Biological and Environmental Sciences (Director of Thesis) (Committee Member) Gregory Reighard Jeffery Elwell Professor of Horticulture Dean, College of Arts and Sciences (Committee Member) A. Jerald Ainsworth Dean of the Graduate School CHESTNUT (CASTANEA spp.) CULTIVAR EVALUATION FOR COMMERCIAL CHESTNUT PRODUCTION IN HAMILTON COUNTY, TENNESSEE by Ana Maria Metaxas A Thesis Submitted to the Faculty of the University of Tennessee at Chattanooga in Partial Fulfillment of the Requirements for the Degree of Master of Science in Environmental Science May 2013 ii ABSTRACT Chestnut cultivars were evaluated for their commercial applicability under the environmental conditions in Hamilton County, TN at 35°13ꞌ 45ꞌꞌ N 85° 00ꞌ 03.97ꞌꞌ W elevation 230 meters. In 2003 and 2004, 534 trees were planted, representing 64 different cultivars, varieties, and species. Twenty trees from each of 20 different cultivars were planted as five-tree plots in a randomized complete block design in four blocks of 100 trees each, amounting to 400 trees. The remaining 44 chestnut cultivars, varieties, and species served as a germplasm collection. These were planted in guard rows surrounding the four blocks in completely randomized, single-tree plots. In the analysis, we investigated our collection predominantly with the aim to: 1) discover the degree of acclimation of grower- recommended cultivars to southeastern Tennessee climatic conditions and 2) ascertain the cultivars’ ability to survive in the area with Cryphonectria parasitica and other chestnut diseases and pests present. -

Quercus Robur (Fagaceae)
Quercus robur (Fagaceae) The map description EEBIO area The integrated map shows the distribution and changes in the areal’s boundaries of pedunculate oak (Quercus robur). Q. robur is the dominant forest- formative species in the belt of broadleaf and mixed 4 needleleaf-broadleaf forests in the plains of the European part of the former USSR (Sokolov et al. 1977). In the northern part of its areal Q. robur grows in river valleys. In the central part, it forms mixed forests with Picea abies; closer to the south – a belt of broadleaf forests where Q. robur dominates. At the areal’s south boundary it forms small (marginal) forests in ravines and flood-plains (Atlas of Areals and Resources… , 1976). Q. robur belongs to the thermophilic species. The low temperature bound of possible occurrence of oak forests is marked by an average annual of 2?C l (http://www.forest.ru – in Russian). Therefore, l l l l l l hypotretically, oak areal boundaries will shift along l ll l l l l l l l with the changes in the average annual temperature. l l l l l l l l l l l For Yearly map of averaged mean annual air l l l l l l l l l l l l l l l l l l lll temperature (Afonin A., Lipiyaynen K., Tsepelev V., l l l l l l l ll ll l l l 2005) see http://www.agroatlas.spb.ru Climate. l l l l l l l l l l l l l l l l Oak forests are of great importance for the water l l l l l ll l lll l l l l l l l l l l l l l l l l l l l regime and soil structure, especially on the steep l l l l l l l l l l l l l l l l l l l l l l l l l l l l l slopes of river valleys and in forest-poor areas. -

5 Fagaceae Trees
CHAPTER 5 5 Fagaceae Trees Antoine Kremerl, Manuela Casasoli2,Teresa ~arreneche~,Catherine Bod6n2s1, Paul Sisco4,Thomas ~ubisiak~,Marta Scalfi6, Stefano Leonardi6,Erica ~akker~,Joukje ~uiteveld', Jeanne ~omero-Seversong, Kathiravetpillai Arumuganathanlo, Jeremy ~eror~',Caroline scotti-~aintagne", Guy Roussell, Maria Evangelista Bertocchil, Christian kxerl2,Ilga porth13, Fred ~ebard'~,Catherine clark15, John carlson16, Christophe Plomionl, Hans-Peter Koelewijn8, and Fiorella villani17 UMR Biodiversiti Genes & Communautis, INRA, 69 Route d'Arcachon, 33612 Cestas, France, e-mail: [email protected] Dipartimento di Biologia Vegetale, Universita "La Sapienza", Piazza A. Moro 5,00185 Rome, Italy Unite de Recherche sur les Especes Fruitikres et la Vigne, INRA, 71 Avenue Edouard Bourlaux, 33883 Villenave d'Ornon, France The American Chestnut Foundation, One Oak Plaza, Suite 308 Asheville, NC 28801, USA Southern Institute of Forest Genetics, USDA-Forest Service, 23332 Highway 67, Saucier, MS 39574-9344, USA Dipartimento di Scienze Ambientali, Universitk di Parma, Parco Area delle Scienze 1lIA, 43100 Parma, Italy Department of Ecology and Evolution, University of Chicago, 5801 South Ellis Avenue, Chicago, IL 60637, USA Alterra Wageningen UR, Centre for Ecosystem Studies, P.O. Box 47,6700 AA Wageningen, The Netherlands Department of Biological Sciences, University of Notre Dame, Notre Dame, IN 46556, USA lo Flow Cytometry and Imaging Core Laboratory, Benaroya Research Institute at Virginia Mason, 1201 Ninth Avenue, Seattle, WA 98101, -

A New Leaf-Mining Moth from New Zealand, Sabulopteryx Botanica Sp
A peer-reviewed open-access journal ZooKeys 865: 39–65A new (2019) leaf-mining moth from New Zealand, Sabulopteryx botanica sp. nov. 39 doi: 10.3897/zookeys.865.34265 MONOGRAPH http://zookeys.pensoft.net Launched to accelerate biodiversity research A new leaf-mining moth from New Zealand, Sabulopteryx botanica sp. nov. (Lepidoptera, Gracillariidae, Gracillariinae), feeding on the rare endemic shrub Teucrium parvifolium (Lamiaceae), with a revised checklist of New Zealand Gracillariidae Robert J.B. Hoare1, Brian H. Patrick2, Thomas R. Buckley1,3 1 New Zealand Arthropod Collection (NZAC), Manaaki Whenua–Landcare Research, Private Bag 92170, Auc- kland, New Zealand 2 Wildlands Consultants Ltd, PO Box 9276, Tower Junction, Christchurch 8149, New Ze- aland 3 School of Biological Sciences, The University of Auckland, Private Bag 92019, Auckland, New Zealand Corresponding author: Robert J.B. Hoare ([email protected]) Academic editor: E. van Nieukerken | Received 4 March 2019 | Accepted 3 May 2019 | Published 22 Jul 2019 http://zoobank.org/C1E51F7F-B5DF-4808-9C80-73A10D5746CD Citation: Hoare RJB, Patrick BH, Buckley TR (2019) A new leaf-mining moth from New Zealand, Sabulopteryx botanica sp. nov. (Lepidoptera, Gracillariidae, Gracillariinae), feeding on the rare endemic shrub Teucrium parvifolium (Lamiaceae), with a revised checklist of New Zealand Gracillariidae. ZooKeys 965: 39–65. https://doi.org/10.3897/ zookeys.865.34265 Abstract Sabulopteryx botanica Hoare & Patrick, sp. nov. (Lepidoptera, Gracillariidae, Gracillariinae) is described as a new species from New Zealand. It is regarded as endemic, and represents the first record of its genus from the southern hemisphere. Though diverging in some morphological features from previously de- scribed species, it is placed in genus Sabulopteryx Triberti, based on wing venation, abdominal characters, male and female genitalia and hostplant choice; this placement is supported by phylogenetic analysis based on the COI mitochondrial gene. -

Diversity of Wisconsin Rosids
Diversity of Wisconsin Rosids . oaks, birches, evening primroses . a major group of the woody plants (trees/shrubs) present at your sites The Wind Pollinated Trees • Alternate leaved tree families • Wind pollinated with ament/catkin inflorescences • Nut fruits = 1 seeded, unilocular, indehiscent (example - acorn) *Juglandaceae - walnut family Well known family containing walnuts, hickories, and pecans Only 7 genera and ca. 50 species worldwide, with only 2 genera and 4 species in Wisconsin Carya ovata Juglans cinera shagbark hickory Butternut, white walnut *Juglandaceae - walnut family Leaves pinnately compound, alternate (walnuts have smallest leaflets at tip) Leaves often aromatic from resinous peltate glands; allelopathic to other plants Carya ovata Juglans cinera shagbark hickory Butternut, white walnut *Juglandaceae - walnut family The chambered pith in center of young stems in Juglans (walnuts) separates it from un- chambered pith in Carya (hickories) Juglans regia English walnut *Juglandaceae - walnut family Trees are monoecious Wind pollinated Female flower Male inflorescence Juglans nigra Black walnut *Juglandaceae - walnut family Male flowers apetalous and arranged in pendulous (drooping) catkins or aments on last year’s woody growth Calyx small; each flower with a bract CA 3-6 CO 0 A 3-∞ G 0 Juglans cinera Butternut, white walnut *Juglandaceae - walnut family Female flowers apetalous and terminal Calyx cup-shaped and persistant; 2 stigma feathery; bracted CA (4) CO 0 A 0 G (2-3) Juglans cinera Juglans nigra Butternut, white -
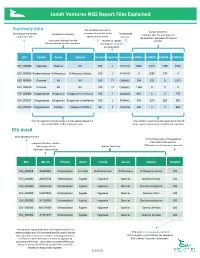
NGS Report Explained
Jonah Ventures NGS Report Files Explained Summary data The % of base pairs in the Sample identifiers Exact Sequence Variant sequence that match to the The detected Exact Sequence Variant Consensus Taxonomy The detected Numbers after the decimal point unique identifier species in the library. sequence. represent lab replicates of the same Taxonomic ranking from the Number of species sample. library matched to each sequence. matching the sequence at a given level. ESV Family Genus Species %match # Species Sequence S10001.1 S10002.1 S10003.1 S10003.2 ESV_000080 Fagaceae Quercus NA 100 7 AAAAAG… 3066 1340 5780 3462 ESV_000818 Orobanchaceae Orthocarpus Orthocarpus luteus 100 1 AAAAAG… 0 2582 249 0 ESV_000006 Poaceae NA NA 100 77 GAAAAG… 584 101 0 1039 ESV_000050 Poaceae NA NA 100 12 GAAAAG… 1328 0 0 0 ESV_000308 Polygonaceae Polygonum Polygonum humifusum 100 2 AAAAAG… 902 0 0 278 ESV_000027 Polygonaceae Eriogonum Eriogonum umbellatum 100 1 ATAAAG… 341 124 282 381 ESV_000520 Polygonaceae Fallopia Fallopia multiflora 99 1 AAAAAG… 126 0 0 994 “NA” at a taxonomic ranks means multiple species present in The number in each cell is the absolute number of the sample differ in that taxonomic rank times a given sequence was read by the sequencer. ESV detail Exact Sequence Variant The % of base pairs in the sequence that match to the species. Index identification number. that match to the species. Each sample has an Species Taxonomy 100% indicates all base pairs matched individual index number. ESV GB_ID Phylum Order Family Genus Species %match ESV_000818 -

The Effect of Insects on Seed Set of Ozark Chinquapin, Castanea Ozarkensis" (2017)
University of Arkansas, Fayetteville ScholarWorks@UARK Theses and Dissertations 5-2017 The ffecE t of Insects on Seed Set of Ozark Chinquapin, Castanea ozarkensis Colton Zirkle University of Arkansas, Fayetteville Follow this and additional works at: http://scholarworks.uark.edu/etd Part of the Botany Commons, Entomology Commons, and the Plant Biology Commons Recommended Citation Zirkle, Colton, "The Effect of Insects on Seed Set of Ozark Chinquapin, Castanea ozarkensis" (2017). Theses and Dissertations. 1996. http://scholarworks.uark.edu/etd/1996 This Thesis is brought to you for free and open access by ScholarWorks@UARK. It has been accepted for inclusion in Theses and Dissertations by an authorized administrator of ScholarWorks@UARK. For more information, please contact [email protected], [email protected], [email protected]. The Effect of Insects on Seed Set of Ozark Chinquapin, Castanea ozarkensis A thesis submitted in partial fulfillment of the requirements for the degree of Master of Science in Entomology by Colton Zirkle Missouri State University Bachelor of Science in Biology, 2014 May 2017 University of Arkansas This thesis is approved for recommendation to the Graduate Council. ____________________________________ Dr. Ashley Dowling Thesis Director ____________________________________ ______________________________________ Dr. Frederick Paillet Dr. Neelendra Joshi Committee Member Committee Member Abstract Ozark chinquapin (Castanea ozarkensis), once found throughout the Interior Highlands of the United States, has been decimated across much of its range due to accidental introduction of chestnut blight, Cryphonectria parasitica. Efforts have been made to conserve and restore C. ozarkensis, but success requires thorough knowledge of the reproductive biology of the species. Other Castanea species are reported to have characteristics of both wind and insect pollination, but pollination strategies of Ozark chinquapin are unknown. -

Pooled Whole‐Genome Sequencing of Interspecific Chestnut (Castanea
Received: 3 April 2018 | Revised: 7 June 2018 | Accepted: 10 June 2018 DOI: 10.1002/ece3.4336 ORIGINAL RESEARCH Pooled whole- genome sequencing of interspecific chestnut (Castanea) hybrids reveals loci associated with differences in caching behavior of fox squirrels (Sciurus niger L.) Nicholas R. LaBonte1 | Keith E. Woeste2 1Department of Crop Sciences, University of Illinois, Urbana, Illinois Abstract 2USDA Forest Service, Northern Research Dispersal of seeds by scatter- hoarding rodents is common among tropical and tem- Station, Hardwood Tree Improvement perate tree species, including chestnuts in the genus Castanea. Backcrossed (BC) in- and Regeneration Center, West Lafayette, Indiana terspecific hybrid chestnuts exhibit wide variation in seed traits: as the parent species (Castanea dentata and C. mollissima) have distinct seed phenotypes and tend to be Correspondence Nicholas R. LaBonte, Department of Crop handled differently by seed dispersers, phenotypic variation in BC trees is likely due Sciences, University of Illinois, 1201 W to inheritance of genes that have undergone divergent evolution in the parent spe- Gregory Drive, Urbana, IL 61801. Email: [email protected] cies. To identify candidate genomic regions for interspecific differences in seed dis- persal, we used tagged seeds to measure average dispersal distance for seeds of third- generation BC chestnuts and sequenced pooled whole genomes of mother trees with contrasting seed dispersal: high caching rate/long distance; low caching rate/short distance; no caching. Candidate regions affecting seed dispersal were identified as loci with more C. mollissima alleles in the high caching rate/ long- distance pool than expected by chance and observed in the other two pools. Functional an- notations of candidate regions included predicted lipid metabolism, dormancy regu- lation, seed development, and carbohydrate metabolism genes. -

An Evolutionary Perspective on Human Cross-Sensitivity to Tree Nut and Seed Allergens," Aliso: a Journal of Systematic and Evolutionary Botany: Vol
Aliso: A Journal of Systematic and Evolutionary Botany Volume 33 | Issue 2 Article 3 2015 An Evolutionary Perspective on Human Cross- sensitivity to Tree Nut and Seed Allergens Amanda E. Fisher Rancho Santa Ana Botanic Garden, Claremont, California, [email protected] Annalise M. Nawrocki Pomona College, Claremont, California, [email protected] Follow this and additional works at: http://scholarship.claremont.edu/aliso Part of the Botany Commons, Evolution Commons, and the Nutrition Commons Recommended Citation Fisher, Amanda E. and Nawrocki, Annalise M. (2015) "An Evolutionary Perspective on Human Cross-sensitivity to Tree Nut and Seed Allergens," Aliso: A Journal of Systematic and Evolutionary Botany: Vol. 33: Iss. 2, Article 3. Available at: http://scholarship.claremont.edu/aliso/vol33/iss2/3 Aliso, 33(2), pp. 91–110 ISSN 0065-6275 (print), 2327-2929 (online) AN EVOLUTIONARY PERSPECTIVE ON HUMAN CROSS-SENSITIVITY TO TREE NUT AND SEED ALLERGENS AMANDA E. FISHER1-3 AND ANNALISE M. NAWROCKI2 1Rancho Santa Ana Botanic Garden and Claremont Graduate University, 1500 North College Avenue, Claremont, California 91711 (Current affiliation: Department of Biological Sciences, California State University, Long Beach, 1250 Bellflower Boulevard, Long Beach, California 90840); 2Pomona College, 333 North College Way, Claremont, California 91711 (Current affiliation: Amgen Inc., [email protected]) 3Corresponding author ([email protected]) ABSTRACT Tree nut allergies are some of the most common and serious allergies in the United States. Patients who are sensitive to nuts or to seeds commonly called nuts are advised to avoid consuming a variety of different species, even though these may be distantly related in terms of their evolutionary history. -

Phylogeny of Rosids! ! Rosids! !
Phylogeny of Rosids! Rosids! ! ! ! ! Eurosids I Eurosids II Vitaceae Saxifragales Eurosids I:! Eurosids II:! Zygophyllales! Brassicales! Celastrales! Malvales! Malpighiales! Sapindales! Oxalidales! Myrtales! Fabales! Geraniales! Rosales! Cucurbitales! Fagales! After Jansen et al., 2007, Proc. Natl. Acad. Sci. USA 104: 19369-19374! Phylogeny of Rosids! Rosids! ! ! ! ! Eurosids I Eurosids II Vitaceae Saxifragales Eurosids I:! Eurosids II:! Zygophyllales! Brassicales! Celastrales! Malvales! Malpighiales! Sapindales! Oxalidales! Myrtales! Fabales! Geraniales! Rosales! Cucurbitales! Fagales! After Jansen et al., 2007, Proc. Natl. Acad. Sci. USA 104: 19369-19374! Alnus - alders A. rubra A. rhombifolia A. incana ssp. tenuifolia Alnus - alders Nitrogen fixation - symbiotic with the nitrogen fixing bacteria Frankia Alnus rubra - red alder Alnus rhombifolia - white alder Alnus incana ssp. tenuifolia - thinleaf alder Corylus cornuta - beaked hazel Carpinus caroliniana - American hornbeam Ostrya virginiana - eastern hophornbeam Phylogeny of Rosids! Rosids! ! ! ! ! Eurosids I Eurosids II Vitaceae Saxifragales Eurosids I:! Eurosids II:! Zygophyllales! Brassicales! Celastrales! Malvales! Malpighiales! Sapindales! Oxalidales! Myrtales! Fabales! Geraniales! Rosales! Cucurbitales! Fagales! After Jansen et al., 2007, Proc. Natl. Acad. Sci. USA 104: 19369-19374! Fagaceae (Beech or Oak family) ! Fagaceae - 9 genera/900 species.! Trees or shrubs, mostly northern hemisphere, temperate region ! Leaves simple, alternate; often lobed, entire or serrate, deciduous -

Chestnut Agroforestry in Galicia, Spain
Lessons learnt: Chestnut agroforestry in Galicia, Spain Project name AGFORWARD (613520) Work-package 3: Agroforestry for High Value Trees Specific group Chestnut agroforestry in Galicia, Spain Deliverable Contribution to Deliverable 3.8: Agroforestry for high value tree systems: Results of innovations Date of report 20 January 2018 Authors Rosa Mosquera-Losada, José Javier Santiago Freijanes, Nuria Ferreiro- Domingues and Antonio Rigueiro-Rodriguez Contact [email protected] Approved Anastasia Pantera Contents 1 Context ............................................................................................................................................. 2 2 Background ...................................................................................................................................... 2 3 Objectives......................................................................................................................................... 3 4 Methodology .................................................................................................................................... 3 5 Results .............................................................................................................................................. 9 6 Conclusions .................................................................................................................................... 11 7 Acknowledgements ....................................................................................................................... -
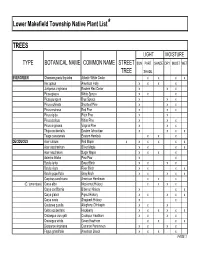
Native Plant List Trees.XLS
Lower Makefield Township Native Plant List* TREES LIGHT MOISTURE TYPE BOTANICAL NAME COMMON NAME STREET SUN PART SHADE DRY MOIST WET TREE SHADE EVERGREEN Chamaecyparis thyoides Atlantic White Cedar x x x x IIex opaca American Holly x x x x Juniperus virginiana Eastern Red Cedar x x x Picea glauca White Spruce x x x Picea pungens Blue Spruce x x x Pinus echinata Shortleaf Pine x x x Pinus resinosa Red Pine x x x Pinus rigida Pitch Pine x x Pinus strobus White Pine x x x Pinus virginiana Virginia Pine x x x Thuja occidentalis Eastern Arborvitae x x x x Tsuga canadensis Eastern Hemlock xx x DECIDUOUS Acer rubrum Red Maple x x x x x x Acer saccharinum Silver Maple x x x x Acer saccharum Sugar Maple x x x x Asimina triloba Paw-Paw x x Betula lenta Sweet Birch x x x x Betula nigra River Birch x x x x Betula populifolia Gray Birch x x x x x Carpinus caroliniana American Hornbeam x x x (C. tomentosa) Carya alba Mockernut Hickory x x x x Carya cordiformis Bitternut Hickory x x x Carya glabra Pignut Hickory x x x x x Carya ovata Shagbark Hickory x x Castanea pumila Allegheny Chinkapin xx x Celtis occidentalis Hackberry x x x x x x Crataegus crus-galli Cockspur Hawthorn x x x x Crataegus viridis Green Hawthorn x x x x Diospyros virginiana Common Persimmon x x x x Fagus grandifolia American Beech x x x x PAGE 1 Exhibit 1 TREES (cont'd) LIGHT MOISTURE TYPE BOTANICAL NAME COMMON NAME STREET SUN PART SHADE DRY MOIST WET TREE SHADE DECIDUOUS (cont'd) Fraxinus americana White Ash x x x x Fraxinus pennsylvanica Green Ash x x x x x Gleditsia triacanthos v.