Вісник Львів. Ун-Ту Visnyk of L'viv Univ. Серія Біологічна
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

An Investigation on Fishes of Bandirma Bay (Sea of Marmara)
BAÜ Fen Bil. Enst. Dergisi (2004).6.2 AN INVESTIGATION ON FISHES OF BANDIRMA BAY (SEA OF MARMARA) Hatice TORCU KOÇ University of Balikesir, Faculty of Science and Arts, Department of Hydrobiology, 10100, Balikesir, Turkey ABSTRACT This investigation was carried out for the determination of fish species living in Bandırma Bay (Sea of Marmara). Morphometric and meristic characters of of fishes caught by trawl and various nets in Bandırma Bay in the years of 1998-1999 were examined and some morphological, ecological properties, and local names of 34 determined species are given. Key Words: Fish Species, Systematic, Bandırma Bay BANDIRMA KÖRFEZİ (MARMARA DENİZİ) BALIKLARI ÜZERİNE BİR ARAŞTIRMA ÖZET Bu araştırma Bandırma Körfezi (Marmara Denizi)’nde yaşayan balık türlerini belirlemek amacıyla yapılmıştır. 1998-1999 yılları arasında körfez içinde trol ve çeşitli ağlar ile yakalanan balıkların morfometrik ve meristik karakterleri incelenmiş ve saptanan 34 türün bazı morfolojik, ekolojik özellikleri, ve yerel isimleri verilmiştir. Anahtar Kelimeler: Balık türleri, Sistematik, Bandırma Körfezi 1. INTRODUCTION Research on the sea fauna along the coasts of Turkey was initiated by foreign researchers at the begining of the 20th century and entered an intensive stage with Turkish researchers in the 1940s. However, the fish fauna of Turkish seas has still not been fully determined. Of these researchers, Tortonese (1) listed 300 species. Papaconstantinou and Tsimenids (2) listed 33 species. Papaconstantinou (3) listed the most of 447 species for Aegean Sea. Slastenenko (4) listed 200 species for Sea of Marmara and 189 species for Black Sea. Tortonese (1) reported 540 fish species in whole of Mediterranean. Demetropoulos and Neocleous (5) gave a list of fishes for Cyprus area. -

Download Full Text (Pdf)
Received: 25 October 2020 Accepted: 4 April 2021 DOI: 10.1111/jfb.14749 REGULAR PAPER FISH Sperm adaptation in relation to salinity in three goby species Kai Lindström1 | Jonathan Havenhand2,3 | Erica Leder2,4,5 | Sofie Schöld6 | Ola Svensson3,6,7 | Charlotta Kvarnemo3,6 1Environmental and Marine Biology, Åbo Akademi University, Turku, Finland Abstract 2Tjärnö Marine Laboratory, Department of In externally fertilizing species, the gametes of both males and females are exposed Marine Sciences, University of Gothenburg, to the influences of the environment into which they are released. Sperm are sensi- Strömstad, Sweden 3Centre for Marine Evolutionary Biology, tive to abiotic factors such as salinity, but they are also affected by biotic factors such University of Gothenburg, Gothenburg, as sperm competition. In this study, the authors compared the performance of sperm Sweden of three goby species, the painted goby, Pomatoschistus pictus, the two-spotted goby, 4Department of Biology, University of Turku, Turku, Finland Pomatoschistus flavescens, and the sand goby, Pomatoschistus minutus. These species 5Natural History Museum, University of Oslo, differ in their distributions, with painted goby having the narrowest salinity range and Oslo, Norway sand goby the widest. Moreover, data from paternity show that the two-spotted 6Department of Biological and Environmental Sciences, University of Gothenburg, goby experiences the least sperm competition, whereas in the sand goby sperm com- Gothenburg, Sweden petition is ubiquitous. The authors took sperm samples from dissected males and 7 Department for Pre-School and School exposed them to high salinity water (31 PSU) representing the North Sea and low Teacher Education, University of Borås, Borås, Sweden salinity water (6 PSU) representing the brackish Baltic Sea Proper. -

Marine Fishes from Galicia (NW Spain): an Updated Checklist
1 2 Marine fishes from Galicia (NW Spain): an updated checklist 3 4 5 RAFAEL BAÑON1, DAVID VILLEGAS-RÍOS2, ALBERTO SERRANO3, 6 GONZALO MUCIENTES2,4 & JUAN CARLOS ARRONTE3 7 8 9 10 1 Servizo de Planificación, Dirección Xeral de Recursos Mariños, Consellería de Pesca 11 e Asuntos Marítimos, Rúa do Valiño 63-65, 15703 Santiago de Compostela, Spain. E- 12 mail: [email protected] 13 2 CSIC. Instituto de Investigaciones Marinas. Eduardo Cabello 6, 36208 Vigo 14 (Pontevedra), Spain. E-mail: [email protected] (D. V-R); [email protected] 15 (G.M.). 16 3 Instituto Español de Oceanografía, C.O. de Santander, Santander, Spain. E-mail: 17 [email protected] (A.S); [email protected] (J.-C. A). 18 4Centro Tecnológico del Mar, CETMAR. Eduardo Cabello s.n., 36208. Vigo 19 (Pontevedra), Spain. 20 21 Abstract 22 23 An annotated checklist of the marine fishes from Galician waters is presented. The list 24 is based on historical literature records and new revisions. The ichthyofauna list is 25 composed by 397 species very diversified in 2 superclass, 3 class, 35 orders, 139 1 1 families and 288 genus. The order Perciformes is the most diverse one with 37 families, 2 91 genus and 135 species. Gobiidae (19 species) and Sparidae (19 species) are the 3 richest families. Biogeographically, the Lusitanian group includes 203 species (51.1%), 4 followed by 149 species of the Atlantic (37.5%), then 28 of the Boreal (7.1%), and 17 5 of the African (4.3%) groups. We have recognized 41 new records, and 3 other records 6 have been identified as doubtful. -

Molecular Taxonomy Study of Representatives of the Genus
ISSN 1314-6246 Tserkova et al. J. BioSci. Biotechnol. 2016, 5(3): 241-246 RESEARCH ARTICLE Feriha Tserkova 1, 2 Molecular taxonomy study of Daniela Klisarova 1 Iliya Denev 2 representatives of the genus Gobius inhabiting coastal waters of Black Sea region Authors’ addresses: ABSTRACT 1 Institute of Fish Resources (Agricultural Academy), According to their origin the Black Sea gobies can be divided to Ponto-Caspian 9000 Varna, Bulgaria. relicts and Mediterranean immigrants. The increase of species diversity in the Black 2 Department of Plant Physiology and Sea is a consequence of Mediterranean immigrants. The present study investigated Molecular Biology, University of the variability in Cytochrome b sequences isolated from two former Mediterranean Plovdiv Paisii Hilendarski, 4000 Plovdiv, Bulgaria. immigrant species: Gobius niger and Zosterisessor ophiocephalus. The annotated at NCBI Cyt b sequences of the species were also used to extend the reach of the study. Correspondence: The analyses demonstrated that Black Sea inhabited by four haplotypes of G. Feriha Tserkova Institute of Fish Resources, niger. Four other haplotypes were found in sequences of Mediterranean black Primorski 4 Bulv., gobies. In the Black Sea haplotype, 6 is predominant and 83.5% of all G. niger 9000 Varna, Bulgaria. representatives belong to it. Three other haplotypes (H_1; H_7 and H_8) were found Tel./fax: +359 52 632066 to form isolated populations. The Tajima D-test indicated that in the Black Sea G. e-mail: [email protected] Iliya Denev niger in a stage of expansion and significant evolutionary pressure according to data Department of Plant Physiology and from Maximum Composite Likelihood model of Tamura-Nei, which can explain the Molecular Biology, University of accumulation of mutation and appearance of new haplotypes. -

Body Size Correlates with Fertilization Success but Not Gonad Size in Grass Goby Territorial Males
Body Size Correlates with Fertilization Success but not Gonad Size in Grass Goby Territorial Males Jose Martin Pujolar, Lisa Locatello, Lorenzo Zane*, Carlotta Mazzoldi Department of Biology, University of Padova, Padova, Italy Abstract In fish species with alternative male mating tactics, sperm competition typically occurs when small males that are unsuccessful in direct contests steal fertilization opportunities from large dominant males. In the grass goby Zosterisessor ophiocephalus, large territorial males defend and court females from nest sites, while small sneaker males obtain matings by sneaking into nests. Parentage assignment of 688 eggs from 8 different nests sampled in the 2003–2004 breeding season revealed a high level of sperm competition. Fertilization success of territorial males was very high but in all nests sneakers also contributed to the progeny. In territorial males, fertilization success correlated positively with male body size. Gonadal investment was explored in a sample of 126 grass gobies collected during the period 1995–1996 in the same area (61 territorial males and 65 sneakers). Correlation between body weight and testis weight was positive and significant for sneaker males, while correlation was virtually equal to zero in territorial males. That body size in territorial males is correlated with fertilization success but not gonad size suggests that males allocate much more energy into growth and relatively little into sperm production once the needed size to become territorial is attained. The increased paternity of larger territorial males might be due to a more effective defense of the nest in comparison with smaller territorial males. Citation: Pujolar JM, Locatello L, Zane L, Mazzoldi C (2012) Body Size Correlates with Fertilization Success but not Gonad Size in Grass Goby Territorial Males. -

Helminthes of Goby Fish of the Hryhoryivsky Estuary (Black Sea, Ukraine)
Vestnik zoologii, 36(3): 71—76, 2002 © Yu. Kvach, 2002 UDC 597.585.1 : 616.99(262.55) HELMINTHES OF GOBY FISH OF THE HRYHORYIVSKY ESTUARY (BLACK SEA, UKRAINE) Yu. Kvach Department of Zoology, Odessa University, Shampansky prov., 2, Odessa, 65058 Ukraine E-mail: [email protected] Accepted 4 September 2001 Helminthes of Goby Fish of the Hryhoryivsky Estuary (Black Sea, Ukraine). Kvach Yu. – In the paper the data about the helminthofauna of Neogobius melanostomus, N. ratan, N. fluviatilis, Mesogobius batrachocephalus, Zosterisessor ophiocephalus, and Proterorhynus marmoratus in the Hryhoryivsky Estu- ary are presented. The fauna of gobies’ helmint hes consist of 10 species: 5 trematods (Cryptocotyle concavum met., C. lingua met., Pygidiopsis genata met., Acanthostomum imbutiforme met.), Asymphylo- dora pontica, one cestoda (Proteocephalus gobiorum), 2 nematods (Streptocara crassicauda l., Dichelyne minutus), and 2 acanthocephalans (Acanthocephaloides propinquus, Telosentis exiguus). Only one of trematods species was presented by adult stage. The modern fauna of helminthes and published data are compared. The relative stability of the goby fish helminthofauna of the Estuary is mentioned. Key words: goby, helminth, infection, Hryhoryivsky Estuary. Ãåëüìèíòû áû÷êîâûõ ðûá Ãðèãîðüåâñêîãî ëèìàíà (×åðíîå ìîðå, Óêðàèíà). Êâà÷ Þ. – Èññëåäî- âàíà ãåëüìèíòîôàóíà Neogobius melanostomus, N. ratan, N. fluviatilis, Mesogobius batrachocephalus, Zosterisessor ophiocephalus è Proterorhynus marmoratus èç Ãðèãîðüåâñêîãî ëèìàíà. Ôàóíà ãåëüìèí- òîâ áû÷êîâ âêëþ÷àåò 10 âèäîâ. Èç íèõ 5 âèäîâ òðåìàòîä (Cryptocotyle lingua met., C. concavum met., Pygidiopsis genata met., Acanthostomum imbutiforme met., Asymphylodora pontica), îäèí âèä öåñ- òîä (Proteocephalus gobiorum), 2 âèäà íåìàòîä (Streptocara crassicauda l., Dichelyne minutus), 2 âèäà ñêðåáíåé (Acanthocephaloides propinquus, Telosentis exiguus). Èç ïÿòè âèäîâ òðåìàòîä òîëüêî îäèí ïðåäñòàâëåí âçðîñëîé ñòàäèåé. -

Scolex Pleuronectis (Cestoda) Infections in Several Bony Fish Species Collected from Sinop Coasts of the Black Sea
Sinop Üniversitesi Fen Bilimleri Dergisi Sinop Uni J Nat Sci 2(1): 150 - 158 (2017) ISSN: 2536-4383 Araştırma Makalesi Scolex pleuronectis (Cestoda) Infections in Several Bony Fish Species Collected from Sinop Coasts of the Black Sea Sevilay Güneydağ a,b, Hakan Özkana, Ahmet Özer *a aSinop University, Faculty of Fisheries, 57000 Sinop b Kocaeli University, Graduate School of Natural and Applied Sciences, 41380 Kocaeli Abstract In the present study, a tetraphylleadean larval cestode Scolex pleuronectis Müller, 1788 was determined in the intestine of shore rockling Gaidropsarus mediterraneus, Atlantic horse mackerel Trachurus trachurus, blotched picarel Spicara flexuosa, grass goby Zosterissesor ophiocephalus and round goby Neogobius melanostomus. Fish were collected by commercial fishermen in Sinop coasts of the Black Sea in April and May 2014. Infection prevalence and mean intensity values were determined as 12.5% and 2.00 ± 0.0 in shore rockling; 4.76% and 1.00 ± 0.0 in Atlantic horse mackerel; 20.0% and 6.80 ± 3.20 in botched picarel; 20.00% and 4.00 ± 0.0 in grass goby and, 1.44% and 55.00 ± 0.0 in round goby. Our results showed that this parasite species can be found widely at its larval stage in many bony fish species in the Black Sea. Keywords: Scolex pleuronectis, Cestoda, Sinop, Black Sea Karadeniz’in Sinop Kıyılarından Yakalanan Bazı Kemikli Balıklarda Scolex pleuronectis (Cestoda) Enfeksiyonları Öz Bu araştırmada, Nisan-Mayıs 2014 tarihlerinde Karadeniz’in Sinop kıyılarında balıkçı tekneleri ile avlanan Gelincik balığı (Gaidropsarus mediterraneus), İstavrit balığı (Trachurus trachurus), İzmarit balığı (Spicara flexuosa), sazkayası balığı (Zosterissesor ophiocephalus), Kum kaya balığı (Neogobius melanostomus) mide - bağırsak sistemleri bir tetraphylleadean larval sestod olan Scolex pleuronectis Müller, 1788 enfeksiyonları araştırıldı. -
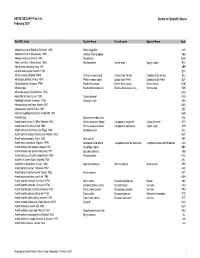
ASFIS ISSCAAP Fish List February 2007 Sorted on Scientific Name
ASFIS ISSCAAP Fish List Sorted on Scientific Name February 2007 Scientific name English Name French name Spanish Name Code Abalistes stellaris (Bloch & Schneider 1801) Starry triggerfish AJS Abbottina rivularis (Basilewsky 1855) Chinese false gudgeon ABB Ablabys binotatus (Peters 1855) Redskinfish ABW Ablennes hians (Valenciennes 1846) Flat needlefish Orphie plate Agujón sable BAF Aborichthys elongatus Hora 1921 ABE Abralia andamanika Goodrich 1898 BLK Abralia veranyi (Rüppell 1844) Verany's enope squid Encornet de Verany Enoploluria de Verany BLJ Abraliopsis pfefferi (Verany 1837) Pfeffer's enope squid Encornet de Pfeffer Enoploluria de Pfeffer BJF Abramis brama (Linnaeus 1758) Freshwater bream Brème d'eau douce Brema común FBM Abramis spp Freshwater breams nei Brèmes d'eau douce nca Bremas nep FBR Abramites eques (Steindachner 1878) ABQ Abudefduf luridus (Cuvier 1830) Canary damsel AUU Abudefduf saxatilis (Linnaeus 1758) Sergeant-major ABU Abyssobrotula galatheae Nielsen 1977 OAG Abyssocottus elochini Taliev 1955 AEZ Abythites lepidogenys (Smith & Radcliffe 1913) AHD Acanella spp Branched bamboo coral KQL Acanthacaris caeca (A. Milne Edwards 1881) Atlantic deep-sea lobster Langoustine arganelle Cigala de fondo NTK Acanthacaris tenuimana Bate 1888 Prickly deep-sea lobster Langoustine spinuleuse Cigala raspa NHI Acanthalburnus microlepis (De Filippi 1861) Blackbrow bleak AHL Acanthaphritis barbata (Okamura & Kishida 1963) NHT Acantharchus pomotis (Baird 1855) Mud sunfish AKP Acanthaxius caespitosa (Squires 1979) Deepwater mud lobster Langouste -

Research Note Prevalence, Protein Analysis and Possible Preventive Measures Against Zoonotic Anisakid Larvae Isolated from Marin
©2015 Institute of Parasitology, SAS, Košice DOI 10.1515/helmin-2015-0060 HELMINTHOLOGIA, 52, 4: 375 – 383, 2015 Research Note Prevalence, protein analysis and possible preventive measures against zoonotic anisakid larvae isolated from marine Atherina fi sh M. SAMIR1,2*, M. A. AMIN1, A. O. HASSAN3,4, A. M. MERWAD1, M. A. I. AWADALLAH1 1Department of Zoonoses, Faculty of Veterinary Medicine, Zagazig University, Egypt *E-mail: [email protected], [email protected]; 2TWINCORE, Centre for Experimental and Clinical Infection Research, Hannover, Germany; 3Department of Parasitology, Faculty of Veterinary Medicine, Zagazig University, Egypt; 4College of Applied Medical Sciences, University of Hail, Kingdom of Saudia Arabia Article info Summary Received November 12, 2014 Anisakidosis is a zoonotic infection caused by ingestion of raw or undercooked marine fi sh including Accepted May 5, 2015 Atherina. In some parts of Egypt, the prevalence of anisakid larvae in marine Atherina still, largely, undetermined. Moreover, the currently used procedures are insuffi cient to avoid human infection. The aim of this study was to identify the prevalence of anisakid larvae in marine Atherina and to test the effect of several treatment procedures on the viability of anisakid larvae. The infection rate of marine Atherina with anisakid larvae was 23.12 %. Anisakid larvae protein revealed molecular weights ranged from 11.5 – 118.5 Kilo Dalton (KDa.). Moreover, freezing at -20 °C for 21 hours (hrs.) as well as vinegar (5 %) treatment for 3 days were the most effective ways to inactivate the larvae. This study states the zoonotic risk of consuming raw or undercooked marine Atherina and highlights the importance of freezing and vinegar treatment in preventing human infection. -

New Fisheries-Related Data from the Mediterranean Sea (October, 2015) K
Collective Aticle B Mediterranean Marine Science Indexed in WoS (Web of Science, ISI Thomson) and SCOPUS The journal is available on line at http://www.medit-mar-sc.net DOI: http://dx.doi.org/10.12681/mms.1396 New Fisheries-related data from the Mediterranean Sea (October, 2015) K. TSAGARAKIS1, N. Başusta2, a. BAŞUSTA2, F. BIANDOLINO3, D. BOSTANCI4, K. BuZ2, Z. DjoDjo5, j. Dulčić6, M. GÖKoĞlu7, A.C. GÜCÜ8, A. MACHIAS1, C. D. MARAVELIAS1, Y. ÖZVaRol9, N. POLAT10, E. PRATO3, P.VasilaKoPoulos1 and S. YEDIER4 1 Institute of Marine Biological Resources and Inland Waters, Hellenic Centre for Marine Research, 46.7 km Athens-Sounio ave., 19013, Anavyssos, Attiki, Greece 2 Fisheries Faculty, Firat University, TR-23119, Elazig, Turkey 3 CNR-Institute for Coastal Marine Environment U.O.S. Taranto, Via Roma 3, 74100 Taranto, Italy 4 Faculty of Science and Arts, Department of Biology, Ordu University, Ordu, Turkey 5 University of Dubrovnik, Department of Aquaculture, 20000 Dubrovnik, Croatia 6 Institute of Oceanography and Fisheries, POB 500, 21000 Split, Croatia 7 Aquaculture Department, Faculty of Fisheries, Akdeniz University, Antalya, Turkey 8 Department of Marine and Fisheries, Institute of Marine Sciences, Middle East Technical University, Mersin, Turkey 9 Fisheries Department, Faculty of Fisheries, Akdeniz University, Antalya, Turkey 10 Faculty of Science and Arts, Department of Biology, OMU, Samsun, Turkey Abstract In this third Collective Article, with fisheries-related data from the Mediterranean Sea, we present the historical length distribution of Lophius budegassa in the catch of commercial trawlers in the Greek seas; length-weight and length-length relationships of five flatfish species (Lepidorhombus boscii, L. -

Bioaccumulation of Metals in Tissues of Marine Animals, Part II: Metal Concentrations in Animal Tissues
Pol. J. Environ. Stud. Vol. 20, No. 5 (2011), 1127-1146 Invited Article Bioaccumulation of Metals in Tissues of Marine Animals, Part II: Metal Concentrations in Animal Tissues Anna Jakimska1*, Piotr Konieczka1, Krzysztof Skóra2, Jacek Namieśnik1** 1Department of Analytical Chemistry, Chemical Faculty, Gdańsk University of Technology, G. Narutowicza 11/12, 80-233 Gdańsk, Poland 2Marine Station Institute of Oceanography in Hel (G215) Received: 30 May 2011 Accepted: 6 June 2011 Abstract The bioaccumulation of metals in an animal depends on a multitude of factors: biotic ones, like its body dimensions and mass, age, sex, diet, metabolism, and position in the trophic web; and abiotic ones, such as the distribution of metals in its environment, salinity, temperature, and pH of the water, habitat type, and interac- tions with other metals. But it is diet that has the greatest influence on the accumulation of metals in animal tissues. Bioaccumulation is a complex process, requiring the simultaneous examination of metal levels in the tissues of animals from at least two adjacent trophic levels. To illustrate the differences in metal concentrations in animals, data are presented on heavy metal levels in the tissues of different groups of animals (marine mol- luscs, crustaceans, echinoderms, fish, sea turtles, birds, and mammals) from various levels of the trophic pyra- mid. Most commonly, metal concentrations are higher in larger animals that are end members of a trophic chain than in the smaller organisms they feed on. Since to a large extent an animal’s habitat determines the level of metals in its body, these data are generally indicators of the extent of pollution of the water body in which it lives. -

An INIRO DUCTION
Introduction to the Black Sea Ecology Item Type Book/Monograph/Conference Proceedings Authors Zaitsev, Yuvenaly Publisher Smil Edition and Publishing Agency ltd Download date 23/09/2021 11:08:56 Link to Item http://hdl.handle.net/1834/12945 Yuvenaiy ZAITSEV шшшшшшишшвивявшиншшшаттшшшштшшщ an INIRO DUCTION TO THE BLACK SEA ECOLOGY Production and publication of this book was supported by the UNDF-GEF Black Sea Ecosystem Recovery Project (BSERP) Istanbul, TURKEY an INTRO Yuvenaly ZAITSEV TO THE BLACK SEA ECOLOGY Smil Editing and Publishing Agency ltd Odessa 2008 УДК 504.42(262.5) 3177 ББК 26.221.8 (922.8) Yuvenaly Zaitsev. An Introduction to the Black Sea Ecology. Odessa: Smil Edition and Publishing Agency ltd. 2008. — 228 p. Translation from Russian by M. Gelmboldt. ISBN 978-966-8127-83-0 The Black Sea is an inland sea surrounded by land except for the narrow Strait of Bosporus connecting it to the Mediterranean. The huge catchment area of the Black Sea receives annually about 400 ктУ of fresh water from large European and Asian rivers (e.g. Danube, Dnieper, Yeshil Irmak). This, combined with the shallowness of Bosporus makes the Black Sea to a considerable degree a stagnant marine water body wherein the dissolved oxygen disappears at a depth of about 200 m while hydrogen sulphide is present at all greater depths. Since the 1970s, the Black Sea has been seriously damaged as a result of pollution and other man-made factors and was studied by dif ferent specialists. There are, of course, many excellent works dealing with individual aspects of the Black Sea biology and ecology.