Efeito De Perturbações Antrópicas
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
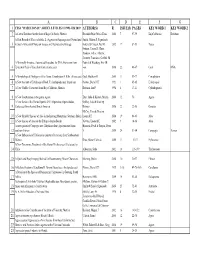
Haseltonia Articles and Authors.Xlsx
ABCDEFG 1 CSSA "HASELTONIA" ARTICLE TITLES #1 1993–#26 2019 AUTHOR(S) R ISSUE(S) PAGES KEY WORD 1 KEY WORD 2 2 A Cactus Database for the State of Baja California, Mexico Resendiz Ruiz, María Elena 2000 7 97-99 BajaCalifornia Database A First Record of Yucca aloifolia L. (Agavaceae/Asparagaceae) Naturalized Smith, Gideon F, Figueiredo, 3 in South Africa with Notes on its uses and Reproductive Biology Estrela & Crouch, Neil R 2012 17 87-93 Yucca Fotinos, Tonya D, Clase, Teodoro, Veloz, Alberto, Jimenez, Francisco, Griffith, M A Minimally Invasive, Automated Procedure for DNA Extraction from Patrick & Wettberg, Eric JB 4 Epidermal Peels of Succulent Cacti (Cactaceae) von 2016 22 46-47 Cacti DNA 5 A Morphological Phylogeny of the Genus Conophytum N.E.Br. (Aizoaceae) Opel, Matthew R 2005 11 53-77 Conophytum 6 A New Account of Echidnopsis Hook. F. (Asclepiadaceae: Stapeliae) Plowes, Darrel CH 1993 1 65-85 Echidnopsis 7 A New Cholla (Cactaceae) from Baja California, Mexico Rebman, Jon P 1998 6 17-21 Cylindropuntia 8 A New Combination in the genus Agave Etter, Julia & Kristen, Martin 2006 12 70 Agave A New Series of the Genus Opuntia Mill. (Opuntieae, Opuntioideae, Oakley, Luis & Kiesling, 9 Cactaceae) from Austral South America Roberto 2016 22 22-30 Opuntia McCoy, Tom & Newton, 10 A New Shrubby Species of Aloe in the Imatong Mountains, Southern Sudan Leonard E 2014 19 64-65 Aloe 11 A New Species of Aloe on the Ethiopia-Sudan Border Newton, Leonard E 2002 9 14-16 Aloe A new species of Ceropegia sect. -

Approved Plant List 10/04/12
FLORIDA The best time to plant a tree is 20 years ago, the second best time to plant a tree is today. City of Sunrise Approved Plant List 10/04/12 Appendix A 10/4/12 APPROVED PLANT LIST FOR SINGLE FAMILY HOMES SG xx Slow Growing “xx” = minimum height in Small Mature tree height of less than 20 feet at time of planting feet OH Trees adjacent to overhead power lines Medium Mature tree height of between 21 – 40 feet U Trees within Utility Easements Large Mature tree height greater than 41 N Not acceptable for use as a replacement feet * Native Florida Species Varies Mature tree height depends on variety Mature size information based on Betrock’s Florida Landscape Plants Published 2001 GROUP “A” TREES Common Name Botanical Name Uses Mature Tree Size Avocado Persea Americana L Bahama Strongbark Bourreria orata * U, SG 6 S Bald Cypress Taxodium distichum * L Black Olive Shady Bucida buceras ‘Shady Lady’ L Lady Black Olive Bucida buceras L Brazil Beautyleaf Calophyllum brasiliense L Blolly Guapira discolor* M Bridalveil Tree Caesalpinia granadillo M Bulnesia Bulnesia arboria M Cinnecord Acacia choriophylla * U, SG 6 S Group ‘A’ Plant List for Single Family Homes Common Name Botanical Name Uses Mature Tree Size Citrus: Lemon, Citrus spp. OH S (except orange, Lime ect. Grapefruit) Citrus: Grapefruit Citrus paradisi M Trees Copperpod Peltophorum pterocarpum L Fiddlewood Citharexylum fruticosum * U, SG 8 S Floss Silk Tree Chorisia speciosa L Golden – Shower Cassia fistula L Green Buttonwood Conocarpus erectus * L Gumbo Limbo Bursera simaruba * L -

Endothelium-Independent Vasorelaxation by Dichloromethanolic Fraction from Anogeissus Leiocarpa (DC) Guill. Et Perr. (Combretace
Vol. 13(4), pp. 25-35, 22 February, 2019 DOI: 10.5897/AJPP2018.4992 Article Number: 5AC3DCE60214 ISSN: 1996-0816 Copyright ©2019 African Journal of Pharmacy and Author(s) retain the copyright of this article Pharmacology http://www.academicjournals.org/AJPP Full Length Research Paper Endothelium-independent vasorelaxation by dichloromethanolic fraction from Anogeissus leiocarpa (DC) Guill. Et Perr. (Combretaceae) bark of trunk on 2+ porcine coronary artery rings: Involvement of [Ca ]i decreased and phosphodiesterases inhibition Belemnaba Lazare1,2*, Nitiéma Mathieu2,3, Ouédraogo Sylvin2, Auger Cyril1, Schini-Kerth Valérie B. 1 and Bernard Bucher1 1UMR CNRS 7213, Laboratoire de Biophotonique et Pharmacologie, Faculté de Pharmacie Université de Strasbourg, Illkirch, France 2Institut de Recherche en Sciences de la Santé (IRSS/CNRST), Ouagadougou, Burkina Faso 3 Université Ouaga I Pr Joseph KI-ZERBO, Ouagadougou, Burkina Faso Received 20 December, 2018; Accepted 16 January, 2019 Anogeissus leiocarpa (DC) Guill. et Perr. belongs to the Combretaceae family and was previously named A. leiocarpa (DC) Guill. Et Perr. It has been widely used in Burkina Faso by traditional medicine for the treatment of hypertension. Previous study showed that the dichloromethanolic fraction from the barks of trunk of A. leiocarpa (ALF) has induced an endothelium-independent and endothelium- dependent vasodilation effect and had the capacity to inhibit in vitro, purified cyclic nucleotide phosphodiesterases (PDEs) activity. The aims of this study were to better underline ALF-induced endothelium-independent vasorelaxation in an organ model. The results showed that ALF significantly reduce the contractile response to U46619 in porcine coronary artery rings without endothelium that were in concentration-dependent manner. -

Oleochemistry Potential from Brazil Northeastern Exotic Plants M.C
Oleochemistry potential from Brazil northeastern exotic plants M.C. Lisboa, F.M.S. Wiltshire, R Souza, A.T. Fricks, C. Dariva, F. Carrière, Á.S. Lima, C.M.F. Soares To cite this version: M.C. Lisboa, F.M.S. Wiltshire, R Souza, A.T. Fricks, C. Dariva, et al.. Oleochemistry potential from Brazil northeastern exotic plants. Biochimie, Elsevier, In press, 10.1016/j.biochi.2020.09.002. hal-02946034 HAL Id: hal-02946034 https://hal.archives-ouvertes.fr/hal-02946034 Submitted on 22 Sep 2020 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. 1 Preprint of the article published in Biochimie (2020) 2 DOI: 10.1016/j.biochi.2020.09.002 3 4 OLEOCHEMISTRY POTENTIAL FROM BRAZIL NORTHEASTERN EXOTIC 5 PLANTS 6 M. C. Lisboa a,b,c , F. M. S. Wiltshire a,b , R. L. Souza a,b , A.T. Fricks a,b , C. Dariva a,b , F. 7 Carrière c, Á. S. Lima a,b , C. M. F. Soares a,b 8 9 aUniversidade Tiradentes, Av. Murilo Dantas, 300, Farolândia, Aracaju, SE 49032-490, 10 Brazil. 11 bInstituto de Tecnologia e Pesquisa, Av. -

First Record of Cnidoscolus Obtusifolius Pohl (Euphorbiaceae) for Paraíba State, Northeastern Brazil
Acta Brasiliensis 4(3): 187-190, 2020 Note http://revistas.ufcg.edu.br/ActaBra http://dx.doi.org/10.22571/2526-4338378 First record of Cnidoscolus obtusifolius Pohl (Euphorbiaceae) for Paraíba State, northeastern Brazil a i b i Maiara Bezerra Ramos h , Maria Gracielle Rodrigues Maciel h , José Iranildo Miranda de c i a,c i Melo h , Sérgio de Faria Lopes a Programa de Pós-Graduação em Etnobiologia e Conservação da Natureza, Universidade Estadual da Paraíba, Campina Grande, 58429-500, Paraíba, Brasil. *[email protected] b Universidade Estadual da Paraíba, Campina Grande, 58429-500, Paraíba, Brasil. c Programa de Pós-Graduação em Ecologia e Conservação, Universidade Estadual da Paraíba, Campina Grande, 58429-500, Paraíba, Brasil. Received: April 29, 2020 / Acepted: June 26, 2020/ Published online: September 28, 2020 Abstract Cnidoscolus obtusifolius Pohl (Euphorbiaceae), species so far known from Minas Gerais, Bahia, Alagoas and Pernambuco States in Brazil is reported for the first time for the State of Paraíba, in the northeastern region of the country. Specimens of this taxon were collected in a fragmented area considered a Caatinga vegetation relict, where total annual precipitation is 700 mm on average and elevation of 644 m a.s.l. The records were made in September and October 2019, when the species was in fertile stage as it bore flowers and fruits. Here we provide a description of its morphology along with taxonomic comments, data on the geographical range and detailed images of the species. Keywords: Caatinga; diversity; floristics; Malpighiales. Primeiro registro de Cnidoscolus obtusifolius Pohl (Euphorbiaceae) no estado da Paraíba, nordeste do Brasil Resumo Cnidoscolus obtusifolius Pohl (Euphorbiaceae) espécie até então conhecida para os Estados de Minas Gerais (Sudeste), Bahia, Alagoas e Pernambuco (Nordeste), Brasil, está sendo registrada pela primeira vez no Estado da Paraíba, nordeste do Brasil. -

Apresentação Do Powerpoint
UNIVERSIDADE FEDERAL DO RIO GRANDE DO NORTE CENTRO DE BIOCIÊNCIAS PROGRAMA DE PÓS-GRADUAÇÃO EM SISTEMÁTICA E EVOLUÇÃO CAPPARACEAE: FLORA DO RIO GRANDE DO NORTE E BIOGEOGRAFIA NO SEMIÁRIDO BRASILEIRO RAIMUNDO LUCIANO SOARES NETO ________________________________________________ Dissertação de Mestrado Natal/RN, fevereiro de 2015 RAIMUNDO LUCIANO SOARES NETO CAPPARACEAE: FLORA DO RIO GRANDE DO NORTE E BIOGEOGRAFIA NO SEMIÁRIDO BRASILEIRO Dissertação apresentada ao Programa de Pós-graduação em Sistemática e Evolução da Universidade Federal do Rio Grande do Norte, como parte dos requisitos para a obtenção do título de Mestre. Orientador: Dr. Jomar Gomes Jardim NATAL - RN 2015 Catalogação da Publicação na Fonte. UFRN / Biblioteca Setorial do Centro de Biociências Soares Neto, Raimundo Luciano. Capparaceae: flora do Rio Grande do Norte e biogeografia no semiárido brasileiro / Raimundo Luciano Soares Neto. – Natal, RN, 2015. 88 f.: il. Orientador: Prof. Dr. Jomar Gomes Jardim. Dissertação (Mestrado) – Universidade Federal do Rio Grande do Norte. Centro de Biociências. Programa de Pós-Graduação em Sistemática e Evolução. 1. Caatinga – Dissertação. 2. Brassicales. – Dissertação. 3. Distribuição geográfica. – Dissertação. I. Jardim, Jomar Gomes. II. Universidade Federal do Rio Grande do Norte. III. Título. RN/UF/BSE-CB CDU 574 BANCA EXAMINADORA ____________________________________________________________________ Dr. Jefferson Guedes de Carvalho Sobrinho (Universidade Estadual de Feira de Santana – UEFS) ____________________________________________________________________ Dr. Leonardo de Melo Versieux (Universidade Federal do Rio Grande do Norte – UFRN) ____________________________________________________________________ Dr. Jomar Gomes Jardim (Universidade Federal do Rio Grande do Norte – UFRN) Orientador NATAL – RN 2015 À minha mãe e minha avó, que sempre dedicaram suas vidas por mim. AGRADECIMENTOS Certamente nem todos serão mencionados e nem por isso deixam de ter importância. -

Review of on the Basis of of 2014 CITES Quotas of Species Selected
UNEP-WCMC technical report Review of species selected on the basis of the Analysis of 2014 CITES export quotas Part II (Version edited for public release) Review of species selected on the basis of the Analysis of 2014 CITES export quotas. Part II. Prepared for The European Commission, Directorate General Environment , Directorate E - Global & Regional Challenges, LIFE ENV.E.2. – Global Sustainability, Trade & Multilateral Agreements , Brussels, Belgium Published November 2014 Copyright European Commission 2014 Citation UNEP-WCMC. 2014. Review of species selected on the basis of the Analysis of 2014 CITES export quotas. Part II. UNEP-WCMC, Cambridge. The UNEP World Conservation Monitoring Centre (UNEP-WCMC) is the specialist biodiversity assessment centre of the United Nations Environment Programme, the world’s foremost intergovernmental environmental organization. The Centre has been in operation for over 30 years, combining scientific research with policy advice and the development of decision tools. We are able to provide objective, scientifically rigorous products and services to help decision -makers recognize the value of biodiversity and apply this knowledge to all that they do. To do this, we collate and verify data on biodiversity and ecosystem services that we analyze and interpret in comprehensive assessments, making the results available in ap propriate forms for national and international level decision-makers and businesses. To ensure that our work is both sustainable and equitable we seek to build the capacity of partners where needed, so that they can provide the same services at national and regional scales. The contents of this report do not necessarily reflect the views or policies of UNEP, contributory organisations or editors. -

ANTIDIABETIC POTENTIALS of LIPOSPHERES ENCAPSULATING Anogeissus Leiocarpus DC Guill & Perr ROOT BARK METHANOL EXTRACT
ANTIDIABETIC POTENTIALS OF LIPOSPHERES ENCAPSULATING Anogeissus leiocarpus DC Guill & Perr ROOT BARK METHANOL EXTRACT BY UCHECHI OKORO PG/M.PHARM/10/52392 A PROJECT PRESENTED IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE AWARD OF THE DEGREE OF MASTER OF PHARMACY (M.PHARM) IN PHYSICAL PHARMACEUTICS OF THE UNIVERSITY OF NIGERIA NSUKKA SUPERVISOR: PROF. A. A. ATTAMA DEPARTMENT OF PHARMACEUTICS, FACULTY OF PHARMACEUTICAL SCIENCES, UNIVERSITY OF NIGERIA, NSUKKA APRIL, 2014 i TITLE ANTIDIABETIC POTENTIALS OF LIPOSPHERES ENCAPSULATING Anogeissus leiocarpus DC Guill & Perr ROOT BARK METHANOL EXTRACT ii CERTIFICATION This is to certify that Uchechi Okoro, a postgraduate student in the Department of Pharmaceutics, with the registration number PG/M.Pharm./10/52392, has satisfactorily completed the requirements for the award of Master of Pharmacy (M. Pharm) degree in Physical Pharmaceutics. The work embodied in this project is original and has not been submitted in part or full for any other diploma or degree of this or any other University. Supervisor: Prof. A. A. Attama Head of Department: Prof. K.C. Oforkansi ………………………………. ………………………………….. Sign/Date Sign/Date iii DEDICATION This work is dedicated to God Almighty for all His mercies and grace; and to my parents for their continued support and love. iv ACKNOWLEDGMENT To God be the glory for all His wonderful works, His goodness, grace and mercies. My immense gratitude goes to my supervisor, Prof. A. A. Attama, one of a kind, for all his support, encouragement and guidance. I sincerely thank him for providing most of the materials and equipment used for this research work. I also, do really thank him for opening my eyes to the opportunities in the field of research. -

MICROPROPAGACIÓN DE Amburana Acreana (ISHPINGO) a PARTIR DE YEMAS APICALES PROVENIENTES DE LA GERMINACIÓN in VITRO DE SEMILLAS”
UNIVERSIDAD NACIONAL AGRARIA LA MOLINA FACULTAD DE CIENCIAS FORESTALES “MICROPROPAGACIÓN DE Amburana acreana (ISHPINGO) A PARTIR DE YEMAS APICALES PROVENIENTES DE LA GERMINACIÓN IN VITRO DE SEMILLAS” TESIS PARA OPTAR EL TÍTULO DE INGENIERA FORESTAL PAOLA LICET MONZÓN NARCISO LIMA-PERÚ 2021 La UNALM es titular de los derechos patrimoniales de la presente tesis (Art. 24 - Reglamento de Propiedad Intelectual) UNIVERSIDAD NACIONAL AGRARIA LA MOLINA FACULTAD DE CIENCIAS FORESTALES “MICROPROPAGACIÓN DE Amburana acreana (ISHPINGO) A PARTIR DE YEMAS APICALES PROVENIENTES DE LA GERMINACIÓN IN VITRO DE SEMILLAS” TESIS PARA OPTAR EL TÍTULO DE INGENIERO FORESTAL PAOLA LICET MONZÓN NARCISO Sustentada y aprobada ante el siguiente jurado: __________________________ Dr. José Eloy Cuellar Bautista Presidente del Jurado ___________________________ ___________________________ Ing. Fernando Bulnes Soriano M.Sc. Lourdes Tapia y Figueroa Miembro del Jurado Miembro del Jurado . ___________________________ ____________________________ Dr. Gilberto Domínguez Torrejón Blga. Rosa María Cabrera Pintado Asesor de Tesis Co asesora DEDICATORIA Agradezco ante todo a Dios por ayudarme en cada momento que lo necesité y permitirme seguir adelante. A mi madre Rosario Narciso por apoyarme incondicionalmente en todas las etapas de mi vida. A mis familiares y amigos por su constante apoyo y cariño. AGRADECIMIENTOS Quiero expresar mis más sinceros agradecimientos A mi asesor el Dr. Gilberto Domínguez y, con un especial cariño, a la Blga. Rosa Cabrera Pintado por apoyarme constantemente durante la ejecución de la investigación. A los miembros del jurado, por las recomendaciones brindadas para el mejoramiento de la investigación. A mis amigos Rocío, Angel, Naty, Liliana, Melissa, Milca y Kiara del Laboratorio de Cultivo de Tejidos Vegetales por su apoyo, ánimos y consejos para el desarrollo de la tesis. -

Check List of Wild Angiosperms of Bhagwan Mahavir (Molem
Check List 9(2): 186–207, 2013 © 2013 Check List and Authors Chec List ISSN 1809-127X (available at www.checklist.org.br) Journal of species lists and distribution Check List of Wild Angiosperms of Bhagwan Mahavir PECIES S OF Mandar Nilkanth Datar 1* and P. Lakshminarasimhan 2 ISTS L (Molem) National Park, Goa, India *1 CorrespondingAgharkar Research author Institute, E-mail: G. [email protected] G. Agarkar Road, Pune - 411 004. Maharashtra, India. 2 Central National Herbarium, Botanical Survey of India, P. O. Botanic Garden, Howrah - 711 103. West Bengal, India. Abstract: Bhagwan Mahavir (Molem) National Park, the only National park in Goa, was evaluated for it’s diversity of Angiosperms. A total number of 721 wild species belonging to 119 families were documented from this protected area of which 126 are endemics. A checklist of these species is provided here. Introduction in the National Park are Laterite and Deccan trap Basalt Protected areas are most important in many ways for (Naik, 1995). Soil in most places of the National Park area conservation of biodiversity. Worldwide there are 102,102 is laterite of high and low level type formed by natural Protected Areas covering 18.8 million km2 metamorphosis and degradation of undulation rocks. network of 660 Protected Areas including 99 National Minerals like bauxite, iron and manganese are obtained Parks, 514 Wildlife Sanctuaries, 43 Conservation. India Reserves has a from these soils. The general climate of the area is tropical and 4 Community Reserves covering a total of 158,373 km2 with high percentage of humidity throughout the year. -

Biogeography and Diversification of Brassicales
Molecular Phylogenetics and Evolution 99 (2016) 204–224 Contents lists available at ScienceDirect Molecular Phylogenetics and Evolution journal homepage: www.elsevier.com/locate/ympev Biogeography and diversification of Brassicales: A 103 million year tale ⇑ Warren M. Cardinal-McTeague a,1, Kenneth J. Sytsma b, Jocelyn C. Hall a, a Department of Biological Sciences, University of Alberta, Edmonton, Alberta T6G 2E9, Canada b Department of Botany, University of Wisconsin, Madison, WI 53706, USA article info abstract Article history: Brassicales is a diverse order perhaps most famous because it houses Brassicaceae and, its premier mem- Received 22 July 2015 ber, Arabidopsis thaliana. This widely distributed and species-rich lineage has been overlooked as a Revised 24 February 2016 promising system to investigate patterns of disjunct distributions and diversification rates. We analyzed Accepted 25 February 2016 plastid and mitochondrial sequence data from five gene regions (>8000 bp) across 151 taxa to: (1) Available online 15 March 2016 produce a chronogram for major lineages in Brassicales, including Brassicaceae and Arabidopsis, based on greater taxon sampling across the order and previously overlooked fossil evidence, (2) examine Keywords: biogeographical ancestral range estimations and disjunct distributions in BioGeoBEARS, and (3) determine Arabidopsis thaliana where shifts in species diversification occur using BAMM. The evolution and radiation of the Brassicales BAMM BEAST began 103 Mya and was linked to a series of inter-continental vicariant, long-distance dispersal, and land BioGeoBEARS bridge migration events. North America appears to be a significant area for early stem lineages in the Brassicaceae order. Shifts to Australia then African are evident at nodes near the core Brassicales, which diverged Cleomaceae 68.5 Mya (HPD = 75.6–62.0). -

Recommendation of Native Species for the Reforestation of Degraded Land Using Live Staking in Antioquia and Caldas’ Departments (Colombia)
UNIVERSITÀ DEGLI STUDI DI PADOVA Department of Land, Environment Agriculture and Forestry Second Cycle Degree (MSc) in Forest Science Recommendation of native species for the reforestation of degraded land using live staking in Antioquia and Caldas’ Departments (Colombia) Supervisor Prof. Lorenzo Marini Co-supervisor Prof. Jaime Polanía Vorenberg Submitted by Alicia Pardo Moy Student N. 1218558 2019/2020 Summary Although Colombia is one of the countries with the greatest biodiversity in the world, it has many degraded areas due to agricultural and mining practices that have been carried out in recent decades. The high Andean forests are especially vulnerable to this type of soil erosion. The corporate purpose of ‘Reforestadora El Guásimo S.A.S.’ is to use wood from its plantations, but it also follows the parameters of the Forest Stewardship Council (FSC). For this reason, it carries out reforestation activities and programs and, very particularly, it is interested in carrying out ecological restoration processes in some critical sites. The study area is located between 2000 and 2750 masl and is considered a low Andean humid forest (bmh-MB). The average annual precipitation rate is 2057 mm and the average temperature is around 11 ºC. The soil has a sandy loam texture with low pH, which limits the amount of nutrients it can absorb. FAO (2014) suggests that around 10 genera are enough for a proper restoration. After a bibliographic revision, the genera chosen were Alchornea, Billia, Ficus, Inga, Meriania, Miconia, Ocotea, Protium, Prunus, Psidium, Symplocos, Tibouchina, and Weinmannia. Two inventories from 2013 and 2019, helped to determine different biodiversity indexes to check the survival of different species and to suggest the adequate characteristics of the individuals for a successful vegetative stakes reforestation.