Dorota Blatsios
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Department of Planning and Zoning
Department of Planning and Zoning Subject: Howard County Landscape Manual Updates: Recommended Street Tree List (Appendix B) and Recommended Plant List (Appendix C) - Effective July 1, 2010 To: DLD Review Staff Homebuilders Committee From: Kent Sheubrooks, Acting Chief Division of Land Development Date: July 1, 2010 Purpose: The purpose of this policy memorandum is to update the Recommended Plant Lists presently contained in the Landscape Manual. The plant lists were created for the first edition of the Manual in 1993 before information was available about invasive qualities of certain recommended plants contained in those lists (Norway Maple, Bradford Pear, etc.). Additionally, diseases and pests have made some other plants undesirable (Ash, Austrian Pine, etc.). The Howard County General Plan 2000 and subsequent environmental and community planning publications such as the Route 1 and Route 40 Manuals and the Green Neighborhood Design Guidelines have promoted the desirability of using native plants in landscape plantings. Therefore, this policy seeks to update the Recommended Plant Lists by identifying invasive plant species and disease or pest ridden plants for their removal and prohibition from further planting in Howard County and to add other available native plants which have desirable characteristics for street tree or general landscape use for inclusion on the Recommended Plant Lists. Please note that a comprehensive review of the street tree and landscape tree lists were conducted for the purpose of this update, however, only -

Central Appalachian Broadleaf Forest Coniferous Forest Meadow Province
Selecting Plants for Pollinators A Regional Guide for Farmers, Land Managers, and Gardeners In the Central Appalachian Broadleaf Forest Coniferous Forest Meadow Province Including the states of: Maryland, Pennsylvania, Virginia, West Virginia And parts of: Georgia, Kentucky, and North Carolina, NAPPC South Carolina, Tennessee Table of CONTENTS Why Support Pollinators? 4 Getting Started 5 Central Appalachian Broadleaf Forest 6 Meet the Pollinators 8 Plant Traits 10 Developing Plantings 12 Far ms 13 Public Lands 14 Home Landscapes 15 Bloom Periods 16 Plants That Attract Pollinators 18 Habitat Hints 20 This is one of several guides for Check list 22 different regions in the United States. We welcome your feedback to assist us in making the future Resources and Feedback 23 guides useful. Please contact us at [email protected] Cover: silver spotted skipper courtesy www.dangphoto.net 2 Selecting Plants for Pollinators Selecting Plants for Pollinators A Regional Guide for Farmers, Land Managers, and Gardeners In the Ecological Region of the Central Appalachian Broadleaf Forest Coniferous Forest Meadow Province Including the states of: Maryland, Pennsylvania, Virginia, West Virginia And parts of: Georgia, Kentucky, North Carolina, South Carolina, Tennessee a nappc and Pollinator Partnership™ Publication This guide was funded by the National Fish and Wildlife Foundation, the C.S. Fund, the Plant Conservation Alliance, the U.S. Forest Service, and the Bureau of Land Management with oversight by the Pollinator Partnership™ (www.pollinator.org), in support of the North American Pollinator Protection Campaign (NAPPC–www.nappc.org). Central Appalachian Broadleaf Forest – Coniferous Forest – Meadow Province 3 Why support pollinators? In theIr 1996 book, the Forgotten PollInators, Buchmann and Nabhan estimated that animal pollinators are needed for the reproduction “ Farming feeds of 90% of flowering plants and one third of human food crops. -

A Taxonomic Revision of Rhododendron L. Section Pentanthera G
A TAXONOMIC REVISION OF RHODODENDRON L. SECTION PENTANTHERA G. DON (ERICACEAE) BY KATHLEEN ANNE KRON A DISSERTATION PRESENTED TO THE GRADUATE SCHOOL OF THE UNIVERSITY OF FLORIDA IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF DOCTOR OF PHILOSOPHY UNIVERSITY OF FLORIDA 1987 , ACKNOWLEDGMENTS I gratefully acknowledge the supervision and encouragement given to me by Dr. Walter S. Judd. I thoroughly enjoyed my work under his direction. I would also like to thank the members of my advisory committee, Dr. Bijan Dehgan, Dr. Dana G. Griffin, III, Dr. James W. Kimbrough, Dr. Jonathon Reiskind, Dr. William Louis Stern, and Dr. Norris H. Williams for their critical comments and suggestions. The National Science Foundation generously supported this project in the form of a Doctoral Dissertation Improvement Grant;* field work in 1985 was supported by a grant from the Highlands Biological Station, Highlands, North Carolina. I thank the curators of the following herbaria for the loan of their material: A, AUA, BHA, DUKE, E, FSU, GA, GH, ISTE, JEPS , KW, KY, LAF, LE NCSC, NCU, NLU NO, OSC, PE, PH, LSU , M, MAK, MOAR, NA, , RSA/POM, SMU, SZ, TENN, TEX, TI, UARK, UC, UNA, USF, VDB, VPI, W, WA, WVA. My appreciation also is offered to the illustrators, Gerald Masters, Elizabeth Hall, Rosa Lee, Lisa Modola, and Virginia Tomat. I thank Dr. R. Howard * BSR-8601236 ii Berg for the scanning electron micrographs. Mr. Bart Schutzman graciously made available his computer program to plot the results of the principal components analyses. The herbarium staff, especially Mr. Kent D. Perkins, was always helpful and their service is greatly appreciated. -

Beekeeping in Turkey: Past to Present
IRFAN KANDEMIR 85 BEEKEEPING IN TURKEY: PAST TO PRESENT Irfan Kandemir Department of Biology, Faculty of Science, Ankara University, Turkey [email protected] Abstract Turkey is on the intersection of three continents and also located on two important trade routes of the past, namely the Spice and Silk Roads. Thus it played a very important role bridging Asia, Europe and Africa. Indeed Turkey was also the place where very important civilizations such as the Roman, Hittite, Byzantine, Ottoman and finally the modern Turkish Republic became established. Covering all of these civilizations beekeeping can be divided into three main periods, supported by archeological findings, the written laws of Ottomans and the present period of the new Republic. Although the findings in archeology and in the Ottoman period are scarce, the present period has Fig. 1 Two tablets found in Boğazköy (Hattuşaş) related to lots of information regarding beekeeping in Turkey. beekeeping laws (Sarıöz, 2006; Akkaya and Alkan, 2007). Archeological evidence of the Hittite Period main part, called Anatolian, is in Asia and the much comes from excavations in two sites in Turkey. Comb, smaller part is Thrace, the European part of Turkey. figures on the walls and the buzzing bees on the The whole country covers a total of approximately carpets are the signs of beekeeping in that area. 800,000 km2. In this vast geographical area different topographical and climatological features, shaped by In the Ottoman period, although there is not evolution, make for a wide variety of flora and fauna. much direct evidence of beekeeping, there are Over 10,000 plant species create huge biodiversity several laws attributable to beekeeping. -

Managing and Controlling Invasive Rhododendron
Practice Guide Managing and controlling invasive rhododendron Colin Edwards Forestry Commission: Edinburgh © Crown Copyright 2006 Applications for reproduction of any part of this publication should be addressed to: HMSO, Licensing Division, St Clements House, 2–16 Colegate, Norwich NR3 1BQ. First published in 2006 by the Forestry Commission 231 Corstorphine Road, Edinburgh EH12 7AT. ISBN 0 85538 704 1 EDWARDS, C. (2006). Managing and controlling invasive rhododendron. Forestry Commission Practice Guide. Forestry Commission, Edinburgh. i–iv + 1–36 pp. Keywords: herbicides, invasive rhododendron, rhododendron control, Rhododendron ponticum. Printed in the United Kingdom on Robert Horne Hello Matt FCPG017/FC-GB(ECD)/IA-2K/SEP06 Enquiries relating to this publication should be addressed to: Forestry Commission 231 Corstorphine Road Edinburgh EH12 7AT T: 0131 334 0303 F: 0131 316 4344 E: [email protected] The author may be contacted at: Forest Research Northern Research Station Roslin Midlothian EH25 9SY T: 0131 445 2176 F: 0131 445 5124 E: [email protected] Acknowledgements The field experiments using herbicides were managed by the Technical Support Unit of Forest Research, especially D. Tracy. Bush growth and dispersal experiments were organised by D. Kohn, J. Travis, C. Stephenson and R. Atkinson. Disclaimer The list of products referred to in the tables of this Practice Guide is not comprehensive; other manufacturers may be able to provide products with equivalent characteristics. Reference to a particular -

Rediscovering Rhododendron Dell, Part 2
Rediscovering Rhododendron Dell, Part 2 Kyle Port “They [hoodlums] deliberately twist off the metal labels from trees and shrubs, so that valuable information is sometimes lost forever and the yearly replacement bill is terrific. They break hundreds of unopened flower buds off the Rhododendrons in the early spring.” —Edgar Anderson, Arnold Arboretum arborist , June 4, 1932 ated C DI N I E S erwi H T SS O E UNL R HO T U A E H T Y B S E G A M I ALL Planted in close proximity to one another, Rhododendron ‘Old Port’ 990-56-B (a catawbiense hybrid with “vinous crimson” flowers, seen here) was incorrectly labeled as R. ‘Red Head’ 329-91-A (with “orient red” flowers). A description published by the Royal Horticultural Society was used to verify the only remaining plant as ‘Old Port’; a lack of indumentum on the undersides of the leaves distinguishes it from ‘Red Head’. he Arboretum’s plant records attest to curatorial review that has advanced our under- episodes of vandalism, arson, theft, and standing of the rhododendron collection and Tother willful shenanigans that have further fostered its use. occurred in the living collections over the years. In response to the identity crises in Rhodo- In 2010, a pile of plant record labels was found dendron Dell, a multi-year collection review in Rhododendron Dell. This intentional—and was conceived. Identity verification and field completely unsanctioned—removal of labels work (e.g., labeling, photographing) was timed from numerous specimens by an anonymous to coincide with peak flowering. -

Structural Adaptations in Overwintering Leaves of Thermonastic and Nonthermonastic Rhododendron Species Xiang Wang Iowa State University
Genetics, Development and Cell Biology Genetics, Development and Cell Biology Publications 11-2008 Structural Adaptations in Overwintering Leaves of Thermonastic and Nonthermonastic Rhododendron Species Xiang Wang Iowa State University Rajeev Arora Iowa State University, [email protected] Harry T. Horner Iowa State University, [email protected] Stephen L. Krebs David G. Leach Station of the Holden Arboretum Follow this and additional works at: http://lib.dr.iastate.edu/gdcb_las_pubs Part of the Horticulture Commons, Other Plant Sciences Commons, Plant Biology Commons, and the Plant Breeding and Genetics Commons The ompc lete bibliographic information for this item can be found at http://lib.dr.iastate.edu/ gdcb_las_pubs/47. For information on how to cite this item, please visit http://lib.dr.iastate.edu/ howtocite.html. This Article is brought to you for free and open access by the Genetics, Development and Cell Biology at Iowa State University Digital Repository. It has been accepted for inclusion in Genetics, Development and Cell Biology Publications by an authorized administrator of Iowa State University Digital Repository. For more information, please contact [email protected]. Structural Adaptations in Overwintering Leaves of Thermonastic and Nonthermonastic Rhododendron Species Abstract Evergreen rhododendrons (Rhododendron L.) are important woody landscape plants in many temperate zones. During winters, leaves of these plants frequently are exposed to a combination of cold temperatures, high radiation, and reduced photosynthetic activity, conditions that render them vulnerable to photooxidative damage. In addition, these plants are shallow-rooted and thus susceptible to leaf desiccation when soils are frozen. In this study, the potential adaptive significance of leaf morphology and anatomy in two contrasting Rhododendron species was investigated. -

A Dunedin Garden
VIREYA VINE ISSUE #82, OCTOBER 2007 PUBLISHED BY THE EDUCATION COMMITTEE OF THE RHODODENDRON SPECIES FOUNDATION R.S.F. PO BOX 3798, FEDERAL WAY, WA. 98063 E. White Smith, Editor From Daphne and Gavin Clark Dunedin, New Zealand Published with permission from the Dunedin Bulletin Feb. 2007 RHODODENDRON lowii (Subsection Vireya) More information about R. lowii relting to the piece in VV81 Addendum – February 2007 Following on from the previous article the long cane produced four shoots. Two were given to a very keen propagator to strike and we tried to strike two, but they all failed. However a good quantity of seed was collected at the end of January, 2005 and again this was shared. Our seed was kept in cool storage and eventually sown in September 2005. A small transparent plastic container with a clear lid was used with the seed sprinkled on to damp, sterilized sphagnum moss. The seeds germinated very well and some of the seedlings were transferred into compost but despite tender care died. The remaining seedlings stayed in the plastic container for some considerable time until recently when they were very carefully removed to individual peat pots into a specially mixed compost. Nine pots are housed in a clear, plastic lidded container 340mm x 300mm which stands on a wide kitchen windowsill with excellent light but no direct sunlight and hopefully some of these will survive. In the meantime the parent plant is flourishing, the two basal shoots are now 800mm high with the original cane cut down to 750mm. It is still in its container and now occupies a choice place among other vireya species in a wooded area beneath 50 year old camellias and rhododendrons which have been pruned to provide an excellent canopy, with morning sun, filtered afternoon sunlight, together with a degree of humidity. -

Host Range of a Select Isolate of the Eri Coid Mycorrhizal Fungus
PROPAGATION & TISSUE CULTURE HORTSCIENCE 38(6):1163–1166. 2003. Berta and Bonfante-Fasolo, 1983; Bradley et al., 1981; Leake and Read, 1989). Other studies have attempted to evaluate the host Host Range of a Select Isolate of range of ericoid fungi, but have inoculated with unidentified ericoid fungal isolates, described, the Eri coid Mycorrhizal Fungus for example as, “dark, slow-growing cultures” (Pearson and Read, 1973b; Reed, 1987). Hymenoscyphus ericae To date there have been no studies that investigate the host range of a select isolate Nicole R. Gorman1 and Mark C. Starrett2 of the ericoid endophyte H. ericae. Therefore, Department of Plant and Soil Science, University of Vermont, Burlington, the objective of this study was to evaluate the VT 05405-0082 host range using select species within the Eri- caceae by inoculating with a specific iso late Additional index words. Ericaceae, Calluna, Enkianthus, Gaultheria, Kalmia, Leucothoe, of H. ericae. Oxydendrum, Pieris, Rhodo den dron, Vaccinium Materials and Methods Abstract. Studies were conducted to ex am ine the host range of a select isolate of the ericoid mycorrhizal fungus Hymenoscyphus ericae (Read) Korf and Kernan [American Type Seed of 15 ericaceous species was ob tained Culture Collection (ATCC) #32985]. Host status was tested for 15 ericaceous species, in- from commercial seed suppliers [Sheffield·s cluding: Calluna vulgaris (L.) Hull, Enkianthus campanulatus (Miq.) Nichols, Gaultheria Seed Co. (Lock, N.Y.) and F.W. Schumacher procumbens L., Kalmia latifolia L., Leucothoe fontanesiana Sleum., Oxydendrum arbo- Co. (Sandwich, Mass.)]. Seed was cleaned and reum (L.) DC., Pieris flo ri bun da (Pursh) Benth. -

Flora of the Carolinas, Virginia, and Georgia, Working Draft of 17 March 2004 -- BIBLIOGRAPHY
Flora of the Carolinas, Virginia, and Georgia, Working Draft of 17 March 2004 -- BIBLIOGRAPHY BIBLIOGRAPHY Ackerfield, J., and J. Wen. 2002. A morphometric analysis of Hedera L. (the ivy genus, Araliaceae) and its taxonomic implications. Adansonia 24: 197-212. Adams, P. 1961. Observations on the Sagittaria subulata complex. Rhodora 63: 247-265. Adams, R.M. II, and W.J. Dress. 1982. Nodding Lilium species of eastern North America (Liliaceae). Baileya 21: 165-188. Adams, R.P. 1986. Geographic variation in Juniperus silicicola and J. virginiana of the Southeastern United States: multivariant analyses of morphology and terpenoids. Taxon 35: 31-75. ------. 1995. Revisionary study of Caribbean species of Juniperus (Cupressaceae). Phytologia 78: 134-150. ------, and T. Demeke. 1993. Systematic relationships in Juniperus based on random amplified polymorphic DNAs (RAPDs). Taxon 42: 553-571. Adams, W.P. 1957. A revision of the genus Ascyrum (Hypericaceae). Rhodora 59: 73-95. ------. 1962. Studies in the Guttiferae. I. A synopsis of Hypericum section Myriandra. Contr. Gray Herbarium Harv. 182: 1-51. ------, and N.K.B. Robson. 1961. A re-evaluation of the generic status of Ascyrum and Crookea (Guttiferae). Rhodora 63: 10-16. Adams, W.P. 1973. Clusiaceae of the southeastern United States. J. Elisha Mitchell Sci. Soc. 89: 62-71. Adler, L. 1999. Polygonum perfoliatum (mile-a-minute weed). Chinquapin 7: 4. Aedo, C., J.J. Aldasoro, and C. Navarro. 1998. Taxonomic revision of Geranium sections Batrachioidea and Divaricata (Geraniaceae). Ann. Missouri Bot. Gard. 85: 594-630. Affolter, J.M. 1985. A monograph of the genus Lilaeopsis (Umbelliferae). Systematic Bot. Monographs 6. Ahles, H.E., and A.E. -

Introduction to the Southern Blue Ridge Ecoregional Conservation Plan
SOUTHERN BLUE RIDGE ECOREGIONAL CONSERVATION PLAN Summary and Implementation Document March 2000 THE NATURE CONSERVANCY and the SOUTHERN APPALACHIAN FOREST COALITION Southern Blue Ridge Ecoregional Conservation Plan Summary and Implementation Document Citation: The Nature Conservancy and Southern Appalachian Forest Coalition. 2000. Southern Blue Ridge Ecoregional Conservation Plan: Summary and Implementation Document. The Nature Conservancy: Durham, North Carolina. This document was produced in partnership by the following three conservation organizations: The Nature Conservancy is a nonprofit conservation organization with the mission to preserve plants, animals and natural communities that represent the diversity of life on Earth by protecting the lands and waters they need to survive. The Southern Appalachian Forest Coalition is a nonprofit organization that works to preserve, protect, and pass on the irreplaceable heritage of the region’s National Forests and mountain landscapes. The Association for Biodiversity Information is an organization dedicated to providing information for protecting the diversity of life on Earth. ABI is an independent nonprofit organization created in collaboration with the Network of Natural Heritage Programs and Conservation Data Centers and The Nature Conservancy, and is a leading source of reliable information on species and ecosystems for use in conservation and land use planning. Photocredits: Robert D. Sutter, The Nature Conservancy EXECUTIVE SUMMARY This first iteration of an ecoregional plan for the Southern Blue Ridge is a compendium of hypotheses on how to conserve species nearest extinction, rare and common natural communities and the rich and diverse biodiversity in the ecoregion. The plan identifies a portfolio of sites that is a vision for conservation action, enabling practitioners to set priorities among sites and develop site-specific and multi-site conservation strategies. -
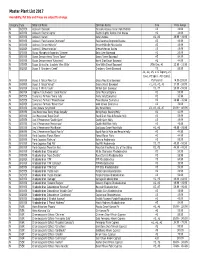
Master Plant List 2017.Xlsx
Master Plant List 2017 Availability, Pot Size and Prices are subject to change. Category Type Botanical Name Common Name Size Price Range N BREVER Azalea X 'Cascade' Cascade Azalea (Glenn Dale Hybrid) #3 49.99 N BREVER Azalea X 'Electric Lights' Electric Lights Double Pink Azalea #2 44.99 N BREVER Azalea X 'Karen' Karen Azalea #2, #3 39.99 - 49.99 N BREVER Azalea X 'Poukhanense Improved' Poukhanense Improved Azalea #3 49.99 N BREVER Azalea X 'Renee Michelle' Renee Michelle Pink Azalea #3 49.99 N BREVER Azalea X 'Stewartstonian' Stewartstonian Azalea #3 49.99 N BREVER Buxus Microphylla Japonica "Gregem' Baby Gem Boxwood #2 29.99 N BREVER Buxus Sempervirens 'Green Tower' Green Tower Boxwood #5 64.99 N BREVER Buxus Sempervirens 'Katerberg' North Star Dwarf Boxwood #2 44.99 N BREVER Buxus Sinica Var. Insularis 'Wee Willie' Wee Willie Dwarf Boxwood Little One, #1 13.99 - 21.99 N BREVER Buxus X 'Cranberry Creek' Cranberry Creek Boxwood #3 89.99 #1, #2, #5, #15 Topiary, #5 Cone, #5 Spiral, #10 Spiral, N BREVER Buxus X 'Green Mountain' Green Mountain Boxwood #5 Pyramid 14.99-299.99 N BREVER Buxus X 'Green Velvet' Green Velvet Boxwood #1, #2, #3, #5 17.99 - 59.99 N BREVER Buxus X 'Winter Gem' Winter Gem Boxwood #5, #7 59.99 - 99.99 N BREVER Daphne X Burkwoodii 'Carol Mackie' Carol Mackie Daphne #2 59.99 N BREVER Euonymus Fortunei 'Ivory Jade' Ivory Jade Euonymus #2 35.99 N BREVER Euonymus Fortunei 'Moonshadow' Moonshadow Euonymus #2 29.99 - 35.99 N BREVER Euonymus Fortunei 'Rosemrtwo' Gold Splash Euonymus #2 39.99 N BREVER Ilex Crenata 'Sky Pencil'