Acanthamoeba Keratitis. a Review Ectasia Post Cirugía
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

History of Refractive Surgery
History of Refractive Surgery Refractive surgery corrects common vision problems by reshaping the cornea, the eye’s outermost layer, to bend light rays to focus on the retina, reducing an individual’s dependence on eye glasses or contact lenses.1 LASIK, or laser-assisted in situ keratomileusis, is the most commonly performed refractive surgery to treat myopia, hyperopia and astigmatism.1 The first refractive surgeries were said to be the removal of cataracts – the clouding of the lens in the eye – in ancient Greece.2 1850s The first lensectomy is performed to remove the lens 1996 Clinical trials for LASIK begin and are approved by the of the eye to correct myopia.2 Food & Drug Administration (FDA).3 Late 19th 2 Abott Medical Optics receives FDA approval for the first Century The first surgery to correct astigmatism takes place. 2001 femtosecond laser, the IntraLase® FS Laser.3 The laser is used to create a circular, hinged flap in the cornea, which allows the surgeon access to the tissue affecting the eye’s 1978 Radial Keratotomy is introduced by Svyatoslov Fyodorov shape.1 in the U.S. The procedure involves making a number of incisions in the cornea to change its shape and 2002 The STAR S4 IR® Laser is introduced. The X generation is correct refractive errors, such as myopia, hyperopia used in LASIK procedures today.4 and astigmatism.2,3 1970s Samuel Blum, Rangaswamy Srinivasan and James J. Wynne 2003 The FDA approves the use of wavefront technology,3 invent the excimer laser at the IBM Thomas J. Watson which creates a 3-D map of the eye to measure 1980s Research Center in Yorktown, New York. -
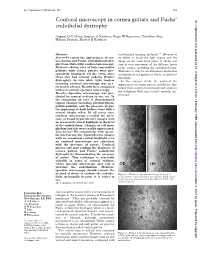
Confocal Microscopy in Cornea Guttata and Fuchs' Endothelial Dystrophy
Br J Ophthalmol 1999;83:185–189 185 Confocal microscopy in cornea guttata and Fuchs’ Br J Ophthalmol: first published as 10.1136/bjo.83.2.185 on 1 February 1999. Downloaded from endothelial dystrophy Auguste G-Y Chiou, Stephen C Kaufman, Roger W Beuerman, Toshihiko Ohta, Hisham Soliman, Herbert E Kaufman Abstract conventional imaging methods.3–13 Because of Aims—To report the appearances of cor- its ability to focus the light source and the nea guttata and Fuchs’ endothelial dystro- image on the same focal plane, it allows real phy from white light confocal microscopy. time in vivo assessment of the diVerent layers Methods—Seven eyes of four consecutive of the cornea, including the endothelial layer. patients with cornea guttata were pro- Therefore, it may be an alternative method in spectively examined. Of the seven eyes, evaluating cornea guttata or Fuchs’ endothelial three also had corneal oedema (Fuchs’ dystrophy. dystrophy). In vivo white light tandem In the current study, we analysed the scanning confocal microscopy was per- appearances of cornea guttata and Fuchs’ dys- formed in all eyes. Results were compared trophy from confocal microscopy and compare with non-contact specular microscopy. the technique with non-contact specular mi- Results—Specular microscopy was pre- croscopy. cluded by corneal oedema in one eye. In the remaining six eyes, it demonstrated typical changes including pleomorphism, polymegathism, and the presence of gut- tae appearing as dark bodies, some with a central bright reflex. In all seven eyes, confocal microscopy revealed the pres- ence of round hyporeflective images with an occasional central highlight at the level of the endothelium. -

Perioperative Assessment for Refractive Cataract Surgery
642 REVIEW/UPDATE Perioperative assessment for refractive cataract surgery Kendall Donaldson, MD, MS, Luis Fernandez-Vega-Cueto, MD, PhD, Richard Davidson, MD, Deepinder Dhaliwal, MD, Rex Hamilton, MD, Mitchell Jackson, MD, Larry Patterson, MD, Karl Stonecipher, MD, for the ASCRS Refractive–Cataract Surgery Subcommittee As cataract surgery has evolved into lens-based refractive surgery, decisions regarding the power of the IOL to be implanted during cata- expectations for refractive outcomes continue to increase. During ract surgery. However, with all the available technology, it can be diffi- the past decade, advancements in technology have provided new cult to decipher which of the many technologies is necessary or best ways to measure the cornea in preparation for cataract surgery. for patients and for practices. This article reviews currently available The increasing ability to accurately estimate corneal power allows options for topography, tomography, keratometry, and biometry in determination of the most precise intraocular lens (IOL) for each pa- preparation for cataract surgery. In addition, intraoperative aberrom- tient. New equipment measures the anterior and posterior corneal etry and integrated cataract suites are reviewed. surfaces to most accurately estimate corneal power and corneal ab- errations. These measurements help surgeons make the best J Cataract Refract Surg 2018; 44:642–653 Q 2018 ASCRS and ESCRS ver the past 2 decades, we have experienced an only the anterior corneal surface with the use of topo- evolution in cataract surgery from simply the graphic devices; however with discovery of the impact of O removal of the cloudy lens to a refractive proced- posterior corneal astigmatism, we can now achieve higher ure that provides patients with increasingly higher levels degrees of accuracy by taking into account the effect of the of spectacle independence. -
Differentiate Red Eye Disorders
Introduction DIFFERENTIATE RED EYE DISORDERS • Needs immediate treatment • Needs treatment within a few days • Does not require treatment Introduction SUBJECTIVE EYE COMPLAINTS • Decreased vision • Pain • Redness Characterize the complaint through history and exam. Introduction TYPES OF RED EYE DISORDERS • Mechanical trauma • Chemical trauma • Inflammation/infection Introduction ETIOLOGIES OF RED EYE 1. Chemical injury 2. Angle-closure glaucoma 3. Ocular foreign body 4. Corneal abrasion 5. Uveitis 6. Conjunctivitis 7. Ocular surface disease 8. Subconjunctival hemorrhage Evaluation RED EYE: POSSIBLE CAUSES • Trauma • Chemicals • Infection • Allergy • Systemic conditions Evaluation RED EYE: CAUSE AND EFFECT Symptom Cause Itching Allergy Burning Lid disorders, dry eye Foreign body sensation Foreign body, corneal abrasion Localized lid tenderness Hordeolum, chalazion Evaluation RED EYE: CAUSE AND EFFECT (Continued) Symptom Cause Deep, intense pain Corneal abrasions, scleritis, iritis, acute glaucoma, sinusitis, etc. Photophobia Corneal abrasions, iritis, acute glaucoma Halo vision Corneal edema (acute glaucoma, uveitis) Evaluation Equipment needed to evaluate red eye Evaluation Refer red eye with vision loss to ophthalmologist for evaluation Evaluation RED EYE DISORDERS: AN ANATOMIC APPROACH • Face • Adnexa – Orbital area – Lids – Ocular movements • Globe – Conjunctiva, sclera – Anterior chamber (using slit lamp if possible) – Intraocular pressure Disorders of the Ocular Adnexa Disorders of the Ocular Adnexa Hordeolum Disorders of the Ocular -

Effects of Depth of Incision on Final Outcome in Radial Keratotomy N
Effects of Depth of Incision on final outcome in Radial Keratotomy N. Raja, M. K. Niazi B-35, PAF Complex, Sector E-9, Islamabad. Abstract Objective: To assess the effect of depth of incision on the final outcome of radial keratotomy for correction of myopia. Methods: Sixty-five eyes with preoperative uncorrected myopia between 2.5-6.0D in subjects with a mean age of 29.2 (+7) years underwent radial keratotomy between Sept 1999--July 2002 in department of Ophthalmology, Military Hospital, Rawalpindi. Based on their preoperative depth of incision the eyes were divided into group-A (twenty-five eyes), with an incision depth of 500-530 µm, and Group-B (forty eyes), with an incision depth of 531- 560 µm. The comparison between the postoperative visual acuity of two groups was made at the end of study after one years` follow up. Results: A total of Sixteen eyes in Group-A (64%) that were within one diopter of emmetropia at first follow-up reverted back to their preoperative myopic state after one year of surgery as compared to only two eyes (5%) in Group-B (p<0.05). Hyperopic shift occurred in two eyes (8%) in Group-A, as compared to four eyes (10%) of Group-B (p >0.05). After one year, refraction showed that only 24% cases of Group-A were within 1 diopter of emmetropia as compared to 85% cases in Group-B. Similarly, 40% cases of Group-A were within 2 diopters of emmetropia as compared to 90% cases of Group-B. Glare and variation of vision in the initial four weeks were the most frequently reported complications in both groups. -

Onchocerciasis
11 ONCHOCERCIASIS ADRIAN HOPKINS AND BOAKYE A. BOATIN 11.1 INTRODUCTION the infection is actually much reduced and elimination of transmission in some areas has been achieved. Differences Onchocerciasis (or river blindness) is a parasitic disease in the vectors in different regions of Africa, and differences in cause by the filarial worm, Onchocerca volvulus. Man is the the parasite between its savannah and forest forms led to only known animal reservoir. The vector is a small black fly different presentations of the disease in different areas. of the Simulium species. The black fly breeds in well- It is probable that the disease in the Americas was brought oxygenated water and is therefore mostly associated with across from Africa by infected people during the slave trade rivers where there is fast-flowing water, broken up by catar- and found different Simulium flies, but ones still able to acts or vegetation. All populations are exposed if they live transmit the disease (3). Around 500,000 people were at risk near the breeding sites and the clinical signs of the disease in the Americas in 13 different foci, although the disease has are related to the amount of exposure and the length of time recently been eliminated from some of these foci, and there is the population is exposed. In areas of high prevalence first an ambitious target of eliminating the transmission of the signs are in the skin, with chronic itching leading to infection disease in the Americas by 2012. and chronic skin changes. Blindness begins slowly with Host factors may also play a major role in the severe skin increasingly impaired vision often leading to total loss of form of the disease called Sowda, which is found mostly in vision in young adults, in their early thirties, when they northern Sudan and in Yemen. -

Managing a Patient with Post-Radial Keratotomy and Sjogren's Syndrome with Scleral Contact Lenses
Managing a patient with Post-Radial Keratotomy and Sjogren's Syndrome with Scleral Contact Lenses Case Report 1 Candidate #123 Abstract: Surgeons used radial keratotomy (RK) in the past as an attempt to flatten the corneal shape and reduce refractive myopia in a patient. In the present day, many post-RK patients suffer from poor, fluctuating vision due to an irregular corneal shape induced from this procedure. Rigid gas permeable lenses, such as scleral lenses, are an excellent solution to improve and stabilize vision. Scleral lenses help recreate an optimal refractive surface to enhance vision for the patient. Patients with specific dry eye symptoms can receive a therapeutic benefit from scleral lens use as the lens acts as a protective barrier for corneal hydration. This is a case report on a patient suffering from both ocular and systemic conditions resulting in decreased vision and discomfort from severe dry eye. She has been successfully fit with scleral lenses to improve signs and symptoms. Key Words: Radial keratotomy (RK), dry eye, Sjogren's syndrome, scleral lens 2300 East Campbell Avenue, Unit 316 Phoenix, AZ 85016 [email protected] (480) 815-4135 1 Introduction: Patients may present to their eye care provider with multiple conditions impacting 2 both their ocular and systemic health. Ocular comorbidities frequently lead to visual impairment 3 and decreased quality of life. To suitably manage these coinciding ailments, it is essential to 4 obtain an early and proper diagnosis. [1] In some instances, similar approaches can help alleviate 5 patient symptoms in managing these comorbidities. 6 7 The goal of refractive surgery is to eliminate the dependency on glasses and contact lenses. -

Radial Keratotomy: a Review of 300 Cases Br J Ophthalmol: First Published As 10.1136/Bjo.76.10.586 on 1 October 1992
586 British JournalofOphthalmology 1992; 76: 586-589 Radial keratotomy: a review of 300 cases Br J Ophthalmol: first published as 10.1136/bjo.76.10.586 on 1 October 1992. Downloaded from A K Bates, S J Morgan, A D McG Steele Abstract were utilised depending on degree of myopia. Three hundred consecutive cases of radial Finally the incisions were carefully irrigated with keratotomy performed between 1985 and 1990 sterile saline, topical antibiotics were instilled, were reviewed. There were no sight and the eye was padded. threatening complications of surgery and no Postoperatively all patients received patient lost one or more lines of corrected prednisolone sodium drops 0 3% and chloram- Snelien acuity. Overall 78*7% saw 6/12 or phenicol drops four times daily for 4 weeks. better unaided postoperatively and 51*7% saw Patients were routinely reviewed at 2 and 6 6/6 or better. Refraction showed 61*3% to be weeks after surgery and then at 3, 6, 12, and 18 within 1 dioptre ofemmetropia and 86*7% were months. within 2 dioptres. Further analysis demon- strated that results of unaided acuity and proximity to emmetropia were much better for Results low (<-2.87 D) and moderate (-3.0 to -5*87 Three hundred procedures were performed on D) than for high (>-6-0 D) myopes. 169 patients ofwhom 100 were male. All were 21 (BrJ Ophthalmol 1992; 76: 586-589) years of age or older. The age of the patients at surgery is shown in Figure 1 and it may be seen that the majority fall within the 21-30 years age Currently myopia is being treated by radial group. -

Fusarium Keratitis and Corneal Collagen Cross
FUSARIUM KERATITIS AND SURGERY REFRACTIVE CORNEAL COLLAGEN CROSS-LINKING BY MINAS CORONEO, AO, BSC(MED), MBBS, MSC SYD, MD, MS, UNSW, FRACS, FRANZCO; RAJESH FOGLA, DNB, FRCS(EDIN), MMED(OPHTH); WILLIAM B. TRATTLER, MD; ASHIYANA NARIANI, MD, MPH; COMPLEX CASE MANAGEMENT COMPLEX GARGI KHARE VORA, MD; AND ALAN N. CARLSON, MD CASE PRESENTATION A 42-year-old white man is referred to the Duke University Eye Center Cornea Service for a central corneal ulcer with a hypopyon in his right eye. The patient sustained the ocular injury while mowing the lawn, with debris getting into the eye while he was wearing contact lenses. He was diagnosed with culture-positive Fusarium species by the referring ophthalmologist and was treat- ed with oral voriconazole 200 mg twice daily and frequent topical natamycin 5% and voriconazole 10 mg/mL. The patient under- went epithelium-off corneal collagen cross-linking (CXL) approxi- Figure 1. Initial evaluation of the eye with a Fusarium corneal mately 4 weeks after diagnosis of the ulcer and was treated with infiltrate and hypopyon. a loteprednol steroid taper after the procedure. His condition subsequently progressed, with increasing eye pain, a nonhealing epithelial defect, and a worsening corneal infiltrate. Upon evaluation, the patient has a large corneal infiltrate with necrotic stroma, which is approaching the limbus, and a hypopyon (Figure 1). His UCVA measures 20/70-1. B-scan ultrasound of the right eye shows no evidence of posterior segment involvement. Reculturing of the corneal infiltrate is negative for bacteria, fungus, and Acanthamoeba. Confocal microscopy reveals no evidence of hyphae or cysts. -

Immune Defense at the Ocular Surface
Eye (2003) 17, 949–956 & 2003 Nature Publishing Group All rights reserved 0950-222X/03 $25.00 www.nature.com/eye Immune defense at EK Akpek and JD Gottsch CAMBRIDGE OPHTHALMOLOGICAL SYMPOSIUM the ocular surface Abstract vertebrates. Improved visual acuity would have increased the fitness of these animals and would The ocular surface is constantly exposed to a have outweighed the disadvantage of having wide array of microorganisms. The ability of local immune cells and blood vessels at a the outer ocular system to recognize pathogens distance where a time delay in addressing a as foreign and eliminate them is critical to central corneal infection could lead to blindness. retain corneal transparency, hence The first vertebrates were jawless fish that preservation of sight. Therefore, a were believed to have evolved some 470 million combination of mechanical, anatomical, and years ago.1 These creatures had frontal eyes and immunological defense mechanisms has inhabited the shorelines of ancient oceans. With evolved to protect the outer eye. These host better vision, these creatures were likely more defense mechanisms are classified as either a active and predatory. This advantage along with native, nonspecific defense or a specifically the later development of jaws enabled bony fish acquired immunological defense requiring to flourish and establish other habitats. One previous exposure to an antigen and the such habitat was shallow waters where lunged development of specific immunity. Sight- fish made the transition to land several hundred threatening immunopathology with thousand years later.2 To become established in autologous cell damage also can take place this terrestrial environment, the new vertebrates after these reactions. -

Treatment of Interface Keratitis with Oral Corticosteroids
Treatment of interface keratitis with oral corticosteroids Scott M. MacRae, MD, Larry F. Rich, MD, Damien C. Macaluso, MD ABSTRACT Purpose: To describe the results of treating interface keratitis using a combination of intensive topical and oral corticosteroids. Setting: Casey Eye Institute, Portland, Oregon, USA. Methods: Thirteen eyes treated for grade 2 to 3 interface keratitis using an oral cortico- steroid (prednisone 60 to 80 mg) as well as an hourly topical corticosteroid were retrospectively reviewed. The best corrected visual acuity (BCVA) was used as an objective guide of whether to treat with intense topical and oral corticosteroids, flap irrigation, or both. Predisposing factors such as intraoperative epithelial defects or a history of severe allergies or atopy were also looked for. Results: All 13 eyes responded favorably to the combination of intensive topical and oral corticosteroids and had a BCVA of 20/20 after the keratitis resolved. In 6 eyes (46%), the patients had a history of severe seasonal allergies. One day postoperatively, 3 eyes (23%) had an epithelial defect and 2 eyes (15%), lint particles or debris embedded in the interface. With oral corticosteroid use, 3 patients (23%) noted mild stomach irritation and 2 (15%) noted nervousness. All 5 side effects resolved without sequelae. No patient developed a serious side effect. Conclusion: A short, intense course of an oral corticosteroid was an effective treatment in patients with grade 2 or higher interface keratitis when combined with a topical corti- costeroid administered hourly. The BCVA is a helpful objective measure of the severity of interface keratitis and can be used to guide the clinician in the therapeutic strategy. -

Anterior Segment Surgery and Complications CATARACT EXTRACTION and INTRAOCULAR LENS IMPLANTATION
10 Anterior Segment Surgery and Complications CATARACT EXTRACTION AND INTRAOCULAR LENS IMPLANTATION Complications PENETRATING KERATOPLASTY Complications Correction of Astigmatism in a Corneal Graft LAMELLAR KERATOPLASTY SUPERFICIAL KERATECTOMY EXCIMER LASER PHOTOTHERAPEUTIC KERATECTOMY CONJUNCTIVAL FLAP LIMBAL STEM CELL TRANSPLANTATION PTERYGIUM EXCISION AND CONJUNCTIVAL AUTOGRAFT CONJUNCTIVAL AND CORNEAL TUMOR EXCISION CORNEAL PERFORATION SURGERY PERMANENT KERATOPROSTHESIS REFRACTIVE SURGERY Radial Keratotomy Excimer Laser Photorefractive Keratectomy Laser In Situ Keratomileusis CONCLUSION Anterior segment surgery ranges from routine cataract extraction and lens implantation, one of the most common surgical operations in the United States, to rarely performed surgery such as permanent keratoprosthesis. It also encompasses surgery first performed centuries ago, such as rudimentary pterygium excision, to the latest in keratorefractive surgery. CATARACT EXTRACTION AND INTRAOCULAR LENS IMPLANTATION The many reasons for the development of cataracts are discussed in detail in Chapter 8. Most cataracts are acquired, but they can also be congenital. This section focuses primarily on the treatment of acquired cataracts in adults. Cataracts in adults are generally age related, but some lens opacities may result from other causes such as trauma, inflammation, systemic illness such as diabetes, or medications such as corticosteroids. Cataracts generally advance slowly over years but can advance rapidly over months, or even faster in some patients. The primary indication for cataract extraction is diminished vision caused by the cataract, significantly affecting the patient's lifestyle. The exact point at which this hardship occurs depends on the patient. Certain patients require little visual function and may delay cataract surgery for years or indefinitely. Other patients with high visual needs seek cataract surgery with much smaller degrees of visual loss.