Isopoda: Asellota: Aselloidea, Gnathostenetroidoidea, Stenetrioidea
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

The 17Th International Colloquium on Amphipoda
Biodiversity Journal, 2017, 8 (2): 391–394 MONOGRAPH The 17th International Colloquium on Amphipoda Sabrina Lo Brutto1,2,*, Eugenia Schimmenti1 & Davide Iaciofano1 1Dept. STEBICEF, Section of Animal Biology, via Archirafi 18, Palermo, University of Palermo, Italy 2Museum of Zoology “Doderlein”, SIMUA, via Archirafi 16, University of Palermo, Italy *Corresponding author, email: [email protected] th th ABSTRACT The 17 International Colloquium on Amphipoda (17 ICA) has been organized by the University of Palermo (Sicily, Italy), and took place in Trapani, 4-7 September 2017. All the contributions have been published in the present monograph and include a wide range of topics. KEY WORDS International Colloquium on Amphipoda; ICA; Amphipoda. Received 30.04.2017; accepted 31.05.2017; printed 30.06.2017 Proceedings of the 17th International Colloquium on Amphipoda (17th ICA), September 4th-7th 2017, Trapani (Italy) The first International Colloquium on Amphi- Poland, Turkey, Norway, Brazil and Canada within poda was held in Verona in 1969, as a simple meet- the Scientific Committee: ing of specialists interested in the Systematics of Sabrina Lo Brutto (Coordinator) - University of Gammarus and Niphargus. Palermo, Italy Now, after 48 years, the Colloquium reached the Elvira De Matthaeis - University La Sapienza, 17th edition, held at the “Polo Territoriale della Italy Provincia di Trapani”, a site of the University of Felicita Scapini - University of Firenze, Italy Palermo, in Italy; and for the second time in Sicily Alberto Ugolini - University of Firenze, Italy (Lo Brutto et al., 2013). Maria Beatrice Scipione - Stazione Zoologica The Organizing and Scientific Committees were Anton Dohrn, Italy composed by people from different countries. -

Natur Und Heimat
Natur u. Heimat, 37. Jahrg., Heft 3, 1977 (1968): Gehäuse von Insekten-Larven, insbesondere von Chironomiden, in quar tären Sedimenten. Mitt. Geol. Inst. Univers. Hannover, 8, 34-53. ___.:._ HrLTERMANN, H. (1975): Kleiner Führer durch Solbad Laer T. W. Suderberger Hefte 1. - HrL TERMANN, H . (1976): Ein vergessener mittelalterlicher Baustein. Jb. Heimatbund Osnabrück-Land, 54-59. - HrLTERMANN, H. & K. MÄDLER (1977): Charophyten als palökologische Indikatoren und ihr Vorkommen in den Sinterkalken von Bad Laer T. W. Paläontol. Z. (im Druck). - ZEISSLER, H. (1977): Konchylien aus dem holozänen Travertin von Bad Laer, Kreis Osnabrück. (im Druck). Anschrift des Verfassers1: Prof. Dr. H. Hiltermann, Milanring 11, D-4518 Bad Laer. Die ersten Nachweise der Wasserassel Proasellus meridianus CRacovitza, 1919) (Crustacea, Isopoda Asellidae) im Einzugsgebiet der Ems KARL FRIEDRICH HERHAUS, Münster In Deutschland ist die von HENRY und MAGNIEZ (1970) revidierte Familie Asellida,e Sars, 1899, mit drei oberirdischen Arten vertreten. Die am weitesten verbreitete Art ist Asellus ( Asellus) aquaticus (L., 175 8); sie ist ein sibirisches Faunenelement, das sich postglazial nach Westen hin ausgebreitet hat (BrRSTEIN 1951; WILLIAMS 1962). Weitaus weniger häufig tritt die zweite Art, Proasellus coxalis (Dollfus, 1892), auf; diese im übrigen circummediterran verbreitete Art ist in Mittel europa mit der Unterart septentrionalis (Herbst, 1956) vertreten, die vermutlich erst in jüngster Zeit eingeschleppt worden ist (HERHAUS 1977). Am seltensten ist auf deutschem Boden die dritte Art, Proasellus meridianus (Racovitza, 1919). P. meridianus ist eine autochthon west europä,isch-atlantische Form (GRUNER 1965); in Deutschland wurde sie von STAMMER (1932) am linken Niederrhein nachgewiesen. Für die sichere Bestimmung der drei Arten ist die Untersuchung der Pleopoden II unter dem Binokular unerläßlich. -

A Synopsis of the Biology and Life History of Ruffe
J. Great Lakes Res. 24(2): 170-1 85 Internat. Assoc. Great Lakes Res., 1998 A Synopsis of the Biology and Life History of Ruffe Derek H. Ogle* Northland College Mathematics Department Ashland, Wisconsin 54806 ABSTRACT. The ruffe (Gymnocephalus cernuus), a Percid native to Europe and Asia, has recently been introduced in North America and new areas of Europe. A synopsis of the biology and life history of ruffe suggests a great deal of variability exists in these traits. Morphological characters vary across large geographical scales, within certain water bodies, and between sexes. Ruffe can tolerate a wide variety of conditions including fresh and brackish waters, lacustrine and lotic systems, depths of 0.25 to 85 m, montane and submontane areas, and oligotrophic to eutrophic waters. Age and size at maturity dif- fer according to temperature and levels of mortality. Ruffe spawn on a variety ofsubstrates, for extended periods of time. In some populations, individual ruffe may spawn more than once per year. Growth of ruffe is affected by sex, morphotype, water type, intraspecific density, and food supply. Ruffe feed on a wide variety of foods, although adult ruffe feed predominantly on chironomid larvae. Interactions (i.e., competition and predation) with other species appear to vary considerably between system. INDEX WORDS: Ruffe, review, taxonomy, reproduction, diet, parasite, predation. INTRODUCTION DISTRIBUTION This is a review of the existing literature on Ruffe are native to all of Europe except for along ruffe, providing a synopsis of its biology and life the Mediterranean Sea, western France, Spain, Por- history. A review of the existing literature is tugal, Norway, northern Finland, Ireland, and Scot- needed at this time because the ruffe, which is na- land (Collette and Banarescu 1977, Lelek 1987). -

Isopoda, Asellota) with Some Phylogenetic Considerations Concerning Asellota
Crustaceana 48 (2) 1985, E. J. Brill, Leiden A CONTRIBUTION TO THE GENERAL MORPHOLOGY OF PROTOJANIRIDAE (ISOPODA, ASELLOTA) WITH SOME PHYLOGENETIC CONSIDERATIONS CONCERNING ASELLOTA BY B. SKET Institut za biologijo, Univerza E. Kardelja v Ljubljani, p.p. 141, YU 61001 Ljubljana, Yugoslavia Since most representatives of the superfamily Gnathostenetroidoidea have been described only for "microtaxonomical" purposes, some important features and even peculiarities of the species and probably of the entire group have been overlooked. I took advantage of possessing a good sample of the comparatively very large representative, viz., Enckella lucei major Sket, 1982 (as well as some other species of the family Protojaniridae) to demonstrate some such features. Unfortunately, of the family Gnathostenetroididae I could study only specimens of an undescribed species from the Bahamas, while comparison with other representatives was possible only through illustrations. I abstained from comparing Enckella with the numerous and diverse Janiroidea, leaving this to a more versed student of that special group. I also abstained from discussing the remarkable idea about possible Asellotan nature of Microcerberidae (WageJe, J 980) which is anyway of little importance for the present subject. Cephalothorax ("head"). — With the exception of having two pairs of antennae, the Enckella's head bears greater resemblance to a prognathous in sect head than to an Asellid. The cephalic capsula is closed to a great extent, incorporating completely the first thoracomere. The capsula is closed and slightly sclerotised also behind the insertions of the maxillipeds, uniting them with the set of other mouth appendages. The clypeolabrum protrudes for wards, its inclination downwards is much less expressed than in most other groups of Isopoda. -

•Not! Ptdition, X:213-230
78 SMITHSONIAN CONTRIBUTIONS TO ZOOLOGY Carman, S. Knjyer, H. 1889. Cave Animal j from South we item Missouri. Bulle 1838. Gronlands Amphipoder. Kongelige danske viden* tin of the Museum of Comparative Zoology, skabernes Selskabbiologiske Skrifter, 7:229-326. 17(6):225-239. Latreille, P. A. Geoffrey Saint-Hilaire, E. L. 1803. Histoire naturelle, ginirale et particuliire, des 1764. Histoire abrigie dts Insectes qui se troitvcnt aux Cruslacis et dts Insectes, 6:1-391. Paris.* environs de Paris. Pari*.* Leonard, A. B,, and L. H. Ponder Gould, A. A, 1949. Crustacea of Eastern Kansas. Transactions of the 1841. Report on the Invertebrate Animals of Massachu Kansas Academy of Science, 52:168-204. setts. Cambridge: Massachusetts. Levi, H. W. Gruner, H. £. 1949. Two New Species of Cave Isopods from Pennsyl 1965. Die Tierwelt Deutschlands. Krebstiere oder Crus vania. Notulae Naturae, 220:1-fi. tacea. V, Isopoda. 53. Teil, 2 Lf. Jena. Linnaeus, C. Hansen, H. J. 1758. Systema Naturae. 10th Edition, 824 pages* 1888. Oversigt over det vestlige Gronlands Fauna. Mac Lin, J. G. Videnskabelige Meddeletier jra dansk Naturhis- 1940. A Key to the Oklahoma Species of the Family torisk Forening Kjobenhacn, 1887:177-198. Asellidae. Proceedings of the Oklahoma Academy Harford, W. G. W. of Science, 20:17-18. 1877. Description of a New Genus and Three New Spe Mackin, J. G, and L. Hubricht cies of Sessile Eyed Crustacea. Proceedings of the 1938. Records of Distribution of Species of Isopods in California Academy of Science, 7:53-55. Central and Southern United States, with Descrip Harger, O. tions of Four New Species of Mancasellus and 1874. -

Does Asellus Aquaticus Avoid Sediment Contaminated by the Insecticide Lufenuron?
DOES ASELLUS AQUATICUS AVOID SEDIMENT KOEN CONTAMINATED BY THE INSECTICIDE WORKEL LUFENURON? Aquatic Ecology and Water Quality Management Department Alterra – Environmental Risk Assessment Does Asellus aquaticus avoid sediment contaminated by the insecticide lufenuron? Master thesis for the attainment of the academic degree of MSc. Hydrology and Water Quality - Aquatic ecology Rapportnr. 010/2011 Koen Workel September 2011, Wageningen Supervisors: Dr. ir. Ivo Roessink Dr. Ir. Edwin Peeters MSc Jacqueline Augusiak Dr. Theo Brock Aquatic Ecology and Water Quality Management Department Alterra – Environmental Risk Assessment Niets uit deze uitgave mag worden verveelvoudigd en/of openbaar gemaakt door middel van druk, fotokopie, microfilm of op welke andere wijze ook zonder voorafgaande schriftelijke toestemming van Alterra Wageningen UR. Alterra B.V. aanvaardt geen aansprakelijkheid voor eventuele schade voortvloeiend uit het gebruik van de resultaten van dit onderzoek of de toepassing van de adviezen. Acknowledgment ‘Doing a thesis should be fun’, said Ivo in our first conversation. Giving the final touch to this report I realize that it was indeed fun! Did very nice experiments, learned many things about research and worked with pleasant people which that made me feel comfortable that really have great knowhow about aquatic ecology and risk assessment. In the first place many thanks to the ERA team of Alterra and Aquatic Ecology and Water Quality Management Department giving me the opportunity to do my master thesis under their supervision. Special thanks go to Ivo Roessink for his enthusiasm, always good mood and supervision. Many thanks to Jacqueline Augusiak for the nice practical cooperation and supervision and Theo Brock for his critical view and good ideas. -

Identification of Freshwater Invertebrates
Identification of Freshwater Invertebrates © 2008 Pennsylvania Sea Grant To request copies, please contact: Sara Grisé email: [email protected] Table of Contents A. Benthic Macroinvertebrates……………………….………………...........…………1 Arachnida………………………………..………………….............….…2 Bivalvia……………………...…………………….………….........…..…3 Clitellata……………………..………………….………………........…...5 Gastropoda………………………………………………………..............6 Hydrozoa………………………………………………….…………....…8 Insecta……………………..…………………….…………......…..……..9 Malacostraca………………………………………………....…….…....22 Turbellaria…………………………………………….….…..........…… 24 B. Plankton…………………………………………...……….………………............25 Phytoplankton Bacillariophyta……………………..……………………...……….........26 Chlorophyta………………………………………….....…………..........28 Cyanobacteria…...……………………………………………..…….…..32 Gamophyta…………………………………….…………...….…..…….35 Pyrrophycophyta………………………………………………………...36 Zooplankton Arthropoda……………………………………………………………....37 Ciliophora……………………………………………………………......41 Rotifera………………………………………………………………......43 References………………………………………………………….……………….....46 Taxonomy is the science of classifying and naming organisms according to their characteris- tics. All living organisms are classified into seven levels: Kingdom, Phylum, Class, Order, Family, Genus, and Species. This book classifies Benthic Macroinvertebrates by using their Class, Family, Genus, and Species. The Classes are the categories at the top of the page in colored text corresponding to the color of the page. The Family is listed below the common name, and the Genus and Spe- cies names -

Optimal Experimental Design for Predator-Prey Functional Response Experiments
Optimal Experimental Design for Predator-Prey Functional Response Experiments Jeff F. Zhangy, Nikos E. Papanikolaou∗;∗∗;∓, Theodore Kypraios] and Christopher C. Drovandiy;z y School of Mathematical Sciences, Queensland University of Technology, Australia z Australian Centre of Excellence for Mathematical and Statistical Frontiers (ACEMS) ∗Directorate of Plant Protection, Greek Ministry of Rural Development and Food, Athens, Greece ∗∗ Laboratory of Agricultural Zoology and Entomology, Agricultural University of Athens, Greece. ∓ Benaki Phytopathological Institute, Athens, Greece ]School of Mathematical Sciences, University of Nottingham, United Kingdom email: [email protected] July 22, 2018 Abstract Functional response models are important in understanding predator-prey in- teractions. The development of functional response methodology has progressed from mechanistic models to more statistically motivated models that can ac- count for variance and the over-dispersion commonly seen in the datasets col- lected from functional response experiments. However, little information seems to be available for those wishing to prepare optimal parameter estimation designs for functional response experiments. It is worth noting that optimally designed experiments may require smaller sample sizes to achieve the same statistical outcomes as non-optimally designed experiments. In this paper, we develop a model-based approach to optimal experimental design for functional response experiments in the presence of parameter uncertainty (also known as a robust -

Native and Exotic Amphipoda and Other Peracarida in the River Meuse: New Assemblages Emerge from a Fast Changing Fauna
Hydrobiologia (2005) 542:203–220 Ó Springer 2005 H. Segers & K. Martens (eds), Aquatic Biodiversity II DOI 10.1007/s10750-004-8930-9 Native and exotic Amphipoda and other Peracarida in the River Meuse: new assemblages emerge from a fast changing fauna Guy Josens1,*, Abraham Bij de Vaate2, Philippe Usseglio-Polatera3, Roger Cammaerts1,4, Fre´de´ric Che´rot1,4, Fre´de´ric Grisez1,4, Pierre Verboonen1 & Jean-Pierre Vanden Bossche1,4 1Universite´ Libre de Bruxelles, Service de syste´matique et d’e´cologie animales, av. Roosevelt, 50, cp 160/13, B-1050 Bruxelles 2Institute for Inland Water Management & Waste Water Treatment, Lelystad, The Netherlands 3Universite´ de Metz, LBFE, e´quipe de De´moe´cologie, av. Ge´ne´ral Delestraint, F-57070 Metz 4Centre de Recherche de la Nature, des Foreˆts et du Bois, DGRNE, Ministe`re de la Re´gion wallonne, Avenue Mare´chal Juin, 23, B-5030 Gembloux (*Author for correspondence: e-mail: [email protected]) Key words: aquatic biodiversity, alien species, invasive species, invasibility, community dynamics, Dikerogammarus villosus, Chelicorophium curvispinum Abstract Samples issued from intensive sampling in the Netherlands (1992–2001) and from extensive sampling carried out in the context of international campaigns (1998, 2000 and 2001) were revisited. Additional samples from artificial substrates (1992–2003) and other techniques (various periods) were analysed. The combined data provide a global and dynamic view on the Peracarida community of the River Meuse, with the focus on the Amphipoda. Among the recent exotic species found, Crangonyx pseudogracilis is regressing, Dikerogammarus haemobaphes is restricted to the Condroz course of the river, Gammarus tigrinus is restricted to the lowlands and seems to regress, Jaera istri is restricted to the ‘tidal’ Meuse, Chelicorophium curvispinum is still migrating upstream into the Lorraine course without any strong impact on the other amphipod species. -

Bijdragen Tot De Dierkunde, 62 (3) 179-191 (1993)
Bijdragen tot de Dierkunde, 62 (3) 179-191 (1993) SPB Academie Publishing bv, The Hague Présence d’Asellides stygobies (Crustacea, Isopoda, Aselloidea) dans la région du Primorye, Sibérie sud-orientale J.-P. Henry & G. Magniez Université de Bourgogne, Biologie Animale et Générale, 6, Bd. Gabriel, 21000 Dijon, France Keywords: stygobiont asellids, taxonomy, biogeography, Far East and Pacific North America Abstract orientale (région du Primorye). L’espèce nouvelle Asellus (Asel- lus) primoryensisest étroitement apparentée à l’espèce épigéeA. Two species of anophthalmous, unpigmentedasellids have been (A.) hilgendorfiiBovallius, 1886, comme c’était déjà le cas pour found in springs and groundwaters of S.E. Siberia (Primorye tous les Asellus (Asellus) stygobies précédemment découverts region). Asellus (Asellus) primoryensis n. sp. is closelyrelated to dans les eaux souterraines de l’archipel japonais. A. the epigean species (A.) hilgendorfiiBovallius, 1886, as is the L’espèce Sibirasellus parpurae n. g., n. sp. est étroitement ap- case for all stygobiont Asellus (Asellus) species previously parentée à une espèce microphtalme du bassin de l’Oussouri, known from the Japanese archipelago. région de Khor: Asellus dentiferBirstein & Levanidov, 1952 qui devient du Sibirasellus parpurae n. g., n. sp. is closely related to the l’espèce-type nouveau genre Sibirasellus. Ces deux microphthalmousspecies Asellus dentiferBirstein & Levanidov, espèces présentent plusieurs caractères originaux: corps couvert the Basin 1952 from Ussuri (Khor region), now type-species of de nombreuses squamules cuticulaires, palpe mandibulaire the new genus Sibirasellus. These two species show several origi- glabre et réduit à 2 articles, et coxopodites des péréiopodes nal characters: body covered by numerouscuticular squamulae, réduits et ankylosés avec leur sternite. -
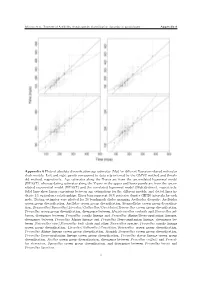
Appendix 6 Plots of Absolute Diversification Age Estimates (Ma
Morvan et al. Timetree of Aselloidea reveals species diversification dynamics in groundwater Appendix 6 Appendix 6 Plots of absolute diversification age estimates (Ma) for different Bayesian relaxed molecular clock models. Left and right panels correspond to data sets inferred by the GMYC method and thresh- old method, respectively. Age estimates along the X-axis are from the uncorrelated lognormal model (BEAST), whereas dating estimates along the Y-axis in the upper and lower panels are from the uncor- related exponential model (BEAST) and the correlated lognormal model (Multidivtime), respectively. Solid lines show linear regressions between age estimations for the different models, and dotted lines in- dicate 1:1 equivalence relationships. Error bars represent 95% posterior density (HPD) intervals for each node. Dating estimates were plotted for 20 benchmark clades spanning Aselloidea diversity: Aselloidea crown group diversification, Asellidae crown group diversification, Stenasellidae crown group diversifica- tion, Bragasellus/Synasellus/Lirceolus/Gallasellus/Caecidotea/Remasellus crown group diversification, Proasellus crown group diversification, divergence between Mexistenasellus coahuila and Stenasellus gal- hanoe, divergence between Proasellus coxalis lineage and Proasellus Alpine/Ibero-aquitanian lineages, divergence between Proasellus Alpine lineage and Proasellus Ibero-aquitanian lineage, divergence be- tween Stenasellus virei/Stenasellus buili clade and other Stenasellus species, Proasellus coxalis lineage crown group diversification, Lirceolus/Gallasellus/Caecidotea/Remasellus crown group diversification, Proasellus Alpine lineage crown group diversification, Spanish Bragasellus crown group diversification, Proasellus Ibero-aquitanian lineage crown group diversification, Proasellus slavus lineage crown group diversification, Asellus crown group diversification, divergence between Proasellus coiffaiti and Proasel- lus slovenicus, Synasellus crown group diversification, and divergence between Proasellus beroni and Proasellus ligusticus. -

Groundwater Ecology: Invertebrate Community Distribution Across the Benthic, Hyporheic and Phreatic Habitats of a Chalk Aquifer in Southeast England
Groundwater Ecology: Invertebrate Community Distribution across the Benthic, Hyporheic and Phreatic Habitats of a Chalk Aquifer in Southeast England Jessica M. Durkota Thesis submitted in partial fulfilment of the requirements for the degree of Doctor of Philosophy University College London Declaration of the Author I, Jessica M. Durkota, confirm that the work presented in this thesis is my own. Where information has been derived from other sources, I confirm that this has been indicated in the thesis. This work was undertaken with the partial support of the Environment Agency. The views expressed in this publication are mine and mine alone and not necessarily those of the Environment Agency or University College London (UCL). 2 Abstract Groundwater is an important resource for drinking water, agriculture, and industry, but it also plays an essential role in supporting the functioning of freshwater ecosystems and providing habitat for a number of rare species. However, despite its importance, groundwater ecology often receives little attention in environmental legislation or research. This study aims to improve our understanding of the organisms living in groundwater-dependent habitats and the influence of environmental conditions on their distribution. Invertebrate communities occurring in the benthic, hyporheic and phreatic habitats were surveyed at twelve sites over four years across the Stour Chalk Block, a lowland catchment in southern England. A diverse range of stygoxenes, stygophiles and stygobionts, including the first record of Gammarus fossarum in the British Isles, were identified using morphological and molecular techniques. The results indicate that under normal conditions, each habitat provided differing environmental conditions which supported a distinctive invertebrate community.