International Nonproprietary Names for Pharmaceutical Substances (INN)
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Adherent Intestinal Cells from Atlantic Salmon Show Phagocytic Ability and Express Macrophage-Specific Genes
fcell-08-580848 October 11, 2020 Time: 9:56 # 1 ORIGINAL RESEARCH published: 15 October 2020 doi: 10.3389/fcell.2020.580848 Adherent Intestinal Cells From Atlantic Salmon Show Phagocytic Ability and Express Macrophage-Specific Genes Youngjin Park1, Qirui Zhang2, Geert F. Wiegertjes3, Jorge M.O. Fernandes1 and Viswanath Kiron1* 1 Faculty of Biosciences and Aquaculture, Nord University, Bodø, Norway, 2 Division of Clinical Genetics, Lund University, Lund, Sweden, 3 Aquaculture and Fisheries Group, Wageningen University & Research, Wageningen, Netherlands Our knowledge of the intestinal immune system of fish is rather limited compared to mammals. Very little is known about the immune cells including the phagocytic cells Edited by: Yi Feng, in fish intestine. Hence, employing imaging flow cytometry and RNA sequencing, we The University of Edinburgh, studied adherent cells isolated from healthy Atlantic salmon. Phagocytic activity and United Kingdom selected gene expression of adherent cells from the distal intestine (adherent intestinal Reviewed by: cells, or AIC) were compared with those from head kidney (adherent kidney cells, or Dimitar Borisov Iliev, Institute of Molecular Biology (BAS), AKC). Phagocytic activity of the two cell types was assessed based on the uptake Bulgaria of Escherichia coli BioParticlesTM. AIC showed phagocytic ability but the phagocytes Sherri L. Christian, Memorial University of Newfoundland, were of different morphology compared to AKC. Transcriptomic analysis revealed that Canada AIC expressed genes associated with macrophages, T cells, and endothelial cells. *Correspondence: Heatmap analysis of selected genes indicated that the adherent cells from the two Viswanath Kiron organs had apparently higher expression of macrophage-related genes. We believe [email protected] that the adherent intestinal cells have phagocytic characteristics and high expression Specialty section: of genes commonly associated with macrophages. -

Protein Identities in Evs Isolated from U87-MG GBM Cells As Determined by NG LC-MS/MS
Protein identities in EVs isolated from U87-MG GBM cells as determined by NG LC-MS/MS. No. Accession Description Σ Coverage Σ# Proteins Σ# Unique Peptides Σ# Peptides Σ# PSMs # AAs MW [kDa] calc. pI 1 A8MS94 Putative golgin subfamily A member 2-like protein 5 OS=Homo sapiens PE=5 SV=2 - [GG2L5_HUMAN] 100 1 1 7 88 110 12,03704523 5,681152344 2 P60660 Myosin light polypeptide 6 OS=Homo sapiens GN=MYL6 PE=1 SV=2 - [MYL6_HUMAN] 100 3 5 17 173 151 16,91913397 4,652832031 3 Q6ZYL4 General transcription factor IIH subunit 5 OS=Homo sapiens GN=GTF2H5 PE=1 SV=1 - [TF2H5_HUMAN] 98,59 1 1 4 13 71 8,048185945 4,652832031 4 P60709 Actin, cytoplasmic 1 OS=Homo sapiens GN=ACTB PE=1 SV=1 - [ACTB_HUMAN] 97,6 5 5 35 917 375 41,70973209 5,478027344 5 P13489 Ribonuclease inhibitor OS=Homo sapiens GN=RNH1 PE=1 SV=2 - [RINI_HUMAN] 96,75 1 12 37 173 461 49,94108966 4,817871094 6 P09382 Galectin-1 OS=Homo sapiens GN=LGALS1 PE=1 SV=2 - [LEG1_HUMAN] 96,3 1 7 14 283 135 14,70620005 5,503417969 7 P60174 Triosephosphate isomerase OS=Homo sapiens GN=TPI1 PE=1 SV=3 - [TPIS_HUMAN] 95,1 3 16 25 375 286 30,77169764 5,922363281 8 P04406 Glyceraldehyde-3-phosphate dehydrogenase OS=Homo sapiens GN=GAPDH PE=1 SV=3 - [G3P_HUMAN] 94,63 2 13 31 509 335 36,03039959 8,455566406 9 Q15185 Prostaglandin E synthase 3 OS=Homo sapiens GN=PTGES3 PE=1 SV=1 - [TEBP_HUMAN] 93,13 1 5 12 74 160 18,68541938 4,538574219 10 P09417 Dihydropteridine reductase OS=Homo sapiens GN=QDPR PE=1 SV=2 - [DHPR_HUMAN] 93,03 1 1 17 69 244 25,77302971 7,371582031 11 P01911 HLA class II histocompatibility antigen, -

Signal Transduction Guide
Signal Transduction Product Guide | 2007 NEW! Selective T-type Ca2+ channel blockers, NNC 55-0396 and Mibefradil ZM 447439 – Novel Aurora Kinase Inhibitor NEW! Antibodies for Cancer Research EGFR-Kinase Selective Inhibitors – BIBX 1382 and BIBU 1361 DRIVING RESEARCH FURTHER Calcium Signaling Agents ...................................2 G Protein Reagents ...........................................12 Cell Cycle and Apoptosis Reagents .....................3 Ion Channel Modulators ...................................13 Cyclic Nucleotide Related Tools ...........................7 Lipid Signaling Agents ......................................17 Cytokine Signaling Agents ..................................9 Nitric Oxide Tools .............................................19 Enzyme Inhibitors/Substrates/Activators ..............9 Protein Kinase Reagents....................................22 Glycobiology Agents .........................................12 Protein Phosphatase Reagents ..........................33 Neurochemicals | Signal Transduction Agents | Peptides | Biochemicals Signal Transduction Product Guide Calcium Signaling Agents ......................................................................................................................2 Calcium Binding Protein Modulators ...................................................................................................2 Calcium ATPase Modulators .................................................................................................................2 Calcium Sensitive Protease -

A Novel, Highly Potent and Selective Phosphodiesterase-9 Inhibitor for the Ferrata Storti Foundation Treatment of Sickle Cell Disease
Red Cell Biology & its Disorders ARTICLE A novel, highly potent and selective phosphodiesterase-9 inhibitor for the Ferrata Storti Foundation treatment of sickle cell disease James G. McArthur,1 Niels Svenstrup,2 Chunsheng Chen,3 Aurelie Fricot,4 Caroline Carvalho,4 Julia Nguyen,3 Phong Nguyen,3 Anna Parachikova,2 Fuad Abdulla,3 Gregory M. Vercellotti,3 Olivier Hermine,4 Dave Edwards,5 Jean-Antoine Ribeil,6 John D. Belcher3 and Thiago T. Maciel4 1Imara Inc., 2nd Floor, 700 Technology Square, Cambridge, MA, USA; 2H. Lundbeck A/S, 3 Haematologica 2020 Ottiliavej 9, 2500 Valby, Denmark; Department of Medicine, Division of Hematology, Oncology and Transplantation, University of Minnesota, Minneapolis, MN, USA; Volume 105(3):623-631 4INSERM UMR 1163, CNRS ERL 8254, Imagine Institute, Laboratory of Excellence GR-Ex, Paris Descartes - Sorbonne Paris Cité University, Paris, France; 5Kinexum, 8830 Glen Ferry Drive, Johns Creek, GA, USA and 6Departments of Biotherapy, Necker Children’s Hospital, Assistance Publique-Hôpitaux de Paris (AP-HP), Paris Descartes- Sorbonne Paris Cité University, Paris, France ABSTRACT he most common treatment for patients with sickle cell disease (SCD) is the chemotherapeutic hydroxyurea, a therapy with Tpleiotropic effects, including increasing fetal hemoglobin (HbF) in red blood cells and reducing adhesion of white blood cells to the vascular endothelium. Hydroxyurea has been proposed to mediate these effects through a mechanism of increasing cellular cGMP levels. An alternative path to increasing cGMP levels in these cells is through the use of phospho- diesterase-9 inhibitors that selectively inhibit cGMP hydrolysis and increase cellular cGMP levels. We have developed a novel, potent and selective phosphodiesterase-9 inhibitor (IMR-687) specifically for the treatment of Correspondence: SCD. -

Fecal Metatranscriptomics of Macaques with Idiopathic Chronic Diarrhea Reveals Altered Mucin Degradation and Fucose Utilization Samuel T
Westreich et al. Microbiome (2019) 7:41 https://doi.org/10.1186/s40168-019-0664-z RESEARCH Open Access Fecal metatranscriptomics of macaques with idiopathic chronic diarrhea reveals altered mucin degradation and fucose utilization Samuel T. Westreich1, Amir Ardeshir2, Zeynep Alkan3, Mary E. Kable3,4, Ian Korf1 and Danielle G. Lemay1,3,4* Abstract Background: Idiopathic chronic diarrhea (ICD) is a common cause of morbidity and mortality among juvenile rhesus macaques. Characterized by chronic inflammation of the colon and repeated bouts of diarrhea, ICD is largely unresponsive to medical interventions, including corticosteroid, antiparasitic, and antibiotic treatments. Although ICD is accompanied by large disruptions in the composition of the commensal gut microbiome, no single pathogen has been concretely identified as responsible for the onset and continuation of the disease. Results: Fecal samples were collected from 12 ICD-diagnosed macaques and 12 age- and sex-matched controls. RNA was extracted for metatranscriptomic analysis of organisms and functional annotations associated with the gut microbiome. Bacterial, fungal, archaeal, protozoan, and macaque (host) transcripts were simultaneously assessed. ICD- afflicted animals were characterized by increased expression of host-derived genes involved in inflammation and increased transcripts from bacterial pathogens such as Campylobacter and Helicobacter and the protozoan Trichomonas. Transcripts associated with known mucin-degrading organisms and mucin-degrading enzymes were elevated in the fecal microbiomes of ICD-afflicted animals. Assessment of colon sections using immunohistochemistry and of the host transcriptome suggests differential fucosylation of mucins between control and ICD-afflicted animals. Interrogation of the metatranscriptome for fucose utilization genes reveals possible mechanisms by which opportunists persist in ICD. -

Identification of Potential Key Genes and Pathway Linked with Sporadic Creutzfeldt-Jakob Disease Based on Integrated Bioinformatics Analyses
medRxiv preprint doi: https://doi.org/10.1101/2020.12.21.20248688; this version posted December 24, 2020. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted medRxiv a license to display the preprint in perpetuity. All rights reserved. No reuse allowed without permission. Identification of potential key genes and pathway linked with sporadic Creutzfeldt-Jakob disease based on integrated bioinformatics analyses Basavaraj Vastrad1, Chanabasayya Vastrad*2 , Iranna Kotturshetti 1. Department of Biochemistry, Basaveshwar College of Pharmacy, Gadag, Karnataka 582103, India. 2. Biostatistics and Bioinformatics, Chanabasava Nilaya, Bharthinagar, Dharwad 580001, Karanataka, India. 3. Department of Ayurveda, Rajiv Gandhi Education Society`s Ayurvedic Medical College, Ron, Karnataka 562209, India. * Chanabasayya Vastrad [email protected] Ph: +919480073398 Chanabasava Nilaya, Bharthinagar, Dharwad 580001 , Karanataka, India NOTE: This preprint reports new research that has not been certified by peer review and should not be used to guide clinical practice. medRxiv preprint doi: https://doi.org/10.1101/2020.12.21.20248688; this version posted December 24, 2020. The copyright holder for this preprint (which was not certified by peer review) is the author/funder, who has granted medRxiv a license to display the preprint in perpetuity. All rights reserved. No reuse allowed without permission. Abstract Sporadic Creutzfeldt-Jakob disease (sCJD) is neurodegenerative disease also called prion disease linked with poor prognosis. The aim of the current study was to illuminate the underlying molecular mechanisms of sCJD. The mRNA microarray dataset GSE124571 was downloaded from the Gene Expression Omnibus database. Differentially expressed genes (DEGs) were screened. -

Cloud-Clone 16-17
Cloud-Clone - 2016-17 Catalog Description Pack Size Supplier Rupee(RS) ACB028Hu CLIA Kit for Anti-Albumin Antibody (AAA) 96T Cloud-Clone 74750 AEA044Hu ELISA Kit for Anti-Growth Hormone Antibody (Anti-GHAb) 96T Cloud-Clone 74750 AEA255Hu ELISA Kit for Anti-Apolipoprotein Antibodies (AAHA) 96T Cloud-Clone 74750 AEA417Hu ELISA Kit for Anti-Proteolipid Protein 1, Myelin Antibody (Anti-PLP1) 96T Cloud-Clone 74750 AEA421Hu ELISA Kit for Anti-Myelin Oligodendrocyte Glycoprotein Antibody (Anti- 96T Cloud-Clone 74750 MOG) AEA465Hu ELISA Kit for Anti-Sperm Antibody (AsAb) 96T Cloud-Clone 74750 AEA539Hu ELISA Kit for Anti-Myelin Basic Protein Antibody (Anti-MBP) 96T Cloud-Clone 71250 AEA546Hu ELISA Kit for Anti-IgA Antibody 96T Cloud-Clone 71250 AEA601Hu ELISA Kit for Anti-Myeloperoxidase Antibody (Anti-MPO) 96T Cloud-Clone 71250 AEA747Hu ELISA Kit for Anti-Complement 1q Antibody (Anti-C1q) 96T Cloud-Clone 74750 AEA821Hu ELISA Kit for Anti-C Reactive Protein Antibody (Anti-CRP) 96T Cloud-Clone 74750 AEA895Hu ELISA Kit for Anti-Insulin Receptor Antibody (AIRA) 96T Cloud-Clone 74750 AEB028Hu ELISA Kit for Anti-Albumin Antibody (AAA) 96T Cloud-Clone 71250 AEB264Hu ELISA Kit for Insulin Autoantibody (IAA) 96T Cloud-Clone 74750 AEB480Hu ELISA Kit for Anti-Mannose Binding Lectin Antibody (Anti-MBL) 96T Cloud-Clone 88575 AED245Hu ELISA Kit for Anti-Glutamic Acid Decarboxylase Antibodies (Anti-GAD) 96T Cloud-Clone 71250 AEK505Hu ELISA Kit for Anti-Heparin/Platelet Factor 4 Antibodies (Anti-HPF4) 96T Cloud-Clone 71250 CCA005Hu CLIA Kit for Angiotensin II -
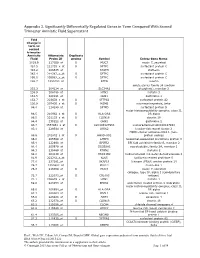
Appendix 2. Significantly Differentially Regulated Genes in Term Compared with Second Trimester Amniotic Fluid Supernatant
Appendix 2. Significantly Differentially Regulated Genes in Term Compared With Second Trimester Amniotic Fluid Supernatant Fold Change in term vs second trimester Amniotic Affymetrix Duplicate Fluid Probe ID probes Symbol Entrez Gene Name 1019.9 217059_at D MUC7 mucin 7, secreted 424.5 211735_x_at D SFTPC surfactant protein C 416.2 206835_at STATH statherin 363.4 214387_x_at D SFTPC surfactant protein C 295.5 205982_x_at D SFTPC surfactant protein C 288.7 1553454_at RPTN repetin solute carrier family 34 (sodium 251.3 204124_at SLC34A2 phosphate), member 2 238.9 206786_at HTN3 histatin 3 161.5 220191_at GKN1 gastrokine 1 152.7 223678_s_at D SFTPA2 surfactant protein A2 130.9 207430_s_at D MSMB microseminoprotein, beta- 99.0 214199_at SFTPD surfactant protein D major histocompatibility complex, class II, 96.5 210982_s_at D HLA-DRA DR alpha 96.5 221133_s_at D CLDN18 claudin 18 94.4 238222_at GKN2 gastrokine 2 93.7 1557961_s_at D LOC100127983 uncharacterized LOC100127983 93.1 229584_at LRRK2 leucine-rich repeat kinase 2 HOXD cluster antisense RNA 1 (non- 88.6 242042_s_at D HOXD-AS1 protein coding) 86.0 205569_at LAMP3 lysosomal-associated membrane protein 3 85.4 232698_at BPIFB2 BPI fold containing family B, member 2 84.4 205979_at SCGB2A1 secretoglobin, family 2A, member 1 84.3 230469_at RTKN2 rhotekin 2 82.2 204130_at HSD11B2 hydroxysteroid (11-beta) dehydrogenase 2 81.9 222242_s_at KLK5 kallikrein-related peptidase 5 77.0 237281_at AKAP14 A kinase (PRKA) anchor protein 14 76.7 1553602_at MUCL1 mucin-like 1 76.3 216359_at D MUC7 mucin 7, -

UNIVERSITY of CALIFORNIA, SAN DIEGO Vitamin
UNIVERSITY OF CALIFORNIA, SAN DIEGO Vitamin D Regulates MUC17 Expression in Caco-2 Cells in A thesis submitted in partial satisfaction of the requirements for the degree Master of Science in Biology by Sara Quraish Tabikh Committee in charge: Professor Silvia Resta-Lenert, Chair Professor Immo Scheffler, Co-Chair Professor Kim Barrett 2010 The Thesis of Sara Quraish Tabikh is approved and it is acceptable in quality and form for publication on microfilm and electronically: Co-Chair Chair University of California, San Diego 2010 iii My work is dedicated to my mother and father, who I am forever indebted to for their undying support, who have always motivated me to achieve of a higher level of education, and who have supported me to always strive for my dream of becoming a medical doctor since the age of three. It is also dedicated to those who suffer from gastrointestinal diseases; I hope this research proves promising towards the development of cures for GI diseases. iv TABLE OF CONTENTS Signature Page ................................................................................................................... iii Dedication .......................................................................................................................... iv Table of Contents .................................................................................................................v List of Abbreviations ......................................................................................................... vi List of Figures .................................................................................................................. -

Characterization of the First Potent and Selective PDE9 Inhibitor Using A
Molecular Pharmacology Fast Forward. Published on September 8, 2005 as DOI: 10.1124/mol.105.017608 Molecular PharmacologyThis article Fasthas not Forward. been copyedited Published and formatted. on TheSeptember final version 8,may 2005 differ asfrom doi:10.1124/mol.105.017608 this version. MOL 17608 Characterization of the first potent and selective PDE9 inhibitor using a cGMP reporter cell line Frank Wunder, Adrian Tersteegen, Annegret Rebmann, Christina Erb, Thomas Fahrig, and Martin Hendrix Downloaded from molpharm.aspetjournals.org Cardiovascular Research (F.W., A.R.), Molecular Screening Technology (A.T.), CNS Research (C.E., T.F.) and Medicinal Chemistry (M.H.), Bayer HealthCare AG, Aprather Weg 18a, D-42096 Wuppertal, Germany at ASPET Journals on September 23, 2021 1 Copyright 2005 by the American Society for Pharmacology and Experimental Therapeutics. Molecular Pharmacology Fast Forward. Published on September 8, 2005 as DOI: 10.1124/mol.105.017608 This article has not been copyedited and formatted. The final version may differ from this version. MOL 17608 Running title: Characterization of the first selective PDE9 inhibitor Corresponding author: Dr. Frank Wunder Bayer HealthCare AG Cardiovascular Research Aprather Weg 18a D-42096 Wuppertal, Germany Downloaded from PHONE: ++ 49-202-364107 FAX: ++ 49-202-368009 E-MAIL: [email protected] molpharm.aspetjournals.org Number of text pages: 28 Number of tables: 1 Number of figures: 6 at ASPET Journals on September 23, 2021 Number of references: 26 Number of words in the abstract: 232 Number of words in the introduction: 658 Number of words in the discussion: 1407 Abbreviations: cGMP, guanosine 3'-5'-cyclic monophosphate; CNG, cyclic nucleotide-gated; IBMX, 3-isobutyl-1-methylxanthin; MTP, microtiter plate; NO, nitric oxide; PDE, cyclic nucleotide-specific phosphodiesterase; RLU, relative light unit; sGC, soluble guanylate cyclase; uHTS, ultra-high-throughput screening 2 Molecular Pharmacology Fast Forward. -

Q2 '21 Earnings Call
Q2 ’21 EARNINGS CALL AUGUST 3, 2021 SAFE HARBOR STATEMENT This presentation contains forward-looking statements that are based on management’s current expectations and beliefs and are subject to a number of risks, uncertainties and assumptions that could cause actual results to differ materially from those described. All statements, other than statements of historical fact, are statements that could be deemed forward-looking statements, including any statements on the outcome, benefits and synergies of collaborations, or potential collaborations, with any other company, (including BeiGene, Ltd. or any collaboration to manufacture therapeutic antibodies against COVID-19), the performance of Otezla® (apremilast) (including anticipated Otezla sales growth and the timing of non-GAAP EPS accretion), or the Five Prime Therapeutics, Inc. acquisition, as well as estimates of revenues, operating margins, capital expenditures, cash, other financial metrics, expected legal, arbitration, political, regulatory or clinical results or practices, customer and prescriber patterns or practices, reimbursement activities and outcomes, effects of pandemics or other widespread health problems such as the ongoing COVID-19 pandemic on our business, outcomes progress, or effects relating to studies of Otezla as a potential treatment for COVID-19, and other such estimates and results. Forward-looking statements involve significant risks and uncertainties, including those discussed below and more fully described in the Securities and Exchange Commission (SEC) reports filed by Amgen, including Amgen’s most recent annual report on Form 10-K and any subsequent periodic reports on Form 10-Q and current reports on Form 8-K. Please refer to Amgen’s most recent Forms 10-K, 10-Q and 8-K for additional information on the uncertainties and risk factors related to our business. -

Cardioprotection by Bioactive Polyphenols: a Strategic View
Open Access Austin Journal of Cardiovascular Disease and Atherosclerosis Review Article Cardioprotection by Bioactive Polyphenols: A Strategic View Chu AJ* Department of Surgery, School of Medicine, Wayne State Abstract University, Detroit, USA Cardiovascular disease (CVD) remains one causing most mortality *Corresponding author: Arthur J. Chu, Department worldwide. Common CVD risks include oxidative stress, hyperlipidemia, of Surgery, School of Medicine, Wayne State University, endothelial dysfunction, thrombosis, hypertension, hyperhomocysteinemia, Detroit, USA inflammation, diabetes, obesity, physical inactivity, and genetic factors. Among which, lifestyle changes including diets are modifiable CVD risks, becoming Received: February 15, 2018; Accepted: March 23, the first line of prevention prior to any medication. In the past decades, the 2018; Published: March 30, 2018 USDA, the American Heart Association, the American Nutrition Association, the Academy of Nutrition and Dietetics, and many other health organizations have launched five colors daily with vegetable and fruit consumption for human health. Lipophilic polyphenols, phytochemicals rich in vegetables and fruits, show classical antioxidation (e.g., radical-scavenging, metal chelating, NOX inhibition, attenuation on mitochondrial respiration, inhibition on xanthine oxidase, and upregulations on endogenous antioxidant enzymes), multiple effects on cell signaling (e.g., AMPK activation, SirT1 activation, eNOS activation, FOXO activation, NFkB inactivation, PI3K/AkT inhibition,