Documento Completo Descargar Archivo
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Bayesian Total Evidence Dating Reveals the Recent Crown Radiation of Penguins
Supporting Information Bayesian total evidence dating reveals the recent crown radiation of penguins Contents 1 Methods 1 1.1 Prior distributions for parameters..........................1 1.2 Data..........................................2 1.3 Fossil ages.......................................2 1.4 Validation.......................................8 2 Results 8 2.1 Divergence dates...................................8 2.2 Sensitivity to the choice of prior distributions for the net diversification rate.. 11 1 Methods 1.1 Prior distributions for parameters We used the following prior distributions for the parameters in all analyses except for the sensitivity analyses. For the net diversification rate, d, we place a log-normal prior distribution with parameters1 M = −3:5 and S2 = 1:5. The 2.5% and 97.5% quantiles of this distribution are 1:6 · 10−3 and 0:57 implying that it well covers the interval (with the lowest 5% quantile of 0.02 and the largest 95% quantile of 0.15) estimated in [1] Figure 1. We place a Uniform(0,1) prior distribution for the turnover, ν, and Uniform(0,1) prior distri- bution for the fossil sampling proportion, s. For birth, death and sampling rates (λ, µ, and ) we used log-normal distributions with pa- rameters1 M = −2:5 and S2 = 1:5 and 2.5% and 97.5% quantiles of 4:34 · 10−3 and 1:55. For the time of origin, tor, we use the Uniform prior distribution between the oldest sample and 160 Ma because Jetz et al. estimated the upper bound for the MRCA of all birds to be 1Parameters M and S for log-normal distributions here are the mean and standard deviation of the associated normal distributions 1 150 Ma ([1] Figure 1) and Lee et al. -

REPORT 2015 Vol. 6
REPORT 2015 vol. 6 Forward-thinking articles from our global network of innovation ecosystem experts KFR Staff KF Board of Directors Publisher Brian Dovey, Chairman Kauffman Fellows Press Domain Associates Executive Editor Tom Baruch Phil Wickham Formation 8 Managing Editor Jason Green Anna F.Doherty Emergence Capital Partners Associate Editor Karen Kerr Leslie F. Peters Agile Equities, LLC Production and Design Audrey MacLean Anna F. Doherty Stanford University Leslie F. Peters Susan Mason Printer Aligned Partners Almaden Press www.almadenpress.com Jenny Rooke Copyright Fidelity Biosciences © 2015 Kauffman Fellows. All rights reserved. Christian Weddell Under no circumstances shall any of the information provided herein be construed as investment advice of any kind. Copan About the Editor Phil Wickham Anna F. Doherty is an accomplished editor and writing Kauffman Fellows coach with a unique collaborative focus in her work. She has 20 years of editing experience on three continents in a variety of business industries. Through her firm, Together Editing & Design, she has offered a full suite of writing, design, and publishing services to Kauffman Fellows since 2009. Leslie F. Peters is the Lead Designer on the TE&D team. www.togetherediting.com www.kauffmanfellows.org Town & Country Village • 855 El Camino Real, Suite 12 • Palo Alto, CA 94301 Phone: 650-561-7450 • Fax: 650-561-7451 iii Kauffman Fellows on the Science of Capital Formation Phil Wickham To describe the unique contribution of Kauffman Fellows to the venture capital ecosystem, the author introduces a Startup Capital Hierarchy of Needs. While financial capital and intellectual capital are most often discussed, three other “shadow” capital types are needed for success. -

Bird Fossils from the Takatika Grit, Chatham Island
BIRD FOSSILS FROM THE TAKATIKA GRIT, CHATHAM ISLAND, NEW ZEALAND A thesis submitted in partial fulfilment of the requirements for the Degree of Master of Science in Geology At the University of Canterbury By Jacob Christopher Blokland University of Canterbury 2017 Figure I: An interpretation of Archaeodyptes stilwelli. Original artwork by Jacob Blokland. i ACKNOWLEDGEMENTS The last couple years have been exciting and challenging. It has been a pleasure to work with great people, and be involved with new research that will hopefully be of contribution to science. First of all, I would like to thank my two supervisors, Dr Catherine Reid and Dr Paul Scofield, for tirelessly reviewing my work and providing feedback. I literally could not have done it without you, and your time, patience and efforts are very much appreciated. Thank you for providing me with the opportunity to do a vertebrate palaeontology based thesis. I would like to extend my deepest gratitude to Catherine for encouragement regarding my interest in palaeontology since before I was an undergraduate, and providing great information regarding thesis and scientific format. I am also extremely grateful to Paul for welcoming me to use specimens from Canterbury Museum, and providing useful information and recommendations for this project through your expertise in this particular discipline. I would also like to thank Associate Professor Jeffrey Stilwell for collecting the fossil specimens used in this thesis, and for the information you passed on regarding the details of the fossils. Thank you to Geoffrey Guinard for allowing me to use your data from your published research in this study. -

Watriama and Co Further Pacific Islands Portraits
Watriama and Co Further Pacific Islands Portraits Hugh Laracy Watriama and Co Further Pacific Islands Portraits Hugh Laracy Published by ANU E Press The Australian National University Canberra ACT 0200, Australia Email: [email protected] This title is also available online at http://epress.anu.edu.au National Library of Australia Cataloguing-in-Publication entry Author: Laracy, Hugh, author. Title: Watriama and Co : further Pacific Islands portraits / Hugh Laracy. ISBN: 9781921666322 (paperback) 9781921666339 (ebook) Subjects: Watriama, William Jacob, 1880?-1925. Islands of the Pacific--History. Dewey Number: 995.7 All rights reserved. No part of this publication may be reproduced, stored in a retrieval system or transmitted in any form or by any means, electronic, mechanical, photocopying or otherwise, without the prior permission of the publisher. Cover design and layout by ANU E Press Printed by Griffin Press This edition © 2013 ANU E Press Contents Preface . ix 1 . Pierre Chanel of Futuna (1803–1841): The making of a saint . 1 2 . The Sinclairs Of Pigeon Bay, or ‘The Prehistory of the Robinsons of Ni’ihau’: An essay in historiography, or ‘tales their mother told them’ . 33 3 . Insular Eminence: Cardinal Moran (1830–1911) and the Pacific islands . 53 4 . Constance Frederica Gordon-Cumming (1837–1924): Traveller, author, painter . 69 5 . Niels Peter Sorensen (1848–1935): The story of a criminal adventurer . 93 6 . John Strasburg (1856–1924): A plain sailor . 111 7 . Ernest Frederick Hughes Allen (1867–1924): South Seas trader . 127 8 . Beatrice Grimshaw (1870–1953): Pride and prejudice in Papua . 141 9 . W .J . Watriama (c . 1880–1925): Pretender and patriot, (or ‘a blackman’s defence of White Australia’) . -
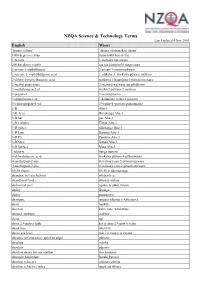
NZQA Science & Technology Terms
NZQA Science & Technology Terms Last Updated 4 Nov 2010 English Māori ‘fitness culture’ ‘ahurea whakapakari tinana’ 1000 degrees celsius mano takiri henekereti 1-hexene 1-waiwaro rua owaro 200 km above (earth) rua rau kiromita ki runga rawa 2-amino-3-methylbutane 2-amino-3-mewarop ūwaro 2–bromo–3–methylbutanoic acid 2–pūkeha–3–waikawa p ūwaro m ēwaro 2-chloro-3-methylbutanoic acid waikawa 2-haum āota-3-pūwaro mewaro 2-methyl propenoate 2-mewaro waiwaro rua p ōhākawa 2-methylpropan-2-ol waihä-2-pöwaro-2-mewaro 2-propanol 2-waih ā p ōwaro 3-chlorobutan-1-ol 3-haum āota waih ā-1-pūwaro 3–chloropropan–1–ol 3–waih ā–1–pōwaro p ūhaum āota 3-D Ahu-3 3-D Area Horahanga Ahu-3 3-D bar pae Ahu-3 3-D Column Tīwae Ahu-3 3-D effect rākeitanga Ahu-3 3-D Line Rārangi Ahu-3 3-D Pie Porohita Ahu-3 3-D Style Kāhua Ahu-3 3-D Surface Mata Ahu-3 3rd party hunga tuatoru 4-chlorobutanoic acid waikawa p ūwaro 4-pūhaum āota 4-methylpent-2-ene 4-waiwaro-rua-2-pēwaro mewaro 4-methylpent-2-yne 4-waiwaro-toru-2-pēwaro mewaro 50-50 chance 50-50 te t ūponotanga abandon, to leave behind whakar ērea abandoned (land) whenua mahue abdominal pain ngau o te puku, k ōpito ability āheinga ability pūmanawa aborigine tangata whenua o Ahitereiria abort haukoti abortion kuka, tahe, whakatahe abound, multiply makuru about mō about 2.4 metres high kei te āhua 2.4 mita te teitei about face tahuri k ē above sea level mai i te mata o te moana abrasive (of character), quick to anger pūtiotio absolute mārika absolute pūrawa absolute desire for one another tara koukoua Absolute Magnitude -

Project Report of the CCOP-GSJ,AIST-NAWAPI
GW-6 Geological Survey of Japan, AIST Project Report of the CCOP-GSJ/AIST-NAWAPI Groundwater Phase III Meeting 16-18 March 2016, Hanoi, Vietnam COORDINATING COMMITTEE FOR GEOSCIENCE PROGRAMMES IN EAST AND SOUTHEAST ASIA (CCOP) In cooperation with GEOLOGICAL SURVEY OF JAPAN (GSJ), AIST Published by CCOP Technical Secretariat Bangkok, Thailand Youhei Uchida (Chief Editor) PREFACE The CCOP-GSJ/AIST-NAWAPI Groundwater Project Phase III Meeting was held on 16-18 March 2016, in Hanoi, Vietnam. It was attended by nineteen participants from Cambodia, China, Indonesia, Japan, Republic of Korea, Lao PDR, Malaysia, Myanmar, Papua New Guinea, Philippines, Thailand, Vietnam and the CCOP Technical Secretariat. In the meeting, participants confirmed progress of the project from February 2015 to March 2016, and discussed work plan for 2016 by three group discussions. Each CCOP Member Country made a country presentation on the topic, “Recent Groundwater Issues and Their Action Study”. Since the current groundwater problem varies from one CCOP member country to another because of various hydrogeological and geographical settings, each Member Country should share the information for efficient groundwater management in the CCOP regions. This is the publication which was compiled each country report presented in the CCOP-GSJ/AIST-NAWAPI Groundwater Phase III Meeting. These reports have made clear the resent groundwater issues in each Member Country and cooperation policy of Phase III project, and will conduct outcome of the GW Phase III Project. I believe we will be able to have some solutions about not only groundwater management but also energy problem in the CCOP member countries. I am very grateful to the authors for their invaluable contributions and to the Organizations to which the authors belong for their permission to publish those important reports. -

Recent Advances in Avian Palaeobiology in New Zealand with Implications for Understanding New Zealand’S Geological, Climatic and Evolutionary Histories
New Zealand Journal of Zoology ISSN: 0301-4223 (Print) 1175-8821 (Online) Journal homepage: http://www.tandfonline.com/loi/tnzz20 Recent advances in avian palaeobiology in New Zealand with implications for understanding New Zealand’s geological, climatic and evolutionary histories Trevor H. Worthy, Vanesa L. De Pietri & R. Paul Scofield To cite this article: Trevor H. Worthy, Vanesa L. De Pietri & R. Paul Scofield (2017) Recent advances in avian palaeobiology in New Zealand with implications for understanding New Zealand’s geological, climatic and evolutionary histories, New Zealand Journal of Zoology, 44:3, 177-211, DOI: 10.1080/03014223.2017.1307235 To link to this article: https://doi.org/10.1080/03014223.2017.1307235 View supplementary material Published online: 19 Apr 2017. Submit your article to this journal Article views: 239 View related articles View Crossmark data Citing articles: 2 View citing articles Full Terms & Conditions of access and use can be found at http://www.tandfonline.com/action/journalInformation?journalCode=tnzz20 NEW ZEALAND JOURNAL OF ZOOLOGY, 2017 VOL. 44, NO. 3, 177–211 https://doi.org/10.1080/03014223.2017.1307235 REVIEW ARTICLE Recent advances in avian palaeobiology in New Zealand with implications for understanding New Zealand’s geological, climatic and evolutionary histories Trevor H. Worthy a, Vanesa L. De Pietri b and R. Paul Scofield b aSchool of Biological Sciences, Flinders University of South Australia, GPO 2100, Adelaide 5001, South Australia; bNatural History Department, Canterbury Museum, Rolleston Avenue, Christchurch 8013, New Zealand ABSTRACT ARTICLE HISTORY New Zealand, long recognised as a land where birds dominate the Received 20 February 2017 terrestrial vertebrate biota, lacked an informative fossil record for Accepted 10 March 2017 the non-marine pre-Pleistocene avifauna until the twenty-first KEYWORDS century. -

Scientists Get First Full Look at Prehistoric New Zealand Penguin 27 February 2012
Scientists get first full look at prehistoric New Zealand penguin 27 February 2012 According to Ksepka, "The location was great for penguins in terms of both food and safety. Most of New Zealand was underwater at that time, leaving isolated, rocky land masses that kept the penguins safe from potential predators and provided them with a plentiful food supply." Kairuku was one of at least five different species of penguin that lived in New Zealand during the same period. The diversity of species is part of what made the reconstruction difficult, and the penguin's unique physique added to the difficulty. Two Kairuku penguins come ashore, passing a stranded "Kairuku was an elegant bird by penguin standards, Waipatia dolphin. Credit: Artwork by Chris Gaskin, owner with a slender body and long flippers, but short, and copyright owner: Geology Museum, University of thick legs and feet," says Ksepka. "If we had done Otago. Used with permission. a reconstruction by extrapolating from the length of its flippers, it would have stood over 6 feet tall. In reality, Kairuku was around 4-feet-2 inches tall or so." After 35 years, a giant fossil penguin has finally been completely reconstructed, giving researchers The researchers reconstructed Kairuku from two new insights into prehistoric penguin diversity. separate fossils, using the skeleton of an existing king penguin as a model. The result is a tall bird The bones were collected in 1977 by Dr. Ewan with an elongated beak and long flippers - easily Fordyce, a paleontologist from the University of the largest of the five species that were common to Otago, New Zealand. -

Press Release for Immediate Release Media Contact Karen Schwarz Interim Director of Marketing and Communications 203 413-6735 | [email protected]
Press Release For Immediate Release Media Contact Karen Schwarz Interim Director of Marketing and Communications 203 413-6735 | [email protected] Ever Dreamed of Seeing Your Face On A Coin? Local Bruce Museum Scientist Gets Pretty Close Dr. Daniel Ksepka, Curator of Science at the Bruce Museum, examines Kairuku fossils. Photograph by R.E. Fordyce. GREENWICH, CT, November 21, 2014 – Two extinct giant penguins that once roamed the wilds of New Zealand and were first described by Dr. Daniel Ksepka, Curator of Science at the Bruce Museum, have been selected for the 2014 New Zealand annual coin. Dr. Ksepka was the lead author of a scientific paper that first identified and described Kaiurku waitaki and Kairuku grebneffi, the penguin species featured on the coin. This research was inducted in collaboration with Dr. R. Ewan Fordyce, Professor at the University of Otago and Fellow of the Royal Society of New Zealand as well as Dr. Tatsuro Ando and Dr. Craig Jones. Fordyce discovered the holotype fossils of Kaiurku as part of his extensive fossil collecting for the University of Otago Geology Museum. In 2012, Ksepka and Fordyce collected new Kairuku fossils in the Kokoamu Greensand Formation of New Zeland’s South Island. “It’s not exactly the same as having your face on a coin, but I quite prefer a coin featuring ancient penguins,” says Dr. Ksepka, “It is a thrill to see these species being acknowledged as an important part of the world’s geological history.” Page 1 of 2 Press Release Kairuku appears on a New Zealand silver coin that is officially legal tender with a $5 face value. -

Bayesian Total-Evidence Dating Reveals the Recent Crown Radiation of Penguins
Version dated: June 25, 2018 RH: Bayesian total-evidence dating Bayesian total-evidence dating reveals the recent crown radiation of penguins Alexandra Gavryushkina1;2, Tracy A. Heath3, Daniel T. Ksepka4, Tanja Stadler5, David Welch1;2 and Alexei J. Drummond1;2 1Centre for Computational Evolution, University of Auckland, Auckland, New Zealand; 2Department of Computer Science, University of Auckland, Auckland, 1010, New Zealand; 3Department of Ecology, Evolution, & Organismal Biology, Iowa State University, Ames, IA, 50011, USA; 4Bruce Museum, Greenwich, CT, 06830, USA; 5Department of Biosystems Science & Engineering, Eidgen¨ossischeTechnische Hochschule Z¨urich, 4058 Basel, Switzerland Corresponding authors: Alexandra Gavryushkina and Alexei Drummond, Centre for Computational Evolution, University of Auckland, Auckland, New Zealand; E-mail: [email protected], [email protected] arXiv:1506.04797v2 [q-bio.PE] 24 Jan 2017 Abstract.| The total-evidence approach to divergence-time dating uses molecular and morphological data from extant and fossil species to infer phylogenetic relationships, species divergence times, and macroevolutionary parameters in a single coherent framework. Current model-based implementations of this approach lack an appropriate model for the tree describing the diversification and fossilization process and can produce estimates that lead to erroneous conclusions. We address this shortcoming by providing a total-evidence method implemented in a Bayesian framework. This approach uses a mechanistic tree prior to describe the underlying diversification process that generated the tree of extant and fossil taxa. Previous attempts to apply the total-evidence approach have used tree priors that do not account for the possibility that fossil samples may be direct ancestors of other samples, that is, ancestors of fossil or extant species or of clades. -

Faculty of Arts 1972 Handbook
FACULTY OF ARTS 1972 HANDBOOK J 80 CENTS FACULTY OF ARTS 1972 HANDBOOK EIGHTY CENTS THE UNIVERSITY OF NEW SOUTH WALES P.O. Box 1, Kensington, N.S.W., 2033 Phone: 663 0351 The University of New South Wales Library has catalogued this work as follows:— UNIVERSITY OF NEW SOUTH WALES— 378.94405 Faculty of Arts NEW Handbook. Annual. Kensington. University of New South Wales— Faculty of Arts—Periodicals TABLE OF CONTENTS CALENDAR OF DATES A6 STAFF A8 COURSES AVAILABLE FOR DEGREE OF BACHELOR OF ARTS A18 DESCRIPTIONS OF SUBJECTS List of Identifying Numbers A26 Chiemistr\ A27 Drama A29 Economic Histor\ A35 Economics A3 8 English A44 French A49 General and Human Biolog\- and Biological Sciences A57 Geographx . A59 Geoscience A67 German A70 History A76 History and Philosophy of Science A90 Industrial Relations A96 Mathematics A98 Statistics AI07 Philosophy A112 Physics A126 Political Science A129 Psychology A138 Russian A149 Sociology A152 Spanish and Latin American Studies A184 REQUIREMENTS FOR ADMISSION BL Matriculation Requirements B1 A3 A4 THE UNIVERSITY OF NEW SOUTH WALES ADMISSION AND ENROLMENT PROCEDURE B7 Admissions Procedure B7 Admissions Office B7 Enrolment Procedure B7 University Union Card BIO UNDERGRADUATE COURSE FEES B11 Payment of Fees B13 RULES RELATING TO STUDENTS B16 General Conduct B16 Attendance at Classes B16 Indebtedness to the University B17 Changes in Course Programmes B17 Restriction upon StLidcnts Re-enrolling B18 Re-admission after Exclusion B21 Parking B21 Application of Rules B21 STUDENT SERVICES Library Services B23 The University Union . B23 Student Counselling and Research Unit B24 Financial Assistance to Students B24 Co-operative Bookshop B24 UNDERGRADUAIE SCHOLARSHIPS B25 STUDENT ACHVHTES B27 FACULIY INFORMATION B32 The Degree of Bachelor of Arts B32 Psychology Subjects B33 Programmes for the Degree of Bachelor of Arts . -

Download Full Article 1.5MB .Pdf File
Memoirs of Museum Victoria 69: 309–325 (2012) ISSN 1447-2546 (Print) 1447-2554 (On-line) http://museumvictoria.com.au/About/Books-and-Journals/Journals/Memoirs-of-Museum-Victoria A review of Australian fossil penguins (Aves: Sphenisciformes) TRAVIS PARK1 AND ERICH M.G. FITZgeRALD2 1 School of Life and Environmental Sciences, Deakin University, Vic. 3125, Australia and Geosciences, Museum Victoria, GPO Box 666, Melbourne, Vic. 3001, Australia ([email protected]) 2 Geosciences, Museum Victoria, GPO Box 666, Melbourne, Victoria 3001, Australia ([email protected]) Abstract Park, T. and Fitzgerald, E.M.G. 2012. A review of Australian fossil penguins (Aves: Sphenisciformes). Memoirs of Museum Victoria 69: 309–325. Australian fossil penguins (Sphenisciformes) are reviewed as a basis for future primary research. The five named species are based on type specimens of Eocene, Miocene—Pliocene and Holocene age collected from South Australia, Victoria and Tasmania. The phylogenetic affinities of these taxa remain unresolved. Only one type specimen is represented by clearly associated elements of a skeleton; the rest are single bones (isolated partial humeri and a pelvis). Further research is required to establish the taxonomic status of Pachydyptes simpsoni, Anthropodyptes gilli, Pseudaptenodyes macraei, ?Pseudaptenodytes minor and Tasidyptes hunteri. Additional described specimens include isolated postcranial elements from the Late Oligocene of South Australia and Late Miocene—Early Pliocene of Victoria. Other Miocene and Pliocene