The Physiological Response of Resident Macrophages to the Estrogen Surge
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

TOX2 Is Differentially Expressed in Non-Small Cell Lung Cancer-PDF 092220
1 Tox2 is differentially expressed in non-small cell lung cancer and associates with patient 2 survival. 3 Shahan Mamoor1 4 [email protected] East Islip, NY USA 5 6 Non-small cell lung cancer (NSCLC) is the leading cause of cancer death in the United States1. 7 We mined published microarray data2,3,4 to identify differentially expressed genes in NSCLC. 8 We found that the gene encoding the thymyocyte selection-associated high mobility box protein 9 family member 2 transcription factor Tox2 was among the genes whose expression was most quantitatively different in tumors from patients with NSCLC as compared to the lung. Tox2 10 expression was significantly decreased in NSCLC tumors as compared to the lung, and lower 11 expression of Tox2 in patient tumors was significantly associated with worse overall survival. Tox2 may be important for initiation or progression of non-small cell lung cancer in humans. 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 Keywords: Tox2, NSCLC, non-small cell lung cancer, systems biology of NSCLC, targeted 27 therapeutics in NSCLC. 28 1 OF 16 1 In 2016, lung cancer resulted in the death of 158,000 Americans; 81% of all patients 2 diagnosed with lung cancer will expire within 5 years5. Non-small cell lung cancer (NSCLC) is 3 4 the most common type of lung cancer, diagnosed in 84% of patients with lung cancer, and 76% 5 of all patients with NSCLC will expire within 5 years5. The rational development of targeted 6 therapeutics to treat patients with NSCLC can be supported by an enhanced understanding of 7 8 fundamental transcriptional features of NSCLC tumors. -

TOX As a Potential Target for Immunotherapy in Lymphocytic Malignancies Chaofeng Liang1,2, Shuxin Huang1, Yujie Zhao1, Shaohua Chen1* and Yangqiu Li1*
Liang et al. Biomarker Research (2021) 9:20 https://doi.org/10.1186/s40364-021-00275-y REVIEW Open Access TOX as a potential target for immunotherapy in lymphocytic malignancies Chaofeng Liang1,2, Shuxin Huang1, Yujie Zhao1, Shaohua Chen1* and Yangqiu Li1* Abstract TOX (thymocyte selection-associated HMG BOX) is a member of a family of transcriptional factors that contain the highly conserved high mobility group box (HMG-box) region. Increasing studies have shown that TOX is involved in maintaining tumors and promoting T cell exhaustion. In this review, we summarized the biological functions of TOX and its contribution as related to lymphocytic malignancies. We also discussed the potential role of TOX as an immune biomarker and target in immunotherapy for hematological malignancies. Keywords: Thymocyte selection-associated HMG BOX, Biological function, T cell exhaustion, Lymphocytic malignancies, Immune biomarker, Immunotherapy Background located on different chromosomes and have different TOX (thymocyte selection-associated HMG BOX), a functions (Fig. 1, Table 1)[16]. transcription factor, belongs to the high mobility group box (HMG-box) superfamily. In 2002, Wilkinson et al. TOX demonstrated for the first time that TOX plays an im- TOX, also known as KIAA0808, is located on q12.1 of portant role in the differentiation of CD4 + CD8+ human chromosome 8 and has one transcript. The double-positive thymocytes by gene microarray technol- length of the TOX mRNA is 4076 bp, and it contains ogy. Numerous studies have shown that TOX plays a nine exons that translate into a protein consisting of 526 vital role in the development and formation of various amino acids. -

Transcriptional Control of Tissue-Resident Memory T Cell Generation
Transcriptional control of tissue-resident memory T cell generation Filip Cvetkovski Submitted in partial fulfillment of the requirements for the degree of Doctor of Philosophy in the Graduate School of Arts and Sciences COLUMBIA UNIVERSITY 2019 © 2019 Filip Cvetkovski All rights reserved ABSTRACT Transcriptional control of tissue-resident memory T cell generation Filip Cvetkovski Tissue-resident memory T cells (TRM) are a non-circulating subset of memory that are maintained at sites of pathogen entry and mediate optimal protection against reinfection. Lung TRM can be generated in response to respiratory infection or vaccination, however, the molecular pathways involved in CD4+TRM establishment have not been defined. Here, we performed transcriptional profiling of influenza-specific lung CD4+TRM following influenza infection to identify pathways implicated in CD4+TRM generation and homeostasis. Lung CD4+TRM displayed a unique transcriptional profile distinct from spleen memory, including up-regulation of a gene network induced by the transcription factor IRF4, a known regulator of effector T cell differentiation. In addition, the gene expression profile of lung CD4+TRM was enriched in gene sets previously described in tissue-resident regulatory T cells. Up-regulation of immunomodulatory molecules such as CTLA-4, PD-1, and ICOS, suggested a potential regulatory role for CD4+TRM in tissues. Using loss-of-function genetic experiments in mice, we demonstrate that IRF4 is required for the generation of lung-localized pathogen-specific effector CD4+T cells during acute influenza infection. Influenza-specific IRF4−/− T cells failed to fully express CD44, and maintained high levels of CD62L compared to wild type, suggesting a defect in complete differentiation into lung-tropic effector T cells. -
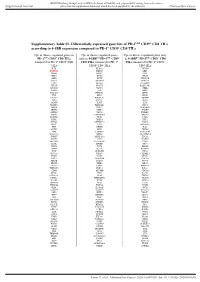
Supplementary Table S5. Differentially Expressed Gene Lists of PD-1High CD39+ CD8 Tils According to 4-1BB Expression Compared to PD-1+ CD39- CD8 Tils
BMJ Publishing Group Limited (BMJ) disclaims all liability and responsibility arising from any reliance Supplemental material placed on this supplemental material which has been supplied by the author(s) J Immunother Cancer Supplementary Table S5. Differentially expressed gene lists of PD-1high CD39+ CD8 TILs according to 4-1BB expression compared to PD-1+ CD39- CD8 TILs Up- or down- regulated genes in Up- or down- regulated genes Up- or down- regulated genes only PD-1high CD39+ CD8 TILs only in 4-1BBneg PD-1high CD39+ in 4-1BBpos PD-1high CD39+ CD8 compared to PD-1+ CD39- CD8 CD8 TILs compared to PD-1+ TILs compared to PD-1+ CD39- TILs CD39- CD8 TILs CD8 TILs IL7R KLRG1 TNFSF4 ENTPD1 DHRS3 LEF1 ITGA5 MKI67 PZP KLF3 RYR2 SIK1B ANK3 LYST PPP1R3B ETV1 ADAM28 H2AC13 CCR7 GFOD1 RASGRP2 ITGAX MAST4 RAD51AP1 MYO1E CLCF1 NEBL S1PR5 VCL MPP7 MS4A6A PHLDB1 GFPT2 TNF RPL3 SPRY4 VCAM1 B4GALT5 TIPARP TNS3 PDCD1 POLQ AKAP5 IL6ST LY9 PLXND1 PLEKHA1 NEU1 DGKH SPRY2 PLEKHG3 IKZF4 MTX3 PARK7 ATP8B4 SYT11 PTGER4 SORL1 RAB11FIP5 BRCA1 MAP4K3 NCR1 CCR4 S1PR1 PDE8A IFIT2 EPHA4 ARHGEF12 PAICS PELI2 LAT2 GPRASP1 TTN RPLP0 IL4I1 AUTS2 RPS3 CDCA3 NHS LONRF2 CDC42EP3 SLCO3A1 RRM2 ADAMTSL4 INPP5F ARHGAP31 ESCO2 ADRB2 CSF1 WDHD1 GOLIM4 CDK5RAP1 CD69 GLUL HJURP SHC4 GNLY TTC9 HELLS DPP4 IL23A PITPNC1 TOX ARHGEF9 EXO1 SLC4A4 CKAP4 CARMIL3 NHSL2 DZIP3 GINS1 FUT8 UBASH3B CDCA5 PDE7B SOGA1 CDC45 NR3C2 TRIB1 KIF14 TRAF5 LIMS1 PPP1R2C TNFRSF9 KLRC2 POLA1 CD80 ATP10D CDCA8 SETD7 IER2 PATL2 CCDC141 CD84 HSPA6 CYB561 MPHOSPH9 CLSPN KLRC1 PTMS SCML4 ZBTB10 CCL3 CA5B PIP5K1B WNT9A CCNH GEM IL18RAP GGH SARDH B3GNT7 C13orf46 SBF2 IKZF3 ZMAT1 TCF7 NECTIN1 H3C7 FOS PAG1 HECA SLC4A10 SLC35G2 PER1 P2RY1 NFKBIA WDR76 PLAUR KDM1A H1-5 TSHZ2 FAM102B HMMR GPR132 CCRL2 PARP8 A2M ST8SIA1 NUF2 IL5RA RBPMS UBE2T USP53 EEF1A1 PLAC8 LGR6 TMEM123 NEK2 SNAP47 PTGIS SH2B3 P2RY8 S100PBP PLEKHA7 CLNK CRIM1 MGAT5 YBX3 TP53INP1 DTL CFH FEZ1 MYB FRMD4B TSPAN5 STIL ITGA2 GOLGA6L10 MYBL2 AHI1 CAND2 GZMB RBPJ PELI1 HSPA1B KCNK5 GOLGA6L9 TICRR TPRG1 UBE2C AURKA Leem G, et al. -

TOX3 Is Expressed in Mammary ER+ Epithelial Cells and Regulates ER
Seksenyan et al. BMC Cancer (2015) 15:22 DOI 10.1186/s12885-015-1018-2 RESEARCH ARTICLE Open Access TOX3 is expressed in mammary ER+ epithelial cells and regulates ER target genes in luminal breast cancer Akop Seksenyan1, Asha Kadavallore1, Ann E Walts2, Brian de la Torre1, Dror Berel3,4, Samuel P Strom5,6, Parinaz Aliahmad1, Vincent A Funari5 and Jonathan Kaye1,3,7* Abstract Background: A breast cancer susceptibility locus has been mapped to the gene encoding TOX3. Little is known regarding the expression pattern or biological role of TOX3 in breast cancer or in the mammary gland. Here we analyzed TOX3 expression in murine and human mammary glands and in molecular subtypes of breast cancer, and assessed its ability to alter the biology of breast cancer cells. Methods: We used a cell sorting strategy, followed by quantitative real-time PCR, to study TOX3 gene expression in the mouse mammary gland. To study the expression of this nuclear protein in human mammary glands and breast tumors, we generated a rabbit monoclonal antibody specific for human TOX3. In vitro studies were performed on MCF7, BT474 and MDA-MB-231 cell lines to study the effects of TOX3 modulation on gene expression in the context of breast cancer cells. Results: We found TOX3 expression in estrogen receptor-positive mammary epithelial cells, including progenitor cells. A subset of breast tumors also highly expresses TOX3, with poor outcome associated with high expression of TOX3 in luminal B breast cancers. We also demonstrate the ability of TOX3 to alter gene expression in MCF7 luminal breast cancer cells, including cancer relevant genes TFF1 and CXCR4. -

TOX3 Is a Favorable Prognostic Indicator and Potential Immunomodulatory Factor in Lung Adenocarcinoma
4144 ONCOLOGY LETTERS 18: 4144-4152, 2019 TOX3 is a favorable prognostic indicator and potential immunomodulatory factor in lung adenocarcinoma DE ZENG1, HAOYU LIN2, JIANXIONG CUI2 and WEIQUAN LIANG2 1Department of Medical Oncology, Cancer Hospital of Shantou University Medical College; 2Department of Breast and Thyroid Surgery, The First Affiliated Hospital of Shantou University Medical College, Shantou, Guangdong 515000, P.R. China Received February 13, 2018; Accepted January 14, 2019 DOI: 10.3892/ol.2019.10748 Abstract. Thymocyte selection-associated high mobility and cytotoxic T lymphocyte-associated protein 4 (CTLA4), as group box (TOX) genes represent a novel family of genes. well as the development of novel immunotherapy agents, lung Deregulated expression of TOXs has been reported in a cancer treatments have improved notably in terms of disease variety of cancer types, including lung cancer. It has also control and survival outcomes (3). However, the success rate been reported that TOXs are crucial regulators of the immune of immunotherapy remains low, and a large number of cancer system. The present study systematically evaluated the prog- types, including lung cancer, remain largely insensitive or nostic values of TOX family members using a set of publicly refractory to PD-1, PD-L1 and CTLA4 blockade (2,4-6). accessible databases, including Oncomine, Kaplan-Meier Therefore, research has focused on identifying novel immu- plotter and cBioPortal. It was revealed that TOX expression notherapy targets or immunomodulatory factors that can profiles differed between lung cancer and normal tissues, be exploited to enhance the response to current immuno- and high expression of TOX mRNAs generally predicted therapeutic agents and address immunotherapy resistance in improved survival outcomes. -

University of Florida Thesis Or Dissertation Formatting
TRANSCRIPTIONAL AND EPIGENETIC PROFILING OF THE HIPPOCAMPUS AND THE MEDIAL PREFRONTAL CORTEX: RELATIONSHIP TO AGING AND COGNITIVE DECLINE By LARA IANOV A DISSERTATION PRESENTED TO THE GRADUATE SCHOOL OF THE UNIVERSITY OF FLORIDA IN PARTIAL FULFILLMENT OF THE REQUIREMENTS FOR THE DEGREE OF DOCTOR OF PHILOSOPHY UNIVERSITY OF FLORIDA 2017 © 2017 Lara Ianov To my spouse, Okie Ianov, and my dear friends Lana McMillan and Guido Pardi ACKNOWLEDGMENTS First, I would like to thank my mentor, Dr. Thomas C. Foster, for providing me the opportunity to work on an exciting area of research, along with his trust in my skills and his time and patience to mentor me. I would also like to acknowledge my committee members, Dr. Leonid Moroz, Dr. Jorg Bungert and Dr. Martha Campbell-Thompson for their guidance and suggestions in all committee meetings. In addition, Dr. Alberto Riva, deserves special recognition for his devoted support to me with a section of the data analysis shown in this dissertation. I would also like to thank Dr. Jennifer Bizon and Dr. B. Sofia Beas for their help with the set shifting task. Furthermore, I would also like to thank the past and present Genetics and Genomics program coordinators including Dr. Wilfred Vermerris who admitted me into the program, Dr. Jorg Bungert and Dr. Connie Mulligan, as past coordinators, and the current coordinators, Dr. Maurice Swanson and Dr. Doug Soltis. I would also like to thank Dr. Patrick Concannon, for his support to the program and the Genetics Institute. Finally, I would like to thank Hope Parmeter for signing me up for all classes each semester along with all student-related requirements. -

Interpretation of T Cell States from Single-Cell Transcriptomics Data Using Reference Atlases
ARTICLE https://doi.org/10.1038/s41467-021-23324-4 OPEN Interpretation of T cell states from single-cell transcriptomics data using reference atlases Massimo Andreatta 1,2, Jesus Corria-Osorio1, Sören Müller 3, Rafael Cubas4, George Coukos 1 & ✉ Santiago J. Carmona 1,2 Single-cell RNA sequencing (scRNA-seq) has revealed an unprecedented degree of immune cell diversity. However, consistent definition of cell subtypes and cell states across studies 1234567890():,; and diseases remains a major challenge. Here we generate reference T cell atlases for cancer and viral infection by multi-study integration, and develop ProjecTILs, an algorithm for reference atlas projection. In contrast to other methods, ProjecTILs allows not only accurate embedding of new scRNA-seq data into a reference without altering its structure, but also characterizing previously unknown cell states that “deviate” from the reference. ProjecTILs accurately predicts the effects of cell perturbations and identifies gene programs that are altered in different conditions and tissues. A meta-analysis of tumor-infiltrating T cells from several cohorts reveals a strong conservation of T cell subtypes between human and mouse, providing a consistent basis to describe T cell heterogeneity across studies, diseases, and species. 1 Department of Oncology, Lausanne Branch, Ludwig Institute for Cancer Research, CHUV and University of Lausanne, Lausanne, Epalinges, Switzerland. 2 Swiss Institute of Bioinformatics, Lausanne, Switzerland. 3 Department of Bioinformatics and Computational Biology, -

Review Article TOX Gene: a Novel Target for Human Cancer Gene Therapy
Am J Cancer Res 2015;5(12):3516-3524 www.ajcr.us /ISSN:2156-6976/ajcr0005402 Review Article TOX gene: a novel target for human cancer gene therapy Xin Yu1*, Zheng Li2* 1Department of Dermatology, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100042, China; 2Department of Orthopaedic Surgery, Peking Union Medical College Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing, China. *Equal contributors. Received December 31, 2014; Accepted June 26, 2015; Epub November 15, 2015; Published December 1, 2015 Abstract: Thymocyte selection-associated high mobility group box factor (TOX) is a member of an evolutionarily con- served DNA-binding protein family and is expressed in several immune-relevant cell subsets. TOX encodes a nuclear protein of the high-mobility group box superfamily. It contains a DNA-binding domain, which allows it to regulate tran- scription by modifying local chromatin structure and modulating the formation of multi-protein complexes. Previous studies have shown that TOX play important roles in immune system. More recently, several studies have described TOX expression is frequently upregulated in diverse types of human tumors and the overregulation often associates with tumor progression. Moreover, TOXis involved in the control of cell apoptosis, growth, metastasis, DNA repair and so on. In this review, we provide an overview of current knowledge concerning the role of TOX in tumor development and progression biology function. To our knowledge, this is the first review about the role of thisnew oncogene in tumor development and progression. Keywords: TOX, oncogene, cancer, proliferation, apoptosis Introduction and leukemia. -

Identification of Molecular Signatures Specific for Distinct Cranial Sensory
Patthey et al. Neural Development (2016) 11:3 DOI 10.1186/s13064-016-0057-y RESEARCHARTICLE Open Access Identification of molecular signatures specific for distinct cranial sensory ganglia in the developing chick Cedric Patthey2,4†, Harry Clifford1,3†, Wilfried Haerty1,3*, Chris P. Ponting1,3, Sebastian M. Shimeld2 and Jo Begbie1* Abstract Background: The cranial sensory ganglia represent populations of neurons with distinct functions, or sensory modalities. The production of individual ganglia from distinct neurogenic placodes with different developmental pathways provides a powerful model to investigate the acquisition of specific sensory modalities. To date there is a limited range of gene markers available to examine the molecular pathways underlying this process. Results: Transcriptional profiles were generated for populations of differentiated neurons purified from distinct cranial sensory ganglia using microdissection in embryonic chicken followed by FAC-sorting and RNAseq. Whole transcriptome analysis confirmed the division into somato- versus viscerosensory neurons, with additional evidence for subdivision of the somatic class into general and special somatosensory neurons. Cross-comparison of distinct ganglia transcriptomes identified a total of 134 markers, 113 of which are novel, which can be used to distinguish trigeminal, vestibulo-acoustic and epibranchial neuronal populations. In situ hybridisation analysis provided validation for 20/26 tested markers, and showed related expression in the target region of the hindbrain in many cases. Conclusions: One hundred thirty-four high-confidence markers have been identified for placode-derived cranial sensory ganglia which can now be used to address the acquisition of specific cranial sensory modalities. Keywords: Cranial sensory ganglia, Viscerosensory neuron, Somatosensory neuron, Cell type markers, Chicken, FACS, Expression profiling Background sensory neurons in the trunk, identifying specific subsets The sensory nervous system is fundamental to perception of somatosensory neurons [2, 3]. -

The Multifaceted Output of C-Jun Biological Activity: Focus at the Junction of CD8 T Cell Activation and Exhaustion
cells Review The Multifaceted Output of c-Jun Biological Activity: Focus at the Junction of CD8 T Cell Activation and Exhaustion Athanasios G. Papavassiliou 1 and Anna Maria Musti 2,* 1 Department of Biological Chemistry, Medical School, National and Kapodistrian University of Athens, 11527 Athens, Greece; [email protected] 2 Department of Pharmacy, Health and Nutritional Sciences, University of Calabria, 87036 Rende, Italy * Correspondence: [email protected]; Tel.: +39-3337543732 Received: 22 September 2020; Accepted: 11 November 2020; Published: 13 November 2020 Abstract: c-Jun is a major component of the dimeric transcription factor activator protein-1 (AP-1), a paradigm for transcriptional response to extracellular signaling, whose components are basic-Leucine Zipper (bZIP) transcription factors of the Jun, Fos, activating transcription factor (ATF), ATF-like (BATF) and Jun dimerization protein 2 (JDP2) gene families. Extracellular signals regulate c-Jun/AP-1 activity at multiple levels, including transcriptional and posttranscriptional regulation of c-Jun expression and transactivity, in turn, establishing the magnitude and the duration of c-Jun/AP-1 activation. Another important level of c-Jun/AP-1 regulation is due to the capability of Jun family members to bind DNA as a heterodimer with every other member of the AP-1 family, and to interact with other classes of transcription factors, thereby acquiring the potential to integrate diverse extrinsic and intrinsic signals into combinatorial regulation of gene expression. Here, we review how these features of c-Jun/AP-1 regulation underlie the multifaceted output of c-Jun biological activity, eliciting quite distinct cellular responses, such as neoplastic transformation, differentiation and apoptosis, in different cell types. -

T-Follicular Regulatory Cells Localizes in the Germinal Centers
− PNAS PLUS A distinct subpopulation of CD25 T-follicular regulatory cells localizes in the germinal centers James Badger Winga, Yohko Kitagawaa, Michela Loccib, Hannah Humea, Christopher Taya, Takayoshi Moritaa, Yujiro Kidania, Kyoko Matsudac, Takeshi Inoued, Tomohiro Kurosakid,e, Shane Crottyb, Cevayir Cobanc, Naganari Ohkuraa, and Shimon Sakaguchia,f,1 aLaboratory of Experimental Immunology, WPI Immunology Frontier Research Center (IFReC), Osaka University, Suita 565-0871, Japan; bDivision of Vaccine Discovery, La Jolla Institute for Allergy and Immunology, La Jolla, CA 92037; cMalaria Immunology, IFReC, Osaka University, Suita 565-0871, Japan; dLymphocyte Differentiation, IFReC, Osaka University, Suita 565-0871, Japan; eLaboratory of Lymphocyte Differentiation, RIKEN Center for Integrative Medical Sciences, Yokohama, Kanagawa 230-0045, Japan; and fDepartment of Experimental Pathology, Institute for Frontier Medical Sciences, Kyoto University, Kyoto 606-8507, Japan Contributed by Shimon Sakaguchi, June 7, 2017 (sent for review April 11, 2017; reviewed by Luis Graca and Shohei Hori) T-follicular helper (Tfh) cells differentiate through a multistep cells are directly inhibited by IL-2/STAT5–driven induction of process, culminating in germinal center (GC) localized GC-Tfh cells BLIMP-1 expression (14, 15). In addition, Tfr cells themselves have that provide support to GC-B cells. T-follicular regulatory (Tfr) cells been described to express BLIMP-1, but its deletion causes their have critical roles in the control of Tfh cells and GC formation. expansion, suggesting that BLIMP-1 acts to inhibit their formation Although Tfh-cell differentiation is inhibited by IL-2, regulatory T (10), whereas loss of BCL6 results in increased expression of (Treg) cell differentiation and survival depend on it.