Caractérisation Par CPG/IK, CPG/SM Et RMN Du Carbone-13 D'huiles
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Cally Plant List a ACIPHYLLA Horrida
Cally Plant List A ACIPHYLLA horrida ACONITUM albo-violaceum albiflorum ABELIOPHYLLUM distichum ACONITUM cultivar ABUTILON vitifolium ‘Album’ ACONITUM pubiceps ‘Blue Form’ ACAENA magellanica ACONITUM pubiceps ‘White Form’ ACAENA species ACONITUM ‘Spark’s Variety’ ACAENA microphylla ‘Kupferteppich’ ACONITUM cammarum ‘Bicolor’ ACANTHUS mollis Latifolius ACONITUM cammarum ‘Franz Marc’ ACANTHUS spinosus Spinosissimus ACONITUM lycoctonum vulparia ACANTHUS ‘Summer Beauty’ ACONITUM variegatum ACANTHUS dioscoridis perringii ACONITUM alboviolaceum ACANTHUS dioscoridis ACONITUM lycoctonum neapolitanum ACANTHUS spinosus ACONITUM paniculatum ACANTHUS hungaricus ACONITUM species ex. China (Ron 291) ACANTHUS mollis ‘Long Spike’ ACONITUM japonicum ACANTHUS mollis free-flowering ACONITUM species Ex. Japan ACANTHUS mollis ‘Turkish Form’ ACONITUM episcopale ACANTHUS mollis ‘Hollard’s Gold’ ACONITUM ex. Russia ACANTHUS syriacus ACONITUM carmichaelii ‘Spätlese’ ACER japonicum ‘Aconitifolium’ ACONITUM yezoense ACER palmatum ‘Filigree’ ACONITUM carmichaelii ‘Barker’s Variety’ ACHILLEA grandifolia ACONITUM ‘Newry Blue’ ACHILLEA ptarmica ‘Perry’s White’ ACONITUM napellus ‘Bergfürst’ ACHILLEA clypeolata ACONITUM unciniatum ACIPHYLLA monroi ACONITUM napellus ‘Blue Valley’ ACIPHYLLA squarrosa ACONITUM lycoctonum ‘Russian Yellow’ ACIPHYLLA subflabellata ACONITUM japonicum subcuneatum ACONITUM meta-japonicum ADENOPHORA aurita ACONITUM napellus ‘Carneum’ ADIANTUM aleuticum ‘Japonicum’ ACONITUM arcuatum B&SWJ 774 ADIANTUM aleuticum ‘Miss Sharples’ ACORUS calamus ‘Argenteostriatus’ -

(Ou Immortelles) En Aromathérapie: Zoom Sur L'hélichryse Italienne Corse
Les hélichryses (ou immortelles) en aromathérapie : zoom sur l’Hélichryse italienne corse Margaux Degrelle To cite this version: Margaux Degrelle. Les hélichryses (ou immortelles) en aromathérapie : zoom sur l’Hélichryse italienne corse. Sciences pharmaceutiques. 2015. hal-01731734 HAL Id: hal-01731734 https://hal.univ-lorraine.fr/hal-01731734 Submitted on 14 Mar 2018 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. AVERTISSEMENT Ce document est le fruit d'un long travail approuvé par le jury de soutenance et mis à disposition de l'ensemble de la communauté universitaire élargie. Il est soumis à la propriété intellectuelle de l'auteur. Ceci implique une obligation de citation et de référencement lors de l’utilisation de ce document. D'autre part, toute contrefaçon, plagiat, reproduction illicite encourt une poursuite pénale. Contact : [email protected] LIENS Code de la Propriété Intellectuelle. articles L 122. 4 Code de la Propriété Intellectuelle. articles L 335.2- L 335.10 http://www.cfcopies.com/V2/leg/leg_droi.php http://www.culture.gouv.fr/culture/infos-pratiques/droits/protection.htm -

Volatilome Analyses and in Vitro Antimicrobial Activity of the Essential Oils from Five South African Helichrysum Species
molecules Article Volatilome Analyses and In Vitro Antimicrobial Activity of the Essential Oils from Five South African Helichrysum Species Basma Najar 1,* , Valeria Nardi 1, Claudio Cervelli 2, Giulia Mecacci 1, Francesca Mancianti 3,4 , Valentina Virginia Ebani 3,4, Simona Nardoni 3 and Luisa Pistelli 1,4 1 Dipartimento di Farmacia, Università di Pisa, Via Bonanno 6, 56126 Pisa, Italy; [email protected] (V.N.); [email protected] (G.M.); [email protected] (L.P.) 2 CREA-Centro di Ricerca Orticoltura e Florovivaismo, Corso Inglesi 508, 18038 Sanremo, Italy; [email protected] 3 Dipartimento di Scienze Veterinarie, Università di Pisa, Viale delle Piagge 2, 56124 Pisa, Italy; [email protected] (F.M.); [email protected] (V.V.E.); [email protected] (S.N.) 4 Centro Interdipartimentale di Ricerca Nutraceutica e Alimentazione per la Salute “Nutrafood”, Università di Pisa, Via del Borgetto 80, 56124 Pisa, Italy * Correspondence: [email protected] Academic Editors: Francesca Mancianti and Valentina Virginia Ebani Received: 22 June 2020; Accepted: 10 July 2020; Published: 13 July 2020 Abstract: Helichrysum genus was used in folk South African medicine to treat various human disorders. As a part of our on-going research addressing the exploitation of South African plants belonging to this genus, five species were investigated for their volatile and antimicrobial activities. The volatile organic compounds (VOCs) and the essential oils (EOs) were analysed by gas chromatography mass spectrometry (GC-MS). Microdilution was the method used for assessing both antimycotic and antibacterial activities, which was also tested by Kirby-Bauer agar disc diffusion. -
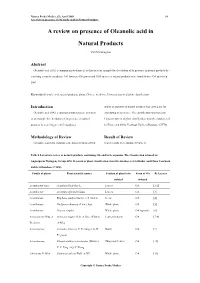
A Review on Presence of Oleanolic Acid in Natural Products
Natura Proda Medica, (2), April 2009 64 A review on presence of Oleanolic acid in Natural Products A review on presence of Oleanolic acid in Natural Products YEUNG Ming Fai Abstract Oleanolic acid (OA), a common phytochemical, is chosen as an example for elucidation of its presence in natural products by searching scientific databases. 146 families, 698 genera and 1620 species of natural products were found to have OA up to Sep 2007. Keywords Oleanolic acid, natural products, plants, Chinese medicine, Linnaeus system of plant classification Introduction and/or its saponins in natural products was carried out for Oleanolic acid (OA), a common phytochemical, is chosen elucidating its pressence. The classification was based on as an example for elucidation of its presence in natural Linnaeus system of plant classification from the databases of products by searching scientific databases. SciFinder and China Yearbook Full-text Database (CJFD). Methodology of Review Result of Review Literature search for isolation and characterization of OA Search results were tabulated (Table 1). Table 1 Literature review of natural products containing OA and/or its saponins. The classification is based on Angiosperm Phylogeny Group APG II system of plant classification from the databases of SciFinder and China Yearbook Full-text Database (CJFD). Family of plants Plant scientific names Position of plant to be Form of OA References isolated isolated Acanthaceae Juss. Acanthus illicifolius L. Leaves OA [1-2] Acanthaceae Avicennia officinalis Linn. Leaves OA [3] Acanthaceae Blepharis sindica Stocks ex T. Anders Seeds OA [4] Acanthaceae Dicliptera chinensis (Linn.) Juss. Whole plant OA [5] Acanthaceae Justicia simplex Whole plant OA saponins [6] Actinidiaceae Gilg. -

Species Accounts
Species accounts The list of species that follows is a synthesis of all the botanical knowledge currently available on the Nyika Plateau flora. It does not claim to be the final word in taxonomic opinion for every plant group, but will provide a sound basis for future work by botanists, phytogeographers, and reserve managers. It should also serve as a comprehensive plant guide for interested visitors to the two Nyika National Parks. By far the largest body of information was obtained from the following nine publications: • Flora zambesiaca (current ed. G. Pope, 1960 to present) • Flora of Tropical East Africa (current ed. H. Beentje, 1952 to present) • Plants collected by the Vernay Nyasaland Expedition of 1946 (Brenan & collaborators 1953, 1954) • Wye College 1972 Malawi Project Final Report (Brummitt 1973) • Resource inventory and management plan for the Nyika National Park (Mill 1979) • The forest vegetation of the Nyika Plateau: ecological and phenological studies (Dowsett-Lemaire 1985) • Biosearch Nyika Expedition 1997 report (Patel 1999) • Biosearch Nyika Expedition 2001 report (Patel & Overton 2002) • Evergreen forest flora of Malawi (White, Dowsett-Lemaire & Chapman 2001) We also consulted numerous papers dealing with specific families or genera and, finally, included the collections made during the SABONET Nyika Expedition. In addition, botanists from K and PRE provided valuable input in particular plant groups. Much of the descriptive material is taken directly from one or more of the works listed above, including information regarding habitat and distribution. A single illustration accompanies each genus; two illustrations are sometimes included in large genera with a wide morphological variance (for example, Lobelia). -

Listado De Todas Las Plantas Que Tengo Fotografiadas Ordenado Por Familias Según El Sistema APG III (Última Actualización: 2 De Septiembre De 2021)
Listado de todas las plantas que tengo fotografiadas ordenado por familias según el sistema APG III (última actualización: 2 de Septiembre de 2021) GÉNERO Y ESPECIE FAMILIA SUBFAMILIA GÉNERO Y ESPECIE FAMILIA SUBFAMILIA Acanthus hungaricus Acanthaceae Acanthoideae Metarungia longistrobus Acanthaceae Acanthoideae Acanthus mollis Acanthaceae Acanthoideae Odontonema callistachyum Acanthaceae Acanthoideae Acanthus spinosus Acanthaceae Acanthoideae Odontonema cuspidatum Acanthaceae Acanthoideae Aphelandra flava Acanthaceae Acanthoideae Odontonema tubaeforme Acanthaceae Acanthoideae Aphelandra sinclairiana Acanthaceae Acanthoideae Pachystachys lutea Acanthaceae Acanthoideae Aphelandra squarrosa Acanthaceae Acanthoideae Pachystachys spicata Acanthaceae Acanthoideae Asystasia gangetica Acanthaceae Acanthoideae Peristrophe speciosa Acanthaceae Acanthoideae Barleria cristata Acanthaceae Acanthoideae Phaulopsis pulchella Acanthaceae Acanthoideae Barleria obtusa Acanthaceae Acanthoideae Pseuderanthemum carruthersii ‘Rubrum’ Acanthaceae Acanthoideae Barleria repens Acanthaceae Acanthoideae Pseuderanthemum carruthersii var. atropurpureum Acanthaceae Acanthoideae Brillantaisia lamium Acanthaceae Acanthoideae Pseuderanthemum carruthersii var. reticulatum Acanthaceae Acanthoideae Brillantaisia owariensis Acanthaceae Acanthoideae Pseuderanthemum laxiflorum Acanthaceae Acanthoideae Brillantaisia ulugurica Acanthaceae Acanthoideae Pseuderanthemum laxiflorum ‘Purple Dazzler’ Acanthaceae Acanthoideae Crossandra infundibuliformis Acanthaceae Acanthoideae Ruellia -

Rock Garden Quarterly
ROCK GARDEN QUARTERLY VOLUME 53 NUMBER 1 WINTER 1995 COVER: Aquilegia scopulorum with vespid wasp by Cindy Nelson-Nold of Lakewood, Colorado All Material Copyright © 1995 North American Rock Garden Society ROCK GARDEN QUARTERLY BULLETIN OF THE NORTH AMERICAN ROCK GARDEN SOCIETY formerly Bulletin of the American Rock Garden Society VOLUME 53 NUMBER 1 WINTER 1995 FEATURES Alpine Gesneriads of Europe, by Darrell Trout 3 Cassiopes and Phyllodoces, by Arthur Dome 17 Plants of Mt. Hutt, a New Zealand Preview, by Ethel Doyle 29 South Africa: Part II, by Panayoti Kelaidis 33 South African Sampler: A Dozen Gems for the Rock Garden, by Panayoti Kelaidis 54 The Vole Story, by Helen Sykes 59 DEPARTMENTS Plant Portrait 62 Books 65 Ramonda nathaliae 2 ROCK GARDEN QUARTERLY VOL. 53:1 ALPINE GESNERIADS OF EUROPE by Darrell Trout J. he Gesneriaceae, or gesneriad Institution and others brings the total family, is a diverse family of mostly Gesneriaceae of China to a count of 56 tropical and subtropical plants with genera and about 413 species. These distribution throughout the world, should provide new horticultural including the north and south temper• material for the rock garden and ate and tropical zones. The 125 genera, alpine house. Yet the choicest plants 2850-plus species include terrestrial for the rock garden or alpine house and epiphytic herbs, shrubs, vines remain the European genera Ramonda, and, rarely, small trees. Botanically, Jancaea, and Haberlea. and in appearance, it is not always easy to separate the family History Gesneriaceae from the closely related The family was named for Konrad Scrophulariaceae (Verbascum, Digitalis, von Gesner, a sixteenth century natu• Calceolaria), the Orobanchaceae, and ralist. -

Chemical Variations, Trichome Structure and Antifungal Activities of Essential Oils of Helichrysum Splendidum from South Africa
South African Journal of Botany 96 (2015) 78–84 Contents lists available at ScienceDirect South African Journal of Botany journal homepage: www.elsevier.com/locate/sajb Chemical variations, trichome structure and antifungal activities of essential oils of Helichrysum splendidum from South Africa M. Mashigo a,⁎,S.Combrincka,T.Regnierb,W.DuPlooyc,W.Augustyna,N.Mokgalakaa a Department of Chemistry, Tshwane University of Technology, PO Box 56208, Arcadia, Pretoria 0001, South Africa b Department of Biotechnology and Food Technology, Tshwane University of Technology, PO Box 56208, Arcadia, Pretoria 0001, South Africa c 25 Kaptein Jan Street, Rietondale 0084, South Africa article info abstract Article history: The chemical profiles of essential oils isolated from nine populations of Helichrysum splendidum were obtained by Received 23 June 2014 gas chromatography. Plants were harvested in both summer and winter seasons in two provinces of South Africa. Received in revised form 15 October 2014 Essential oils originating from Limpopo Province were characterized by high levels of β-phellandrene, 1,8-cineole, Accepted 24 October 2014 δ-cadinene, α-cadinol, τ-cadinol, and β-pinene. These could be clearly distinguished through multivariate analysis Available online xxxx from those collected in Mpumalanga Province. The Mpumalanga oils contained germacrene D, spathulenol and bicyclogermacrene as major constituents. Seasonal variations in the volatile compositions and yields were observed. Keywords: Helichrysum splendidum A prediction model obtained through orthogonal projection to latent structures discriminant analysis was used to Essential oils compare the essential oil profiles to that of a commercial H. splendidum sample, in addition to those reported for Trichomes Zimbabwean specimens. One of the specimens from Zimbabwe differed substantially from all the others, indicating Chemometric analysis the existence of more chemotypes. -
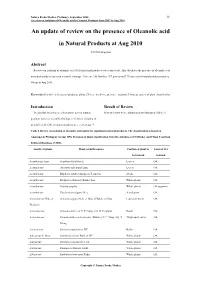
An Update of Review on the Presence of Oleanolic Acid in Natural Products at Aug 2010
Natura Proda Medica, Prelimary, September 2010 11 A review on isolation of Oleanolic acid in Natural Products from 2007 to Aug 2010 An update of review on the presence of Oleanolic acid in Natural Products at Aug 2010 YEUNG Ming Fai Abstract Reviews on isolation of oleanolic acid (OA) in natural products were carried out. This elucidates the presence of oleanolic acid in natural products based on scientific findings. There are 158 families, 767 genera and 1710 species of natural products isolated OA up to Aug 2010. Keywords Oleanolic acid, natural products, plants, Chinese medicine, presence, isolation, Linnaeus system of plant classification Introduction Result of Review To elucidate the presence of oleanolic acid in natural Review results were collaborated and tabulated (Table 1). products based on scientific findings, reviews on isolation of oleanolic acid (OA) in natural products were carried out 1-2. Table 1 Review on isolation of oleanolic acid and/or its saponins in natural products. The classification is based on Angiosperm Phylogeny Group APG II system of plant classification from the databases of SciFinder and China Yearbook Full-text Database (CJFD). Family of plants Plant scientific names Position of plant to Form of OA be isolated isolated Acanthaceae Juss. Acanthus illicifolius L. Leaves OA Acanthaceae Avicennia officinalis Linn. Leaves OA Acanthaceae Blepharis sindica Stocks ex T. Anders Seeds OA Acanthaceae Dicliptera chinensis (Linn.) Juss. Whole plants OA Acanthaceae Justicia simplex Wholeplants OAsaponins Acanthaceae Gendarussa vulgaris Nees Aerial parts OA Actinidiaceae Gilg. et Actinidia arguta (Sieb. et Zucc.) Planch. ex Miq. Leaves or stems OA Werderm. Actinidiaceae Actinidia deliciosa C. -

Floristic Composition and Structure of the Dry Afromontane Forest at Bale Mountains National Park, Ethiopia
SINET : Ethiop. J. Sci ., 31(2):103–120, 2008 © Faculty of Science, Addis Ababa University, 2008 ISSN: 0379–2897 FLORISTIC COMPOSITION AND STRUCTURE OF THE DRY AFROMONTANE FOREST AT BALE MOUNTAINS NATIONAL PARK, ETHIOPIA Haile Yineger 1 , Ensermu Kelbessa 2 , Tamrat Bekele 2 and Ermias Lulekal 3 1 Department of Biology, Jimma University, PO Box 5195, Jimma, Ethiopia E-mail: [email protected] or [email protected] 2 National Herbarium, Department of Biology, Faculty of Science, Addis Ababa University PO Box 3434, Addis Ababa, Ethiopia 3 Department of Biology, Debre Berhan University, PO Box 445, Debre Berhan, Ethiopia ABSTRACT : The floristic composition and structure of the Dry Afromontane Forest at Bale Mountains National Park was studied from July 2003 to June 2004. A total of 90 plots were established at three sites (Adelle, Boditi and Gaysay) at an altitudinal range of 3010–3410 m. The cover abundance values, density, and diameter at breast height and list of species were recorded in each plot. About 230 species belonging to 157 genera and 58 families were identified and documented. Analysis of vegetation data revealed 5 homogenous clusters. The densities of trees in the diameter class >2 cm were 766 and 458 individuals ha -1in Adelle and Boditi forests, respectively. The basal areas were about 26 and 23 m 2ha -1 in Adelle and Boditi forests, respectively. About 43% of the basal area in Adelle and 57 in Boditi forests were contributed by Juniperus procera and Hagenia abyssinica , respectively. Both Adelle and Boditi forests were found at an earlier secondary stage of development and had, more or less, a similar trend of development. -

Aloes and Lilies of Ethiopia and Eritrea
Aloes and Lilies of Ethiopia and Eritrea Sebsebe Demissew Inger Nordal Aloes and Lilies of Ethiopia and Eritrea Sebsebe Demissew Inger Nordal <PUBLISHER> <COLOPHON PAGE> Front cover: Aloe steudneri Back cover: Kniphofia foliosa Contents Preface 4 Acknowledgements 5 Introduction 7 Key to the families 40 Aloaceae 42 Asphodelaceae 110 Anthericaceae 127 Amaryllidaceae 162 Hyacinthaceae 183 Alliaceae 206 Colchicaceae 210 Iridaceae 223 Hypoxidaceae 260 Eriospermaceae 271 Dracaenaceae 274 Asparagaceae 289 Dioscoreaceae 305 Taccaceae 319 Smilacaceae 321 Velloziaceae 325 List of botanical terms 330 Literature 334 4 ALOES AND LILIES OF ETHIOPIA Preface The publication of a modern Flora of Ethiopia and Eritrea is now completed. One of the major achievements of the Flora is having a complete account of all the Mono cotyledons. These are found in Volumes 6 (1997 – all monocots except the grasses) and 7 (1995 – the grasses) of the Flora. One of the main aims of publishing the Flora of Ethiopia and Eritrea was to stimulate further research in the region. This challenge was taken by the authors (with important input also from Odd E. Stabbetorp) in 2003 when the first edition of ‘Flowers of Ethiopia and Eritrea: Aloes and other Lilies’ was published (a book now out of print). The project was supported through the NUFU (Norwegian Council for Higher Education’s Programme for Development Research and Education) funded Project of the University of Oslo, Department of Biology, and Addis Ababa University, National Herbarium in the Biology Department. What you have at hand is a second updated version of ‘Flowers of Ethiopia and Eritrea: Aloes and other Lilies’. -

Holzanatomischer Merkmalskatalog
Holzanatomischer Merkmalskatalog Fortsetzung Polygalaceae Securidaca longipedunculata Fresen. Zuwachsgrenzen mäßig deutlich, markiert nur durch den geringeren tangentialen Durchmesser der Fasern im Spätholz. Gefäße groß (mittlerer tangentialer Durchmesser: 110.7µm, Standardabweichung: 39,0µm, range: 44-165µm), überwiegend einzeln, seltener gepaart oder in kleinen Nestern, in geringer Dichte (5-20/mm2). Gummiartige Inhaltsstoffe in den Kernholzgefäßen. Durchbrechungen ausschließlich einfach, Gefäßtüpfel wechselständig, tangentialer Durchmesser 4-7µm. Kreuzungsfeldtüpfel deutlich behöft, ähnlich den Gefäßtüpfeln. Fasern mittelwandig, unseptiert, mit deutlich behöften Tüpfeln auf Radial- und Tangentialwänden. Axialparenchym paratracheal spärlich, vasizentrisch, gelegentlich aliform-konfluent und apotracheal diffus, in drei- bis vierzelligen Strängen. Strahlen ein- bis dreireihig, heterozellulär aus liegenden Zellen mit mehr als vier Reihen aufrechter/quadratischer Zellen am Rand oder heterozellulär durchmischt. 8 bis 12 Strahlen pro mm, häufig um 200 bis 400µm hoch, maximale Strahlhöhe 800µm. Eingeschlossenes Phloem vorhanden, in weit auseinander stehenden konzentrischen Lagen. Prismatische Kristalle vorhanden, in aufrechten/quadratischen Holzstrahlzellen (dort gelegentlich zwei Kristalle pro Zelle) und ungekammertem Axialparenchym sowie im unlignifizierten Überbrückungsparenchym. Portulacaceae Ceraria longipedunculata Merxm. & Podlech Beschreibung Zuwachsgrenzen undeutlich oder fehlend. Gefäße mittelgroß (mittlerer tangentialer Durchmesser: