Appendices: V Ervolgonderzoek Medicatieveiligheid
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Faldaprevir, Pegylated Interferon, and Ribavirin for Treatment-Naïve HCV Genotype-1: Pooled Analysis of Two Phase 3 Trials
Faldaprevir, pegylated interferon and ribavirin. , 2016; 15 (3): 333-349 333 ORIGINAL ARTICLE May-June, Vol. 15 No. 3, 2016: 333-349 The Official Journal of the Mexican Association of Hepatology, the Latin-American Association for Study of the Liver and the Canadian Association for the Study of the Liver Faldaprevir, pegylated interferon, and ribavirin for treatment-naïve HCV genotype-1: pooled analysis of two phase 3 trials Donald M. Jensen,1 Tarik Asselah,2 Douglas Dieterich,3 Graham R. Foster,4 Mark S. Sulkowski,5 Stefan Zeuzem,6 Parvez Mantry,7 Eric M. Yoshida,8 Christophe Moreno,9 Denis Ouzan,10 Mark Wright,11 Luis E. Morano,12 Robert Buynak,13 Marc Bourlière,14 Tarek Hassanein,15 Shuhei Nishiguchi,16 Jia-Horng Kao,17 Masao Omata,18 Seung W. Paik,19 David K. Wong,20 Edward Tam,21 Kelly Kaita,22 S. Victor Feinman,23 Jerry O. Stern,24 Joseph Scherer,24 Anne-Marie Quinson,24 Florian Voss,25 John-Paul Gallivan,25 Wulf O. Böcher,25 Peter Ferenci26 1 University of Chicago Medicine, Chicago, IL, USA. 2 Hôpital Beaujon, APHP, University Paris-Diderot and INSERM CRB3, Clichy, France. 3 Icahn School of Medicine at Mount Sinai, New York, NY, USA. 4 Queen Mary University of London, London, UK. 5 Johns Hopkins University School of Medicine, Baltimore, MD, USA. 6 J.W.Goethe University Hospital, Frankfurt, Germany. 7 The Liver Institute at Methodist Dallas Medical Center, Dallas, TX, USA. 8 University of British Columbia, Vancouver, BC, Canada. 9 CUB Hôpital Erasme, Université Libre de Bruxelles, Brussels, Belgium. 10 Institut Arnault Tzanck, St. -

Development of Antiviral Agents for Enteroviruses
Journal of Antimicrobial Chemotherapy (2008) 62, 1169–1173 doi:10.1093/jac/dkn424 Advance Access publication 18 October 2008 Development of antiviral agents for enteroviruses Tzu-Chun Chen1–3, Kuo-Feng Weng1,2, Shih-Cheng Chang1,2, Jing-Yi Lin1,2, Peng-Nien Huang1,2 and Shin-Ru Shih1,2,4,5* 1Research Center for Emerging Viral Infections, Chang Gung University, Taoyuan, Taiwan; 2Department of Medical Biotechnology and Laboratory Science, Chang Gung University, Taoyuan, Taiwan; 3Institute Downloaded from https://academic.oup.com/jac/article/62/6/1169/774341 by guest on 26 September 2021 of Molecular Medicine, National Tsing Hua University, Hsinchu, Taiwan; 4Clinical Virology Laboratory, Chang Gung Memorial Hospital, Taoyuan, Taiwan; 5Division of Biotechnology and Pharmaceutical Research, National Health Research Institutes, Chunan, Taiwan Enteroviruses (EVs) are common human pathogens that are associated with numerous disease symptoms in many organ systems of the body. Although EV infections commonly cause mild or non- symptomatic illness, some of them are associated with severe diseases such as CNS complications. The current absence of effective vaccines for most viral infection and no available antiviral drugs for the treatment of EVs highlight the urgency and significance of developing antiviral agents. Several key steps in the viral life cycle are potential targets for blocking viral replication. This article reviews recent studies of antiviral developments for EVs based on various molecular targets that interrupt viral attach- ment, viral translation, polyprotein processing and RNA replication. Keywords: capsid proteins, viral proteases, viral RNA replication, 50 untranslated region Introduction EVs such as echovirus 6, 9 and 30 and CVB5 were the most common causes of aseptic meningitis in children.4 EV70 and Enteroviruses (EVs) are a common cause of infections in CVA24 were associated with acute haemorrhagic conjunctivitis.4 humans, especially children. -
(12) United States Patent (10) Patent No.: US 8,993,581 B2 Perrine Et Al
US00899.3581B2 (12) United States Patent (10) Patent No.: US 8,993,581 B2 Perrine et al. (45) Date of Patent: Mar. 31, 2015 (54) METHODS FOR TREATINGVIRAL (58) Field of Classification Search DSORDERS CPC ... A61K 31/00; A61K 31/166; A61K 31/185: A61K 31/233; A61K 31/522: A61K 38/12: (71) Applicant: Trustees of Boston University, Boston, A61K 38/15: A61K 45/06 MA (US) USPC ........... 514/263.38, 21.1, 557, 565, 575, 617; 424/2011 (72) Inventors: Susan Perrine, Weston, MA (US); Douglas Faller, Weston, MA (US) See application file for complete search history. (73) Assignee: Trustees of Boston University, Boston, (56) References Cited MA (US) U.S. PATENT DOCUMENTS (*) Notice: Subject to any disclaimer, the term of this 3,471,513 A 10, 1969 Chinn et al. patent is extended or adjusted under 35 3,904,612 A 9/1975 Nagasawa et al. U.S.C. 154(b) by 0 days. (Continued) (21) Appl. No.: 13/915,092 FOREIGN PATENT DOCUMENTS (22) Filed: Jun. 11, 2013 CA 1209037 A 8, 1986 CA 2303268 A1 4f1995 (65) Prior Publication Data (Continued) US 2014/OO45774 A1 Feb. 13, 2014 OTHER PUBLICATIONS Related U.S. Application Data (63) Continuation of application No. 12/890,042, filed on PCT/US 10/59584 Search Report and Written Opinion mailed Feb. Sep. 24, 2010, now abandoned. 11, 2011. (Continued) (60) Provisional application No. 61/245,529, filed on Sep. 24, 2009, provisional application No. 61/295,663, filed on Jan. 15, 2010. Primary Examiner — Savitha Rao (74) Attorney, Agent, or Firm — Nixon Peabody LLP (51) Int. -

Faldaprevir Combined with Peginterferon Alfa2a and Ribavirin In
Faldaprevir Combined With Peginterferon Alfa-2a and Ribavirin in Chronic Hepatitis C Virus Genotype-1 Patients With Prior Nonresponse: SILEN-C2 Trial Mark S. Sulkowski,1 Marc Bourlie`re,2 Jean-Pierre Bronowicki,3 Tarik Asselah,4 Jean-Michel Pawlotsky,5 Stephen D. Shafran,6 Stanislas Pol,7 Stefan Mauss,8 Dominique Larrey,9 Yakov Datsenko,10 Jerry O. Stern,11 George Kukolj,12 Joseph Scherer,11 Gerhard Nehmiz,10 Gerhard G. Steinmann,10 and Wulf O. B€ocher13 Faldaprevir (BI 201335) is a potent, hepatitis C virus (HCV) NS3/4A protease inhibitor. In all, 290 noncirrhotic HCV genotype (GT)-1 patients with prior null (<1log10 viral load [VL] drop at any time on treatment) or partial response (1log10 VL drop but never undetectable on treatment) were randomized 2:1:1 to receive 48 weeks of peginterferon alfa-2a and ribavirin (PegIFN/RBV) in combination with faldaprevir 240 mg once daily (QD) with 3 days PegIFN/RBV lead-in (LI), 240 mg QD without LI, or 240 mg twice daily (BID) with LI. Patients in the 240 mg QD/LI group achieving maintained rapid virologic response (mRVR; VL <25 IU/mL [Roche TaqMan] at week 4 and undetectable at weeks 8 to 20) were rerandomized to cease all treatment at week 24 or continue PegIFN/RBV up to week 48. Sustained virologic response (SVR) rates were 32%, 50%, and 42% in prior partial responders, and 21%, 35%, and 29% in prior null responders in the faldaprevir 240 mg QD/LI, 240 mg QD, and 240 mg BID/LI groups, respectively. -
Inclusion and Exclusion Criteria for Each Key Question
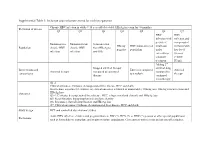
Supplemental Table 1: Inclusion and exclusion criteria for each key question Chronic HBV infection in adults ≥ 18 year old (detectable HBsAg in serum for >6 months) Definition of disease Q1 Q2 Q3 Q4 Q5 Q6 Q7 HBV HBV infection with infection and persistent compensated Immunoactive Immunotolerant Seroconverted HBeAg HBV mono-infected viral load cirrhosis with Population chronic HBV chronic HBV from HBeAg to negative population under low level infection infection anti-HBe entecavir or viremia tenofovir (<2000 treatment IU/ml) Adding 2nd Stopped antiviral therapy antiviral drug Interventions and Entecavir compared Antiviral Antiviral therapy compared to continued compared to comparisons to tenofovir therapy therapy continued monotherapy Q1-2: Clinical outcomes: Cirrhosis, decompensated liver disease, HCC and death Intermediate outcomes (if evidence on clinical outcomes is limited or unavailable): HBsAg loss, HBeAg seroconversion and Outcomes HBeAg loss Q3-4: Cirrhosis, decompensated liver disease, HCC, relapse (viral and clinical) and HBsAg loss Q5: Renal function, hypophosphatemia and bone density Q6: Resistance, flare/decompensation and HBeAg loss Q7: Clinical outcomes: Cirrhosis, decompensated liver disease, HCC and death Study design RCT and controlled observational studies Acute HBV infection, children and pregnant women, HIV (+), HCV (+) or HDV (+) persons or other special populations Exclusions such as hemodialysis, transplant, and treatment failure populations. Co treatment with steroids and uncontrolled studies. Supplemental Table 2: Detailed Search Strategy: Ovid Database(s): Embase 1988 to 2014 Week 37, Ovid MEDLINE(R) In-Process & Other Non- Indexed Citations and Ovid MEDLINE(R) 1946 to Present, EBM Reviews - Cochrane Central Register of Controlled Trials August 2014, EBM Reviews - Cochrane Database of Systematic Reviews 2005 to July 2014 Search Strategy: # Searches Results 1 exp Hepatitis B/dt 26410 ("hepatitis B" or "serum hepatitis" or "hippie hepatitis" or "injection hepatitis" or 2 178548 "hepatitis type B").mp. -

1 Annex I Annex I Summary of Product Characteristics
ANNEX I ANNEX I SUMMARY OF PRODUCT CHARACTERISTICS 1 1. NAME OF THE MEDICINAL PRODUCT VENVIA 1 mg film-coated tablets. 2. QUALITATIVE AND QUANTITATIVE COMPOSITION Each tablet contains rosiglitazone maleate corresponding to 1 mg rosiglitazone. For excipients see 6.1. 3. PHARMACEUTICAL FORM Film-coated tablets Yellow film-coated tablets marked "SB" on one side and "1" on the other. 4. CLINICAL PARTICULARS 4.1 Therapeutic indications Rosiglitazone is indicated only in oral combination treatment of type 2 diabetes mellitus in patients with insufficient glycaemic control despite maximal tolerated dose of oral monotherapy with either metformin or a sulphonylurea: − in combination with metformin only in obese patients. − in combination with a sulphonylurea only in patients who show intolerance to metformin or for whom metformin is contraindicated. 4.2 Posology and method of administration Treatment should only be initiated by a physician experienced in the treatment of type 2 diabetes. Experience from clinical trials with rosiglitazone is currently limited to 2 years. The long-term benefits of therapy with rosiglitazone have not been demonstrated (see section 5.1). Rosiglitazone therapy is usually initiated at 4 mg/day. Combination with Metformin This dose can be increased to 8 mg/day after 8 weeks if greater glycaemic control is required. Combination with sulphonylurea There is currently no experience with doses of rosiglitazone above 4 mg/day in combination with sulphonylureas. Rosiglitazone may be given once or twice a day. Rosiglitazone may be taken with or without food. Elderly No dose adjustment is required in the elderly. 2 Patients with renal impairment No dose adjustment is required in patients with mild and moderate renal insufficiency. -

The Evolution of Pleconaril: Modified O-Alkyl Linker Analogs Have
molecules Communication The Evolution of Pleconaril: Modified O-Alkyl Linker Analogs Have Biological Activity towards Coxsackievirus B3 Nancy 1, 2, 1 3 Alexandrina Volobueva y, Anna Egorova y, Anastasia Galochkina , Sean Ekins , Vladimir Zarubaev 1 and Vadim Makarov 2,* 1 Saint-Petersburg Pasteur Institute, Mira str., 14, 197101 Saint Petersburg, Russia; [email protected] (A.V.); [email protected] (A.G.); [email protected] (V.Z.) 2 Bach Institute of Biochemistry, Research Center of Biotechnology of the Russian Academy of Sciences, Leninsky prospect, 33, build. 2, 119071 Moscow, Russia; [email protected] 3 Collaborations Pharmaceuticals, Inc., 840 Main Campus Drive, Lab 3510, Raleigh, NC 27606, USA; [email protected] * Correspondence: [email protected] These authors contributed equally to this work. y Received: 10 February 2020; Accepted: 13 March 2020; Published: 16 March 2020 Abstract: Coxsackieviruses type B are one of the most common causes of mild upper respiratory and gastrointestinal illnesses. At the time of writing, there are no approved drugs for effective antiviral treatment for Coxsackieviruses type B. We used the core-structure of pleconaril, a well-known antienteroviral drug candidate, for the synthesis of novel compounds with O-propyl linker modifications. Some original compounds with 4 different linker patterns, such as sulfur atom, ester, amide, and piperazine, were synthesized according to five synthetic schemes. The cytotoxicity and bioactivity of 14 target compounds towards Coxsackievirus B3 Nancy were examined. Based on the results, the values of 50% cytotoxic dose (CC50), 50% virus-inhibiting dose (IC50), and selectivity index (SI) were calculated for each compound. Several of the novel synthesized derivatives exhibited a strong anti-CVB3 activity (SI > 20 to > 200). -

Subject Index
52_1107_1136_SI 16.11.2005 9:35 Uhr Seite 1107 Subject Index A – tape 264, 368, 940 α-adjustment 154 AAS, see atomic absorption spectrophotometry adrenocorticotrophic hormone (ACTH) 21 abietic acid 909, 943 adverse drug reaction 401 abrasion 174, 283 aeroallergen 391 absorption through appendage 169 – atopic eczema 391 α-acaridial 329 – avoidance 391 accident 889 aerospace 726 acebutolol hydrochloride 909 African aceclofenac 909 –ebony783 acetaldehyde 943 – mahagony 783 acetone 118, 666 – red padauk wood 783 acetylacetone 697 Agave acetylsalicylic acid 84, 909 – americana 354 Achillea millefolium (yarrow extract) 909 – tequilana 225 aciclovir 909 age 279 acid 110 agent orange 806 – black 48 (CI 65005) 909 AGEP 404 – dye 689 Agfa TSS 355 – halogenated 259 aggravation 204 –hydrochloric261 agricultural worker 272 –nitric261 agriculture 725 –red AICD, see activation-induced cell death – – 14 (azorubine) 909 airborne – – 118 (CI 26410) 909 – allergic contact dermatitis 218, 228, 315, 467, 477, 484, 598, ––359909 627, 654, 788 – violet 17 (CI 42650) 909 – contact urticaria 753, 758 – yellow – irritant contact dermatitis 625 – – 36 (CI 13065, metanil yellow) 909 aircraft manufacture 560 – – 61 (CI 18968) 909 airway symptom 520 acitretin 341 alachlor 953 acneiform alantolactone 55, 789, 909, 954 – folliculitis 229 alclometasone-17,21-dipropionate 909 –lesion265 alclometasone-17-propionate 58 acrodermatitis enteropathica 241 alcohol, see also ethyl 909 acrovesicular dermatitis 401 aldehyde 110, 607, 886 acrylamide 592, 944 algicide 562 acrylate -

SAMHD1 . . . and Viral Ways Around It
viruses Review SAMHD1 . and Viral Ways around It Janina Deutschmann and Thomas Gramberg * Institute of Clinical and Molecular Virology, Friedrich-Alexander University Erlangen-Nürnberg, 91054 Erlangen, Germany; [email protected] * Correspondence: [email protected] Abstract: The SAM and HD domain-containing protein 1 (SAMHD1) is a dNTP triphosphohydrolase that plays a crucial role for a variety of different cellular functions. Besides balancing intracellular dNTP concentrations, facilitating DNA damage repair, and dampening excessive immune responses, SAMHD1 has been shown to act as a major restriction factor against various virus species. In addition to its well-described activity against retroviruses such as HIV-1, SAMHD1 has been identified to reduce the infectivity of different DNA viruses such as the herpesviruses CMV and EBV, the poxvirus VACV, or the hepadnavirus HBV. While some viruses are efficiently restricted by SAMHD1, others have developed evasion mechanisms that antagonize the antiviral activity of SAMHD1. Within this review, we summarize the different cellular functions of SAMHD1 and highlight the countermeasures viruses have evolved to neutralize the restriction factor SAMHD1. Keywords: SAMHD1; restriction factor; viral antagonism; HIV; herpesviruses; viral kinases; Vpx; dNTP hydrolase; viral interference 1. The dNTPase SAMHD1 The SAM and HD domain-containing protein 1 (SAMHD1) is a ubiquitously expressed Citation: Deutschmann, J.; deoxynucleotide triphosphohydrolase (dNTPase) of 626 amino acids (Figure1). In general, Gramberg, T. SAMHD1 . and Viral sterile alpha motif (SAM) domains have been shown to mediate protein–protein interaction Ways around It. Viruses 2021, 13, 395. or nucleic acid binding; however, its function in SAMHD1 is still unclear. The enzymatically https://doi.org/10.3390/v13030395 active HD domain, defined by two pairs of histidine and aspartate residues in its active center, on the other hand is essential for retroviral restriction and tetramerization of the Academic Editor: Sébastien Nisole protein [1–3]. -

WO 2014/167554 A2 16 October 2014 (16.10.2014) P O P C T
(12) INTERNATIONAL APPLICATION PUBLISHED UNDER THE PATENT COOPERATION TREATY (PCT) (19) World Intellectual Property Organization International Bureau (10) International Publication Number (43) International Publication Date WO 2014/167554 A2 16 October 2014 (16.10.2014) P O P C T (51) International Patent Classification: (81) Designated States (unless otherwise indicated, for every A61K 47/10 (2006.01) kind of national protection available): AE, AG, AL, AM, AO, AT, AU, AZ, BA, BB, BG, BH, BN, BR, BW, BY, (21) International Application Number: BZ, CA, CH, CL, CN, CO, CR, CU, CZ, DE, DK, DM, PCT/IB20 14/060675 DO, DZ, EC, EE, EG, ES, FI, GB, GD, GE, GH, GM, GT, (22) International Filing Date: HN, HR, HU, ID, IL, IN, IR, IS, JP, KE, KG, KN, KP, KR, 12 April 2014 (12.04.2014) KZ, LA, LC, LK, LR, LS, LT, LU, LY, MA, MD, ME, MG, MK, MN, MW, MX, MY, MZ, NA, NG, NI, NO, NZ, (25) Filing Language: English OM, PA, PE, PG, PH, PL, PT, QA, RO, RS, RU, RW, SA, (26) Publication Language: English SC, SD, SE, SG, SK, SL, SM, ST, SV, SY, TH, TJ, TM, TN, TR, TT, TZ, UA, UG, US, UZ, VC, VN, ZA, ZM, (30) Priority Data: zw. 1103/DEL/2013 12 April 2013 (12.04.2013) IN (84) Designated States (unless otherwise indicated, for every (71) Applicant: VYOME BIOSCIENCES PVT. LTD. kind of regional protection available): ARIPO (BW, GH, [IN/IN]; 459 F.I.E, First Floor, Patparganj Industrial Area, GM, KE, LR, LS, MW, MZ, NA, RW, SD, SL, SZ, TZ, New Delhi 110092 (IN). -

List of Union Reference Dates A
Active substance name (INN) EU DLP BfArM / BAH DLP yearly PSUR 6-month-PSUR yearly PSUR bis DLP (List of Union PSUR Submission Reference Dates and Frequency (List of Union Frequency of Reference Dates and submission of Periodic Frequency of submission of Safety Update Reports, Periodic Safety Update 30 Nov. 2012) Reports, 30 Nov. -

DMD #9209 1 N-Methylpurine DNA Glycosylase and 8-Oxoguanine
DMD Fast Forward. Published on March 24, 2006 as DOI: 10.1124/dmd.105.009209 DMD FastThis article Forward. has not beenPublished copyedited on and March formatted. 24, The 2006 final version as doi:10.1124/dmd.105.009209 may differ from this version. DMD #9209 N-methylpurine DNA glycosylase and 8-oxoguanine DNA glycosylase metabolize the antiviral nucleoside 2-bromo-5,6-dichloro-1-(β-D-ribofuranosyl)benzimidazole Philip L. Lorenzi1, Christopher P. Landowski2, Andrea Brancale, Xueqin Song, Leroy B. Townsend, John C. Drach and Gordon L. Amidon. Department of Pharmaceutical Sciences (P.L.L., C.P.L., X.S., G.L.A.) and Medicinal Chemistry (L.B.T., J.C.D.), College of Pharmacy, and Department of Biologic and Downloaded from Materials Sciences (J.C.D.), School of Dentistry, University of Michigan, Ann Arbor, Michigan, USA; and Welsh School of Pharmacy (A.B.), Cardiff University, Wales, UK. dmd.aspetjournals.org at ASPET Journals on September 24, 2021 1 Copyright 2006 by the American Society for Pharmacology and Experimental Therapeutics. DMD Fast Forward. Published on March 24, 2006 as DOI: 10.1124/dmd.105.009209 This article has not been copyedited and formatted. The final version may differ from this version. DMD #9209 Running Title: Nucleoside drug metabolism by DNA repair enzymes Text pages: 19 Tables: 4 Figures: 3 References: 43 Words in Abstract: 180 Words in Introduction: 464 Words in Discussion: 1433 Abbreviations: BDCRB, 2-bromo-5,6-dichloro-1-(β-D-ribofuranosyl)benzimidazole; TCRB, 2,5,6-trichloro-1-(β-D-ribofuranosyl)benzimidazole;