Introdução Geral
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Phylogenetic Relationships Within the Speciose Family Characidae
Oliveira et al. BMC Evolutionary Biology 2011, 11:275 http://www.biomedcentral.com/1471-2148/11/275 RESEARCH ARTICLE Open Access Phylogenetic relationships within the speciose family Characidae (Teleostei: Ostariophysi: Characiformes) based on multilocus analysis and extensive ingroup sampling Claudio Oliveira1*, Gleisy S Avelino1, Kelly T Abe1, Tatiane C Mariguela1, Ricardo C Benine1, Guillermo Ortí2, Richard P Vari3 and Ricardo M Corrêa e Castro4 Abstract Background: With nearly 1,100 species, the fish family Characidae represents more than half of the species of Characiformes, and is a key component of Neotropical freshwater ecosystems. The composition, phylogeny, and classification of Characidae is currently uncertain, despite significant efforts based on analysis of morphological and molecular data. No consensus about the monophyly of this group or its position within the order Characiformes has been reached, challenged by the fact that many key studies to date have non-overlapping taxonomic representation and focus only on subsets of this diversity. Results: In the present study we propose a new definition of the family Characidae and a hypothesis of relationships for the Characiformes based on phylogenetic analysis of DNA sequences of two mitochondrial and three nuclear genes (4,680 base pairs). The sequences were obtained from 211 samples representing 166 genera distributed among all 18 recognized families in the order Characiformes, all 14 recognized subfamilies in the Characidae, plus 56 of the genera so far considered incertae sedis in the Characidae. The phylogeny obtained is robust, with most lineages significantly supported by posterior probabilities in Bayesian analysis, and high bootstrap values from maximum likelihood and parsimony analyses. -

Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 Version Available for Download From
Information Sheet on Ramsar Wetlands (RIS) – 2009-2012 version Available for download from http://www.ramsar.org/ris/key_ris_index.htm. Categories approved by Recommendation 4.7 (1990), as amended by Resolution VIII.13 of the 8th Conference of the Contracting Parties (2002) and Resolutions IX.1 Annex B, IX.6, IX.21 and IX. 22 of the 9th Conference of the Contracting Parties (2005). Notes for compilers: 1. The RIS should be completed in accordance with the attached Explanatory Notes and Guidelines for completing the Information Sheet on Ramsar Wetlands. Compilers are strongly advised to read this guidance before filling in the RIS. 2. Further information and guidance in support of Ramsar site designations are provided in the Strategic Framework and guidelines for the future development of the List of Wetlands of International Importance (Ramsar Wise Use Handbook 14, 3rd edition). A 4th edition of the Handbook is in preparation and will be available in 2009. 3. Once completed, the RIS (and accompanying map(s)) should be submitted to the Ramsar Secretariat. Compilers should provide an electronic (MS Word) copy of the RIS and, where possible, digital copies of all maps. 1. Name and address of the compiler of this form: FOR OFFICE USE ONLY. DD MM YY Beatriz de Aquino Ribeiro - Bióloga - Analista Ambiental / [email protected], (95) Designation date Site Reference Number 99136-0940. Antonio Lisboa - Geógrafo - MSc. Biogeografia - Analista Ambiental / [email protected], (95) 99137-1192. Instituto Chico Mendes de Conservação da Biodiversidade - ICMBio Rua Alfredo Cruz, 283, Centro, Boa Vista -RR. CEP: 69.301-140 2. -

Biota Colombiana Vol
Biota Colombiana Vol. 9 (2), 2008 Una publicación del / A publication of: Instituto Alexander von Humboldt En asocio con / In collaboration with: Instituto de Ciencias Naturales de la Universidad Nacional de Colombia Instituto de Investigaciones Marinas y Costeras - Invemar BIOTA COLOMBIANA Missouri Botanical Garden ISSN 0124-5376 Volumen 9 - Número 2, diciembre de 2008 Checklist of the Freshwater Fishes of Colombia • Listado de especies espinosas de Solanum L. (Leptostemonum, Solanaceae) • Anfibios y reptiles en el departamento del Valle del Cauca, Colombia • Peces del Oriente de Antioquia, Colombia • Una nueva especie de Liotyphlops Peters, 1881 (Serpentes, Scolecophidia, Anomalepidae) del sur de la Amazonia Colombiana • Checklist of the Freshwater Fishes of Colombia • Listado de LISTADOS TAXONÓMICOS / TAXONOMIC LIST especies espinosas de Solanum L. (Leptostemonum, Solanaceae) • Anfibios y reptiles en el departamento del Valle del Cauca, Colombia • Peces del Oriente de Antioquia, Colombia • Una nueva especie de Liotyphlops Peters, 1881 (Serpentes, Scolecophidia, Anomalepidae) del sur de la Amazonia Listados Nacionales / National Lists Colombiana • Checklist of the Freshwater Fishes of Colombia • Listado de especies espinosas de Solanum L. (Leptostemonum, Solanaceae) • Checklist of the Freshwater Fishes of Colombia – J. A. Maldonado-Ocampo, R. P. Vari & J. S. Usma......................143 Anfibios y reptiles en el departamento del Valle del Cauca, Colombia • Peces del Oriente de Antioquia, Colombia • Una nueva especie deLiotyphlops Peters, 1881 (Serpentes, Scolecophidia, Anomalepidae) del sur de la Amazonia Colombiana • Checklist of the Freshwater Fishes of Colombia • Listado de especies espinosas de Solanum L. (Leptostemonum, Solanaceae) – C. I. Orozco, Listado de especies espinosas de Solanum L. (Leptostemonum, Solanaceae) • Anfibios y reptiles en el departamento del Valle del Cauca, Colombia G. -

Taxonomia E Filogenia De Peixes De Riachos Brasileiros
Oecologia Australis 25(2):197–230, 2021 https://doi.org/10.4257/oeco.2021.2502.01 TAXONOMIA E FILOGENIA DE PEIXES DE RIACHOS BRASILEIROS Paulo Andreas Buckup1* 1 Universidade Federal do Rio de Janeiro, Museu Nacional, Quinta da Boa Vista, CEP 20940-040, Rio de Janeiro, RJ, Brasil. E-mail: [email protected] (*autor correspondente). Resumo: A fauna de peixes de riachos brasileiros compreende 36 famílias de peixes teleósteos de água doce. O conhecimento sobre a sistemática e filogenia deste conjunto de espécies ampliou-se consideravelmente nas últimas duas décadas, porém ainda é muito heterogêneo, havendo grupos sobre os quais pouco se conhece, assim como grupos para os quais há chaves de identificação e hipóteses filogenéticas recentes e bem documentadas. O número de famílias de peixes de água doce com presença frequente em riachos brasileiros ampliou-se de 31 para 36. Este crescimento no conhecimento da diversidade dos peixes neotropicais refletiu-se no grande desenvolvimento das hipóteses sobre sua evolução e contribuiu para o entendimento da história filogenética e estruturação das comunidades de peixes de riacho. Palavras-chave: biodiversidade; classificação; filogenia; riachos; sistemática. TAXONOMY AND PHYLOGENY OF FISHES FROM BRAZILIAN SMALL STREAMS: The fish fauna occurring in Brazilian small streams comprises 36 families of teleost freshwater fishes. The systematics and phylogenetic knowledge about this fauna greatly expanded during the last two decades, but is still very heterogeneous. For some taxonomic groups there are taxonomic identification keys and well-documented phylogenetic hypotheses, while other groups are mostly comprised by poorly known species. The increase in the knowledge of Neotropical fish diversity was associated with the significant growth of hypotheses about their evolution and contributed to the understanding of the phylogenetic history of fish comunities and their structure in small streams. -
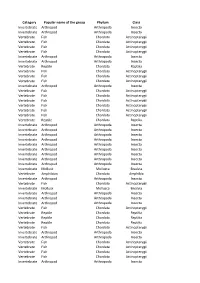
Category Popular Name of the Group Phylum Class Invertebrate
Category Popular name of the group Phylum Class Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Vertebrate Reptile Chordata Reptilia Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Invertebrate Arthropod Arthropoda Insecta Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Fish Chordata Actinopterygii Vertebrate Reptile Chordata Reptilia Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Mollusk Mollusca Bivalvia Vertebrate Amphibian Chordata Amphibia Invertebrate Arthropod Arthropoda Insecta Vertebrate Fish Chordata Actinopterygii Invertebrate Mollusk Mollusca Bivalvia Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Invertebrate Arthropod Arthropoda Insecta Vertebrate -

Reproductive Characteristics of Characid Fish Species (Teleostei
Reproductive characteristics of characid fish species (Teleostei... 469 Reproductive characteristics of characid fish species (Teleostei, Characiformes) and their relationship with body size and phylogeny Marco A. Azevedo Setor de Ictiologia, Museu de Ciências Naturais, Fundação Zoobotânica do Rio Grande do Sul, Rua Dr. Salvador França, 1427, 90690-000 Porto Alegre, RS, Brazil. ([email protected]) ABSTRACT. In this study, I investigated the reproductive biology of fish species from the family Characidae of the order Characiformes. I also investigated the relationship between reproductive biology and body weight and interpreted this relationship in a phylogenetic context. The results of the present study contribute to the understanding of the evolution of the reproductive strategies present in the species of this family. Most larger characid species and other characiforms exhibit a reproductive pattern that is generally characterized by a short seasonal reproductive period that lasts one to three months, between September and April. This is accompanied by total spawning, an extremely high fecundity, and, in many species, a reproductive migration. Many species with lower fecundity exhibit some form of parental care. Although reduction in body size may represent an adaptive advantage, it may also require evolutionary responses to new biological problems that arise. In terms of reproduction, smaller species have a tendency to reduce the number of oocytes that they produce. Many small characids have a reproductive pattern similar to that of larger characiforms. On the other hand they may also exhibit a range of modifications that possibly relate to the decrease in body size and the consequent reduction in fecundity. -

Check List 5(3): 673–691, 2009
Check List 5(3): 673–691, 2009. ISSN: 1809-127X LISTS OF SPECIES Fishes from the upper Yuruá river, Amazon basin, Peru Tiago P. Carvalho 1 S. June Tang 1 Julia I. Fredieu 1 Roberto Quispe 2 Isabel Corahua 2 Hernan Ortega 2 1 James S. Albert 1 University of Louisiana at Lafayette, Department of Biology. Lafayette, LA 70504, USA. E-mail: [email protected] 2 Museo de Historia Natural de la Universidad Nacional Mayor de San Marcos. Av. Arenales 1256, Lima 11, Peru. Abstract We report results of an ichthyological survey of the upper Rio Yuruá in southeastern Peru. Collections were made at low water (July-August, 2008) near the headwaters of the Brazilian Rio Juruá. This is the first of four expeditions to the Fitzcarrald Arch - an upland associated with the Miocene-Pliocene rise of the Peruvian Andes - with the goal of comparing the ichthyofauna across the headwaters of the largest tributary basins in the western Amazon (Ucayali, Juruá, Purús and Madeira). We recorded a total of 117 species in 28 families and 10 orders, with all species accompanied by tissue samples preserved in 100% ethanol for subsequent DNA analysis, and high-resolution digital images of voucher specimens with live color to facilitate accurate identification. From interviews with local fishers and comparisons with other ichthyological surveys of the region we estimate the actual diversity of fishes in the upper Juruá to exceed 200 species. Introduction The Yuruá river rises in the department of Ucayali The freshwater f sh fauna of tropical South in Peru and runs into Brazilian territory, where it America is among the richest vertebrate faunas is known as Juruá river. -

Use of DNA Barcode in the Identification of Fish Eggs in Tributaries of the Paranapanema River Basin
Genetics and Molecular Biology 43, 3, e20190352 (2020) Copyright © 2020, Sociedade Brasileira de Genética. DOI: https://doi.org/10.1590/1678-4685-GMB-2019-0352 Research Article Animal Genetics Use of DNA barcode in the identification of fish eggs in tributaries of the Paranapanema River basin Moema Cristina Costa de Lima1 , Same Costa Lima1 , Camila Satie Savada1 , Karen Mayumi Suzuki1 , Mário Luís Orsi2 and Fernanda Simões de Almeida1 1Universidade Estadual de Londrina, Departamento de Biologia Geral, Laboratório de Genética e Ecologia Animal, Londrina, PR, Brazil. 2Universidade Estadual de Londrina, Departamento de Biologia Animal e Vegetal, Laboratório de Ecologia de Peixes e Invasões Biológicas, Londrina, PR, Brazil. Abstract Fish eggs are often excluded from identification analysis since at this stage of development there are few morpholog- ical characters. The correct identification of eggs can provide important information about spawning areas of spe- cies. The current work aimed to identify fish eggs in the Tibagi and Cinzas Rivers using the DNA barcode to obtain information on richness and diversity, adding to the existing data in the area. Of the 928 sequences analyzed using the BOLD Systems database, 99.78% were able to be identified at a specific level, demonstrating a high success rate for egg identification. The samples resulted in 25 species, 11 families, and 2 orders. Of the 25 species found, more than half (60%) present reproductive migration behavior, indicating that the tributaries of the Capivara reservoir are being used as a migratory route by these species. Eggs of rare and endangered species were found, indicating these tributaries as spawning grounds for these species. -

Redalyc.Checklist of the Freshwater Fishes of Colombia
Biota Colombiana ISSN: 0124-5376 [email protected] Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Colombia Maldonado-Ocampo, Javier A.; Vari, Richard P.; Saulo Usma, José Checklist of the Freshwater Fishes of Colombia Biota Colombiana, vol. 9, núm. 2, 2008, pp. 143-237 Instituto de Investigación de Recursos Biológicos "Alexander von Humboldt" Bogotá, Colombia Available in: http://www.redalyc.org/articulo.oa?id=49120960001 How to cite Complete issue Scientific Information System More information about this article Network of Scientific Journals from Latin America, the Caribbean, Spain and Portugal Journal's homepage in redalyc.org Non-profit academic project, developed under the open access initiative Biota Colombiana 9 (2) 143 - 237, 2008 Checklist of the Freshwater Fishes of Colombia Javier A. Maldonado-Ocampo1; Richard P. Vari2; José Saulo Usma3 1 Investigador Asociado, curador encargado colección de peces de agua dulce, Instituto de Investigación de Recursos Biológicos Alexander von Humboldt. Claustro de San Agustín, Villa de Leyva, Boyacá, Colombia. Dirección actual: Universidade Federal do Rio de Janeiro, Museu Nacional, Departamento de Vertebrados, Quinta da Boa Vista, 20940- 040 Rio de Janeiro, RJ, Brasil. [email protected] 2 Division of Fishes, Department of Vertebrate Zoology, MRC--159, National Museum of Natural History, PO Box 37012, Smithsonian Institution, Washington, D.C. 20013—7012. [email protected] 3 Coordinador Programa Ecosistemas de Agua Dulce WWF Colombia. Calle 61 No 3 A 26, Bogotá D.C., Colombia. [email protected] Abstract Data derived from the literature supplemented by examination of specimens in collections show that 1435 species of native fishes live in the freshwaters of Colombia. -

View/Download
SILURIFORMES (part 10) · 1 The ETYFish Project © Christopher Scharpf and Kenneth J. Lazara COMMENTS: v. 25.0 - 13 July 2021 Order SILURIFORMES (part 10 of 11) Family ASPREDINIDAE Banjo Catfishes 13 genera · 50 species Subfamily Pseudobunocephalinae Pseudobunocephalus Friel 2008 pseudo-, false or deceptive, referring to fact that members of this genus have previously been mistaken for juveniles of various species of Bunocephalus Pseudobunocephalus amazonicus (Mees 1989) -icus, belonging to: Amazon River, referring to distribution in the middle Amazon basin (including Rio Madeira) of Bolivia and Brazil Pseudobunocephalus bifidus (Eigenmann 1942) forked, referring to bifid postmental barbels Pseudobunocephalus iheringii (Boulenger 1891) in honor of German-Brazilian zoologist Hermann von Ihering (1850-1930), who helped collect type Pseudobunocephalus lundbergi Friel 2008 in honor of John G. Lundberg (b. 1942), Academy of Natural Sciences of Philadelphia, Friel’s Ph.D. advisor, for numerous contributions to neotropical ichthyology and the systematics of siluriform and gymnotiform fishes Pseudobunocephalus quadriradiatus (Mees 1989) quadri-, four; radiatus, rayed, referring to four-rayed pectoral fin rather than the usual five Pseudobunocephalus rugosus (Eigenmann & Kennedy 1903) rugose or wrinkled, referring to “very conspicuous” warts all over the skin Pseudobunocephalus timbira Leão, Carvalho, Reis & Wosiacki 2019 named for the Timbira indigenous groups who live in the area (lower Tocantins and Mearim river basins in Maranhão, Pará and -

Diversidade Da Ictiofauna Do Alto Rio Paraná: Composição Atual E Perspectivas Futuras
Diversidade da ictiofauna do Alto Rio Paraná: composição atual e perspectivas futuras Francisco Langeani1,6, Ricardo Macedo Corrêa e Castro2, Osvaldo Takeshi Oyakawa3, Oscar Akio Shibatta4, Carla Simone Pavanelli5 & Lilian Casatti1 Biota Neotropica v7 (n3) – http://www.biotaneotropica.org.br/v7n3/pt/abstract?article+bn03407032007 Recebido em 21/12/06 Versão reformulada recebida em 06/07/07 Publicado em 19/10/07 1Laboratório de Ictiologia, Departamento de Zoologia e Botânica, Universidade Estadual Paulista – UNESP, Rua Cristóvão Colombo, 2265, CEP 15054-000, São José do Rio Preto, SP, Brasil, e-mail: [email protected] 2Laboratório de Ictiologia de Ribeirão Preto – LIRP, Departamento de Biologia, Faculdade de Filosofia Ciencias e Letras de Ribeirao Preto – FFCLRP, Universidade de São Paulo – USP, Av. Bandeirantes, 3900, CEP 14040-901, Ribeirão Preto, SP, Brasil, e-mail: [email protected] 3Museu de Zoologia, Universidade de São Paulo, Av. Nazaré, 481, CP 42494, CEP 04218-970, São Paulo, SP, Brasil, e-mail: [email protected] 4Departamento de Biologia Animal e Vegetal, Centro de Ciências Biológicas, Universidade Estadual de Londrina – UEL, Rodovia Celso Garcia Cid – PR 445, Km 380, CEP 86051-990, Londrina, PR, Brasil, e-mail: [email protected] 5Núcleo de Pesquisas em Limnologia Ictiologia e Aqüicultura – NUPELIA, Universidade Estadual de Maringá, Av. Colombo, 5790, CEP 87020-900, Maringá, PR, Brasil. e-mail: [email protected] 6Autor para correspondência: Francisco Langeani, e-mail: [email protected] Abstract Langeani, F., Castro, R.M.C., Oyakawa, O.T., Shibatta, O.A., Pavanelli, C.S. & Casatti, L. Ichthyofauna diversity of the upper rio Paraná: present composition and future perspectives. -

Ecología Trófica Y Rasgos Ecomorfológicos Del Pez Triportheus Magdalenae (Characiformes: Triportheidae) En El Embalse El Guájaro, Río Magdalena, Colombia
Ecología trófica y rasgos ecomorfológicos del pez Triportheus magdalenae (Characiformes: Triportheidae) en el embalse El Guájaro, río Magdalena, Colombia Jenny J. Morales1 & Carlos A. García-Alzate2* 1. Pós-Graduação em Ecologia e Conservação da Biodiversidade, Instituto de Biociências, Universidade Federal de Mato Grosso (UFMT), Cuiabá-MT, Brasil; [email protected] 2. Programa de Biología, Colecciones Científicas Museo de Biología, Facultad de Ciencias Básicas, Universidad del Atlántico; Barranquilla, Colombia; [email protected] * Correspondencia Recibido 26-III-2018. Corregido 18-V-2018. Aceptado 19-VI-2018. Abstract: Trophic ecology and ecomorphological traits of the fish Triportheus magdalenae (Characiformes: Triportheidae) in the El Guájaro reservoir, Magdalena River, Colombia. This study integrated morphologi- cal characteristics and trophic ecology of Triportheus magdalenae in the El Guájaro reservoir, Atlántico, lower Magdalena River Basin, Colombia, based on the analysis of stomach contents and ecomorphological attributes. Five samplings were made between September 2014 and February 2016 considering each phase of the flood pulse. The fish were sampled using traditional fishing gear such as nets and trawls. The index of food impor- tance (IAi %) was used to establish the dietary habits of the species, and the variation of the diet at interspecific level, and the vacuity coefficient (CV %) was also calculated. The Levins index standardized by Hurlbert (BA) was used to evaluate the amplitude between sizes, sex and hydrological phases. The oropharyngeal structures and the digestive tract were characterized, which together with morphological measurements, allowed and analyze 11 ecomorphological traits related to the use of habitat, such as position in the water column, and the exploitation of a particular trophic resource.