A Tt G T G C T a C a Tt G a Gg T Aa Ttt C Ttttt A
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-
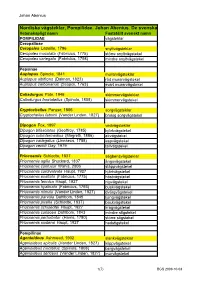
Nordiska Vägsteklar, Pompilidae. Johan Abenius. De Svenska
Johan Abenius Nordiska vägsteklar, Pompilidae. Johan Abenius. De svenska namnen fastställda av Kommittén för svenska djurnamn 100825 Vetenskapligt namn Fastställt svenskt namn POMPILIDAE vägsteklar Ceropalinae Ceropales Latreille, 1796 snyltvägsteklar Ceropales maculata (Fabricius, 1775) större snyltvägstekel Ceropales variegata (Fabricius, 1798) mindre snyltvägstekel Pepsinae Auplopus Spinola, 1841 murarvägsteklar Auplopus albifrons (Dalman, 1823) röd murarvägstekel Auplopus carbonarius (Scopoli, 1763) svart murarvägstekel Caliadurgus Pate, 1946 skimmervägsteklar Caliadurgus fasciatellus (Spinola, 1808) skimmervägstekel Cryptocheilus Panzer, 1806 sorgvägsteklar Cryptocheilus fabricii (Vander Linden, 1827) brokig sorgvägstekel Dipogon Fox, 1897 vedvägsteklar Dipogon bifasciatus (Geoffroy, 1785) björkvägstekel Dipogon subintermedius (Magretti, 1886) ekvägstekel Dipogon variegatus (Linnaeus, 1758) aspvägstekel Dipogon vechti Day, 1979 tallvägstekel Priocnemis Schiødte, 1837 sågbensvägsteklar Priocnemis agilis Shuckard, 1837 ängsvägstekel Priocnemis confusor Wahis, 2006 stäppvägstekel Priocnemis cordivalvata Haupt, 1927 hjärtvägstekel Priocnemis exaltata (Fabricius, 1775) höstvägstekel Priocnemis fennica Haupt, 1927 nipvägstekel Priocnemis hyalinata (Fabricius, 1793) buskvägstekel Priocnemis minuta (Vander Linden, 1827) dvärgvägstekel Priocnemis parvula Dahlbom, 1845 ljungvägstekel Priocnemis pusilla (Schiødte, 1837) backvägstekel Priocnemis schioedtei Haupt, 1927 kragvägstekel Priocnemis coriacea Dahlbom, 1843 mindre stigstekel Priocnemis -

UNIVERSITY of READING Delivering Biodiversity and Pollination Services on Farmland
UNIVERSITY OF READING Delivering biodiversity and pollination services on farmland: a comparison of three wildlife- friendly farming schemes Thesis submitted for the degree of Doctor of Philosophy Centre for Agri-Environmental Research School of Agriculture, Policy and Development Chloe J. Hardman June 2016 Declaration I confirm that this is my own work and the use of all material from other sources has been properly and fully acknowledged. Chloe Hardman i Abstract Gains in food production through agricultural intensification have come at an environmental cost, including reductions in habitat diversity, species diversity and some ecosystem services. Wildlife- friendly farming schemes aim to mitigate the negative impacts of agricultural intensification. In this study, we compared the effectiveness of three schemes using four matched triplets of farms in southern England. The schemes were: i) a baseline of Entry Level Stewardship (ELS: a flexible widespread government scheme, ii) organic agriculture and iii) Conservation Grade (CG: a prescriptive, non-organic, biodiversity-focused scheme). We examined how effective the schemes were in supporting habitat diversity, species diversity, floral resources, pollinators and pollination services. Farms in CG and organic schemes supported higher habitat diversity than farms only in ELS. Plant and butterfly species richness were significantly higher on organic farms and butterfly species richness was marginally higher on CG farms compared to farms in ELS. The species richness of plants, butterflies, solitary bees and birds in winter was significantly correlated with local habitat diversity. Organic farms supported more evenly distributed floral resources and higher nectar densities compared to farms in CG or ELS. Compared to maximum estimates of pollen demand from six bee species, only organic farms supplied sufficient pollen in late summer. -

A Comprehensive Guide to Insects of Britain & Ireland
a comprehensive guide to insects of Britain & ireland To be launched Spring 2014. order your copy now and save over £7.50! Offer endS 31 March 2014 Special expected list price: £27.50 Pre-Publication special price: £19.95 offer you save: £7.50 A comprehensive guide to Insects of Britain & irelAnd by Paul D. Brock Special expected list price: £27.50 * Scientific Associate of the Pre-Publication special price: £19.95 Natural History Museum, offer you save: £7.50 London, and author of the acclaimed ‘Insects of the New Forest’ full colour photographs throughout, with fully comprehensive sections on all insect 2 Ants, bees and wasps Subfamily Andreninae Ants, bees and wasps 3 Andrena species form the majority of this large subfamily of small to large, mining (soil-nesting) bees; very few groups, including flies, bees and wasps nest communally. There are sometimes several species with similar appearance, thus care is needed in identification. Many have a single brood, but identification of others with two broods is so by seasonal variation. In a few species, giant males occur, with large heads and mandibles. metimes complicated species and a few Sphecodes species are cleptoparasites and parasitic flies are often seen around Colourful nests where it is fascinating to watch their behaviour. A selection of species in this popular genus is include Nomada widespread, some are very local. ISBN 978-1-874357-58-2 d; although Andrena angustior Body length: 8–11 mm. Small, distinguished by the long marginal area on 2nd tergite. Cleptoparasite probably Nomada fabriciana Flexibound, 195 × 135mm, around 500pp woodlands, meadows and sometimes heaths. -

Harmful Non-Indigenous Species in the United States
Harmful Non-Indigenous Species in the United States September 1993 OTA-F-565 NTIS order #PB94-107679 GPO stock #052-003-01347-9 Recommended Citation: U.S. Congress, Office of Technology Assessment, Harmful Non-Indigenous Species in the United States, OTA-F-565 (Washington, DC: U.S. Government Printing Office, September 1993). For Sale by the U.S. Government Printing Office ii Superintendent of Documents, Mail Stop, SSOP. Washington, DC 20402-9328 ISBN O-1 6-042075-X Foreword on-indigenous species (NIS)-----those species found beyond their natural ranges—are part and parcel of the U.S. landscape. Many are highly beneficial. Almost all U.S. crops and domesticated animals, many sport fish and aquiculture species, numerous horticultural plants, and most biologicalN control organisms have origins outside the country. A large number of NIS, however, cause significant economic, environmental, and health damage. These harmful species are the focus of this study. The total number of harmful NIS and their cumulative impacts are creating a growing burden for the country. We cannot completely stop the tide of new harmful introductions. Perfect screening, detection, and control are technically impossible and will remain so for the foreseeable future. Nevertheless, the Federal and State policies designed to protect us from the worst species are not safeguarding our national interests in important areas. These conclusions have a number of policy implications. First, the Nation has no real national policy on harmful introductions; the current system is piecemeal, lacking adequate rigor and comprehensiveness. Second, many Federal and State statutes, regulations, and programs are not keeping pace with new and spreading non-indigenous pests. -

Final Report 1
Sand pit for Biodiversity at Cep II quarry Researcher: Klára Řehounková Research group: Petr Bogusch, David Boukal, Milan Boukal, Lukáš Čížek, František Grycz, Petr Hesoun, Kamila Lencová, Anna Lepšová, Jan Máca, Pavel Marhoul, Klára Řehounková, Jiří Řehounek, Lenka Schmidtmayerová, Robert Tropek Březen – září 2012 Abstract We compared the effect of restoration status (technical reclamation, spontaneous succession, disturbed succession) on the communities of vascular plants and assemblages of arthropods in CEP II sand pit (T řebo ňsko region, SW part of the Czech Republic) to evaluate their biodiversity and conservation potential. We also studied the experimental restoration of psammophytic grasslands to compare the impact of two near-natural restoration methods (spontaneous and assisted succession) to establishment of target species. The sand pit comprises stages of 2 to 30 years since site abandonment with moisture gradient from wet to dry habitats. In all studied groups, i.e. vascular pants and arthropods, open spontaneously revegetated sites continuously disturbed by intensive recreation activities hosted the largest proportion of target and endangered species which occurred less in the more closed spontaneously revegetated sites and which were nearly absent in technically reclaimed sites. Out results provide clear evidence that the mosaics of spontaneously established forests habitats and open sand habitats are the most valuable stands from the conservation point of view. It has been documented that no expensive technical reclamations are needed to restore post-mining sites which can serve as secondary habitats for many endangered and declining species. The experimental restoration of rare and endangered plant communities seems to be efficient and promising method for a future large-scale restoration projects in abandoned sand pits. -

Additions to the Checklist of Scoliidae, Sphecidae, Pompilidae and Vespidae of Peru, with Notes on the Endemic Status of Some Species (Hymenoptera, Aculeata)
A peer-reviewed open-access journal ZooKeys 519:Additions 33–48 (2015) to the checklist of Scoliidae, Sphecidae, Pompilidae and Vespidae of Peru... 33 doi: 10.3897/zookeys.519.6501 CHECKLIST http://zookeys.pensoft.net Launched to accelerate biodiversity research Additions to the checklist of Scoliidae, Sphecidae, Pompilidae and Vespidae of Peru, with notes on the endemic status of some species (Hymenoptera, Aculeata) Eduardo Fernando dos Santos1, Yuri Campanholo Grandinete1,2, Fernando Barbosa Noll1 1 Departamento de Zoologia e Botânica, Instituto de Biociências, Letras e Ciências Exatas, Universidade Esta- dual Paulista “Júlio de Mesquita Filho”. Rua Cristóvão Colombo, 2265, Jd. Nazareth, 15054-000, São José do Rio Preto, SP, Brazil 2 Departamento de Biologia, Faculdade de Filosofia, Ciências e Letras de Ribeirão Preto, Universidade de São Paulo. Av. Bandeirantes, 3900, 14040-901, Ribeirão Preto, SP, Brazil Corresponding author: Eduardo Fernando dos Santos ([email protected]) Academic editor: Michael Engel | Received 22 May 2015 | Accepted 19 August 2015 | Published 31 August 2015 http://zoobank.org/DA5A298F-BEF0-4AF5-AA08-FB8FF41FE6A4 Citation: dos Santos EF, Grandinete YC, Noll FB (2015) Additions to the checklist of Scoliidae, Sphecidae, Pompilidae and Vespidae of Peru, with notes on the endemic status of some species (Hymenoptera, Aculeata). ZooKeys 519: 33–48. doi: 10.3897/zookeys.519.6501 Abstract The first checklist of the Peruvian Hymenoptera listed 1169 species and subspecies of aculeate wasps, including 173 species of Pompilidae, seven of Scoliidae, 39 of Sphecidae and 403 of Vespidae. Herein are reported 32 species as new for Peru based mainly on the collection of the Natural History Museum, London. -

Nhbs Monthly Catalogue New and Forthcoming Titles Issue: 2013/08 August 2013 [email protected] +44 (0)1803 865913
nhbs monthly catalogue new and forthcoming titles Issue: 2013/08 August 2013 www.nhbs.com [email protected] +44 (0)1803 865913 Welcome to the August 2013 edition of the NHBS Monthly Catalogue. This monthly Zoology: update contains all of the wildlife, science and environment titles added to nhbs.com in Mammals the last month. Birds Editor's Picks - New in Stock this Month Reptiles & Amphibians Fishes ● The Warbler Guide Invertebrates ● The Avian Migrant Palaeontology ● The Biology of Peatlands Marine & Freshwater Biology ● Birds of the Indian Ocean Islands General Natural History ● A Field Key to Lichens on Trees Regional & Travel ● Frogs of the United States and Canada (2-Volume Set) ● Mammals of China (Pocket Edition) Botany & Plant Science ● Marine Plants of the Canary Islands Animal & General Biology ● Reunion Island Orchids / Orchidees de La Reunion Evolutionary Biology ● Penguins: Natural History and Conservation Ecology ● Reptiles and Amphibians of the Pacific Islands: A Comprehensive Guide Habitats & Ecosystems ● River Conservation and Management Conservation & Biodiversity ● The Symbol: Wall Lizards of Ibiza and Formentera Find out more about services for libraries and organisations: NHBS Environmental Science LibraryPro Physical Sciences Sustainable Development Best wishes, -The NHBS Team Data Analysis Reference View this Monthly Catalogue as a web page or save/print it as a .pdf document. Mammals A Pictorial Guide to Non-human Primates of India 173 pages | colour illustrations, colour Sangita Mitra maps | This is a colorful pictorial guide for Indian Primates, which concisely describes all the 15 species Paperback | 01/2011 | 9788192061610 occurring in India including their distribution, habit, habitat, morphology, sexual dimorphism, | #207408A | £26.99 Add to basket natural diet, endemicity, interspecific .. -

2017 City of York Biodiversity Action Plan
CITY OF YORK Local Biodiversity Action Plan 2017 City of York Local Biodiversity Action Plan - Executive Summary What is biodiversity and why is it important? Biodiversity is the variety of all species of plant and animal life on earth, and the places in which they live. Biodiversity has its own intrinsic value but is also provides us with a wide range of essential goods and services such as such as food, fresh water and clean air, natural flood and climate regulation and pollination of crops, but also less obvious services such as benefits to our health and wellbeing and providing a sense of place. We are experiencing global declines in biodiversity, and the goods and services which it provides are consistently undervalued. Efforts to protect and enhance biodiversity need to be significantly increased. The Biodiversity of the City of York The City of York area is a special place not only for its history, buildings and archaeology but also for its wildlife. York Minister is an 800 year old jewel in the historical crown of the city, but we also have our natural gems as well. York supports species and habitats which are of national, regional and local conservation importance including the endangered Tansy Beetle which until 2014 was known only to occur along stretches of the River Ouse around York and Selby; ancient flood meadows of which c.9-10% of the national resource occurs in York; populations of Otters and Water Voles on the River Ouse, River Foss and their tributaries; the country’s most northerly example of extensive lowland heath at Strensall Common; and internationally important populations of wetland birds in the Lower Derwent Valley. -

Checklist of the Spider Wasps (Hymenoptera: Pompilidae) of British Columbia
Checklist of the Spider Wasps (Hymenoptera: Pompilidae) of British Columbia Scott Russell Spencer Entomological Collection Beaty Biodiversity Museum, UBC Vancouver, B.C. The family Pompilidae is a cosmopolitan group of some 5000 species of wasps which prey almost exclusively on spiders, giving rise to their common name - the spider wasps. While morphologically monotonous (Evans 1951b), these species range in size from a few millimetres long to among the largest of all hymenopterans; genus Pepsis, the tarantula hawks may reach up to 64 mm long in some tropical species (Vardy 2000). B.C.'s largest pompilid, Calopompilus pyrrhomelas, reaches a more modest body length of 19 mm among specimens held in our collection. In North America, pompilids are known primarily from hot, arid areas, although some species are known from the Yukon Territories and at least one species can overwinter above the snowline in the Colorado mountains (Evans 1997). In most species, the females hunt, attack, and paralyse spiders before laying one egg on (or more rarely, inside) the spider. Prey preferences in Pompilidae are generally based on size, but some groups are known to specialize, such as genus Ageniella on jumping spiders (Araneae: Salticidae) and Tachypompilus on wolf spiders (Araneae: Lycosidae) (Evans 1953). The paralysed host is then deposited in a burrow, which may have been appropriated from the spider, but is typically prepared before hunting from existing structures such as natural crevices, beetle tunnels, or cells belonging to other solitary wasps. While most pompilids follow this general pattern of behaviour, in the Nearctic region wasps of the genus Evagetes and the subfamily Ceropalinae exhibit cleptoparasitism (Evans 1953). -

Yorkhill Green Spaces Wildlife Species List
Yorkhill Green Spaces Wildlife Species List April 2021 update Yorkhill Green Spaces Species list Draft list of animals, plants, fungi, mosses and lichens recorded from Yorkhill, Glasgow. Main sites: Yorkhill Park, Overnewton Park and Kelvinhaugh Park (AKA Cherry Park). Other recorded sites: bank of River Kelvin at Bunhouse Rd/ Old Dumbarton Rd, Clyde Expressway path, casual records from streets and gardens in Yorkhill. Species total: 711 Vertebrates: Amhibians:1, Birds: 57, Fish: 7, Mammals (wild): 15 Invertebrates: Amphipods: 1, Ants: 3, Bees: 26, Beetles: 21, Butterflies: 11, Caddisflies: 2, Centipedes: 3, Earthworms: 2, Earwig: 1, Flatworms: 1, Flies: 61, Grasshoppers: 1, Harvestmen: 2, Lacewings: 2, Mayflies: 2, Mites: 4, Millipedes: 3, Moths: 149, True bugs: 13, Slugs & snails: 21, Spiders: 14, Springtails: 2, Wasps: 13, Woodlice: 5 Plants: Flowering plants: 174, Ferns: 5, Grasses: 13, Horsetail: 1, Liverworts: 7, Mosses:17, Trees: 19 Fungi and lichens: Fungi: 24, Lichens: 10 Conservation Status: NameSBL - Scottish Biodiversity List Priority Species Birds of Conservation Concern - Red List, Amber List Last Common name Species Taxon Record Common toad Bufo bufo amphiban 2012 Australian landhopper Arcitalitrus dorrieni amphipod 2021 Black garden ant Lasius niger ant 2020 Red ant Myrmica rubra ant 2021 Red ant Myrmica ruginodis ant 2014 Buff-tailed bumblebee Bombus terrestris bee 2021 Garden bumblebee Bombus hortorum bee 2020 Tree bumblebee Bombus hypnorum bee 2021 Heath bumblebee Bombus jonellus bee 2020 Red-tailed bumblebee Bombus -

Halloween Horrors: the Dark Side of Mother Nature by Francie Mcgowan
Halloween Horrors: The Dark Side of Mother Nature by Francie McGowan As Halloween approaches, monsters, bats and bugs will loom in the darkness of a moonless night in October to scare us. Mother Nature also has some macabre critters of the bug and insect variety that are every bit as eerie and unsettling as any Halloween costume or horror film. [Spoiler alert: do no read this article while eating or you may get sick.] To start with a seemingly pious bug, the praying mantis (order Mantodea), is actually a deadly eater and mater. With her long forelegs she captures her prey and eats them alive while holding them in a death grip. While she is mating, she bites the head of the male clean off and continues chomping the rest of the poor victim until he dies. She then saunters off well fed and fertile. The Japanese giant hornet (Vespa mandarinia japonica) is so big that, in flight, it resembles a small bird. It stings or sprays its victims - including humans - with a flesh-dissolving acid. It usually aims for the eyes. Embedded in this acid is a pheromone that attracts the other hornets in the hive to the victim and they attack en masse. Thirty of these hornets can attack a honey bee hive and kill thirty thousand of them in a matter of a few hours. Another creature to throw the most stalwart person into a state of arachnophobia (fear of spiders) or entomophobia (fear of insects) is the cockroach wasp (Ampulex compressa). They live in Asia and in Africa. -

Full Issue, Vol. 57 No. 3
Great Basin Naturalist Volume 57 Number 3 Article 15 7-31-1997 Full Issue, Vol. 57 No. 3 Follow this and additional works at: https://scholarsarchive.byu.edu/gbn Recommended Citation (1997) "Full Issue, Vol. 57 No. 3," Great Basin Naturalist: Vol. 57 : No. 3 , Article 15. Available at: https://scholarsarchive.byu.edu/gbn/vol57/iss3/15 This Full Issue is brought to you for free and open access by the Western North American Naturalist Publications at BYU ScholarsArchive. It has been accepted for inclusion in Great Basin Naturalist by an authorized editor of BYU ScholarsArchive. For more information, please contact [email protected], [email protected]. T H E GREAT BASBASINI1 naturalistnaturalist ale A VOLUME 57 ngN 3 JULY 1997 BRIGHAM YOUNG university GREAT BASIN naturalist editor assistant editor RICHARD W BAUMANN NATHAN M SMITH 290 MLBM 190 MLBM PO box 20200 PO box 26879 brigham youhgyoung university brigham young university provo UT 84602020084602 0200 provo UT 84602687984602 6879 8013785053801 378 5053 8017378801378668880173786688801 378 6688 FAX 8013783733801 378 3733 emailE mail nmshbllibyuedunmshbll1byuedu associate editors J R CALLAHAN PAUL C MARSH museum of southwestern biology university of tentercentergenter for environmental studies arizona new mexico albuquerque NM state university tempe AZ 85287 mailing address box 3140 hemet CA 92546 STANLEY D SMITH BRUCE D ESHELMAN department of biology department of Biologicbiologicalajlainaln sciences university of university of nevada las vegas wisconsin whitewawhitewaterwhitewayterten