Les Diptères Asilidae Du Département De La Manche
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

Publicité Des Demandes D'autorisation D'exploiter Pour Une
Publicité des demandes d'autorisation d'exploiter 13/03/2020 pour une mise en valeur agricole enregistrées par la DDTM de la Manche Date no enregistre Référence cadastrales Superficie Demandeur Adresse demandeur Localisation biens demandés Propriétaire Adresse propriétaire interne ment parcelles demandées (ha) demande 5020121 28/02/2020 GAEC La Vicomterie Fleury FLEURY ZK-119 1,60 Odile LEROYER La Vicomterie 50800 Fleury 5020121 28/02/2020 GAEC La Vicomterie Fleury CHAMPREPUS C-673 0,26 Odile LEROYER La Vicomterie 50800 Fleury Le Hamel Fauvel 50210 Saint 5020122 28/02/2020 Maxime DELAMARE Regnéville sur mer REGNEVILLE SUR MER ZB-45-46 1,27 Michèle LEMERY Denis le Vêtu 11 route de l'Epine 50800 5020123 28/02/2020 GAEC Lebreton Lepesant La Chaise Baudouin LA CHAISE BAUDOUIN ZN-22, ZM-1-3 2,45 Daniel PIHAN Bourguenolles 11 route de l'Epine 50800 5020123 28/02/2020 GAEC Lebreton Lepesant La Chaise Baudouin LE PARC ZH-25 1,78 Daniel PIHAN Bourguenolles St Brice de Landelles ; Vesly ; 5020125 02/03/2020 GAEC Roger La Lande d'Airou BOURGUENOLLES A-129 à 131, 136-230 4,15 Indivision CHARDRON Sainte Pience ; Breville sur mer EARL Leprieur (Changement 5020126 03/03/2020 de statut) Tirepied TIREPIED SUR SEE 19,20 Marie LE SURTEL ; Didier LE Marcenne - St Jean du Corail 5020127 04/03/2020 GAEC du Meslier Barenton BARENTON YE-40 3,16 SURTEL 50140 Romagny Fontenay CAMPAGNOLLES, LANDELLES ET COUPIGNY, NOUES DE SIENNE, EARL du Gautier (changement VIRE NORMANDIE, ST VIGOR DES 5020128 04/03/2020 de statut) Morigny MONTS 53,41 EARL du Gautier (changement 5020129 04/03/2020 de statut) Morigny NOUES DE SIENNE 3,73 5020130 04/03/2020 EARL du Gautier Morigny GOUVETS ZI-48-50-52 3,02 Roger ALLAIRE 5020130 04/03/2020 EARL du Gautier Morigny GOUVETS ZK-25 0,53 Georgette CRUET La Prévostière 14380 Sept Frères 5020130 04/03/2020 EARL du Gautier Morigny GOUVETS ZH-86-109 3,10 Gilles SEVAUX Le bourg 50410 Montbray 1, La Larderie - St Aubin de 5020131 05/03/2020 GAEC du Haut Rocher Saint Senier de Beuvron SAINT SENIER DE BEUVRON ZC-68 5,71 M. -

Plan Local D'urbanisme (PLU)
ATELIER DU MARAIS – 50 rue de Vitré – 35300 Fougères / Tél : 02.99.97.23.72 Commune de CAROLLES (50) / Elaboration du PLAN LOCAL d’URBANISME / PIECE ADMINISTRATIVE N°1 : Rapport de présentation - Partie n°1 : Diagnostic Volet A : Le socle physique et biologique Page Département : La Manche Commune : Carolles Plan Local d’Urbanisme (PLU) Pièce administrative n°1 : Rapport de présentation Vu pour être annexé à la délibération d’APPROBATION du projet PLU en date du 02 juin 2017 Le Maire ATELIER DU MARAIS – 50 rue de Vitré – 35300 Fougères / Tél : 02.99.97.23.72 Commune de CAROLLES (50) / Elaboration du PLAN LOCAL d’URBANISME / PIECE ADMINISTRATIVE N°1 : Rapport de présentation - Partie n°1 : Diagnostic Volet A : Le socle physique et biologique Page 2 Sommaire Partie n°1 : Etat initial et diagnostic - p 3 Volet A : Le socle physique et biologique - p 5 Volet B : La découverte du territoire - p 63 Volet C : L’environnement littoral - p 103 Volet D : L’armature urbaine - p 144 Volet E : Le diagnostic agricole - p 189 Partie n°2 : Justifications et compatibilité du projet de PLU - p 209 Volet F : Justifications sur la traduction réglementaire des objectifs du Plan Local d’Urbanisme - p 209 Volet G : Compatibilité avec la Loi Littoral - p 347 Volet H : Articulation du PLU avec les documents supra-communaux - p 371 Partie n°3 : Analyse des incidences sur l’environnement et évaluation environnementale - p 380 Annexes - p 443 Annexe 1 : Les dents creuses du bourg de Carolles Annexe 2 : Etude pour l’aménagement des aires d’accueil ATELIER DU MARAIS -

Rendez- Vous Aux Jardins
R endez- v ous 4 – 6 juin aux 2021 jardins La transmission des savoirs rendezvousauxjardins.fr #RdvJardins Normandie Présentation de la manifestation Pour leur 18e édition en France et 3e édition en Europe, les Rendez-vous aux Jardins vous invitent à partager « la transmission des savoirs » avec les nombreux acteurs passionnés de jardins. Nous vous attendons nombreux cette année pour explorer la richesse et la variété de nos parcs et jardins, privés et publics, de tous les styles et de toutes les époques. Plus de 3 000 parcs et jardins, en France et en Europe, s’associeront cette année à cette grande fête européenne et nous offriront des moments précieux de décou- verte et d’échange. Localement, dans le sud de la Manche, l’évènement est animé par la Société d’Horticulture d’Avranches avec le soutien de la Communauté d’agglomération Mont Saint-Michel Normandie et de la Communauté de communes Granville, Terre et Mer. Le programme détaillé est disponible sur le site www.ste-horticulture-avranches.fr Attention pour certains jardins, il est nécessaire de réserver. Mesures de sécurité sanitaire Le respect des mesures barrières est indispensable lors de chacune des visites : - distanciation d’au moins 1 mètre ; - hygiène des mains ; - port du masque obligatoire. Les masques ne sont pas fournis aux visiteurs. Jardins ouverts à la visite dans le Sud-Manche 13 12 21 22 14 17 11 15 16 18 6 10 7 9 20 8 19 1 5 4 2 3 1 - Jardin à la française - Ardevon Jardin à la française, géométrique et tropical. Roseraie. -

50-Gazette-Manche (Page 1)
Votre hebdomadaire dans la Manche Cérences Gouvets Bréhal Sourdeval- Percy Chanteloup les-Bois Ver Gavray Le Chefresne Saint-Vigor- des-Monts Coudeville- Montaigu- Margueray La Gazette de la Manche sur-Mer les-Bois Bréville- Le Mesnil- sur-Mer Hudimesnil La Amand Montbray Meurdraquière Morigny Parution : mercredi Longueville Le Mesnil- La Bloutière La Colombe Donville- Le Loreur Le Mesnil- Garnier les-Bains Anctoville- sur-Boscq Rogues Le Mesnil- Yquelon Beslon Saint-Sauveur- Villeman Fleury Granville Saint- la-Pommeraye Planchers Beauchamps Villedieu- Equilly Champrepus les- Sainte- Saint-Aubin- Folligny Cécile des-Préaux Poêles Saint-Pair- Hocquigny La Lande-d'Airou sur-Mer Saint-Jean- Le Tanu Saint-Maur- des-Champs La Haye- Rouffigny des-Bois La Chapelle- Saint-Pierre- Pesnel Cécelin Boisyvon Bourguenolles Chérencé- Langers La Lucerne-d'Outremer le-Héron La Mouche La Trinité Champcervon Saint-Martin- le-Bouillant Jullouville La Rochelle- Le Luot Saint-Jean-du- Coulouvray- Sainte- Corail-des-Bois Boisbenâtre Angey Normande Les Chambres Pience La Chaise- Saint- Subligny Baudouin Nicolas- Sartilly Montviron des-Bois Saint-Michel- Gathemo Braffais Les Loges- de-Montjoie Champeaux sur-Brécey Notre-Dame- Saint-Laurent- de-Cuves Saint-Jean- Champcey de-Livoye Saint- le-Thomas Lolif Chavoy Saint- Pois Vengeons Plomb Georges- Beauficel Chaulieu Saint- de-Livoye Lingeard Dragey- Jean- Perriers-en- Ronthon Tirepied Brécey Cuves Bacilly de-la-Haize Beauficel Marcey- Ponts Vernix Le Mesnil- les- Gilbert Brouains Cancale Grèves Saint-Brice Les Cresnays -
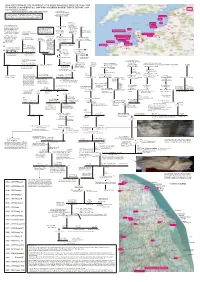
15 GENERATIONS of the MOWBRAY LINE from ROGER DE MONTBRAY B.C
15 GENERATIONS OF THE MOWBRAY LINE FROM ROGER DE MONTBRAY b.c. 1020 TO ISABELLA MOWBRAY b.c. 1400 WHO MARRIED ROBERT BRUCE BEFORE 1419 http://www,ardrosshouse.com/family.htm Comte de Holland THIS DOES INCLUDE MANY OF THE OTHER MOWBRAY LINES Luitgarde of Luxembourg It should be stressed that information pre the Conquest is based Arnulph de GAND [Ghent] on on-line submissions, often without the benefit of accompanying = Ermegarde de Flanders Saint Omer sources. Much of the information after the Conquest is supported by sources listed by John Watson, Richard Chapman and others. Aalst b.c. 965 Eu d. 6 Oct. 1019 Roupied The d’AUBIGNY line can Frederick I OYRI ? Oiry be traced back further; but Adalbert de GAND of Luxembourg (and on) { Beauvais the picture is rather confused. These lines can be followed Count of Moselgau Patrick R. Knight refers to back on the internet, on Brix sources include = Ermentrude two separate families, the Wikipedia and other sites, (Imintrud) van Penthièvre Source: Cotentin Pensinsula source for earliest George T. Homs "Arundel/Sussex d'Aubignys" for several generations, often Gleiberg Stanley W. Duke jnr. de Montbrai / Montbray line: (dates do vary!) and the "Belvoir d'Aubignys.” with sources well documented. c. 965 - 1024 Dennis Siney Montfort-sur-Risle b.c. 1016, d. before 1073 Brionne (1st earl of Surry) c. 995 - 1056 Saint-Sauveur-le-vicomte Niel II (III) de St-Sauveur- b.c. 1020 Montbray Hugh III William de bur. Chapel of St Lawrence Ghent (Morbihan, Bretagne) le-vicomte de Contentin St Martin d’Aubigny Roger de MONTBRAY de Gournay Warenne = Ralph / Rudolph van Gent Eudes, Comte d Penthièvre = Adèle de Brionne = Basita Flaitel Gundred de St seigneur d’Aalst = Agnès Canhiart de Cornouaille Coutances comtesse d’Eu Omer before 1070 Guingamp Plessis (the couple = Gisèle de Luxembourg also: founded Lewes b.c. -

Power Inequality in Inter-Communal Structures
Power Inequality in Inter-communal Structures: The Simulated Impact of a Reform in the Case of the Municipalities in Western France Zineb Abidi, Matthieu Leprince, Vincent Merlin To cite this version: Zineb Abidi, Matthieu Leprince, Vincent Merlin. Power Inequality in Inter-communal Structures: The Simulated Impact of a Reform in the Case of the Municipalities in Western France. Economie et Prévision, Minefi - Direction de la prévision, 2020. halshs-02996998 HAL Id: halshs-02996998 https://halshs.archives-ouvertes.fr/halshs-02996998 Submitted on 9 Nov 2020 HAL is a multi-disciplinary open access L’archive ouverte pluridisciplinaire HAL, est archive for the deposit and dissemination of sci- destinée au dépôt et à la diffusion de documents entific research documents, whether they are pub- scientifiques de niveau recherche, publiés ou non, lished or not. The documents may come from émanant des établissements d’enseignement et de teaching and research institutions in France or recherche français ou étrangers, des laboratoires abroad, or from public or private research centers. publics ou privés. Power Inequality in Inter-communal Structures: The Simulated Impact of a Reform in the Case of the Municipalities in Western France Zineb Abidi∗†‡ Matthieu Leprince§ Vincent Merlin¶ Abstract. This paper deals with an important issue concerning democratic government: how delegates are to be allocated among jurisdictions in a federal system. More precisely, we analyze the effect of the 2010 inter-municipal reform in France, which changed the allocation of delegates between municipalities within their inter-communal structures. Using the theory of power indices and a unique set of data gathering 377 inter-municipal structures for three French regions, we compare the fairness of the distribution of municipal delegates prior to the 2010 reform to that of the new distribution, by simulating the impact of the 2010 reform. -

Syndicat Mixte Ouvert Manche Numérique Statuts
SYNDICAT MIXTE OUVERT MANCHE NUMÉRIQUE STATUTS Manche Numérique - statuts 26-03-2021 1 / 10 TITRE I : PRÉSENTATION DU SYNDICAT Article I.1 : OBJET DU SYNDICAT En application des articles L. 5721-1 et suivants du code général des collectivités territoriales, il est créé un syndicat mixte ouvert (ci-après désigné « le Syndicat ») pour l’établissement, l’exploitation et la mise à disposition des réseaux et infrastructures de communications électroniques, des services numériques et activités connexes. Le Syndicat est régi, par ordre de priorité : • par les dispositions des articles L. 5721-1 et suivants du code général des collectivités territoriales, relatives aux syndicats mixtes ouverts, et par les présents statuts ; • à défaut, par les dispositions des articles L. 5211-1 et suivants et L. 5212-1 et suivants du code général des collectivités territoriales, relatives aux établissements publics de coopération intercommunale. Le Syndicat relève de la catégorie des syndicats mixtes ouverts restreints au sens de l’article L.5721-8 du code général des collectivités territoriales. La liste de ses membres est établie en annexe 1. Le Syndicat relève des syndicats fonctionnants « à la carte », au sens de l’article L. 5721-6-1 du code général des collectivités territoriales, pour les compétences visées à l’article I.1.1. La liste des membres par compétences figure en annexe des présents statuts. Article I.1.1 : Compétences Le Syndicat exerce, « à la carte », les deux compétences relatives à : • Compétence « Aménagement Numérique du Territoire » : 1) l’établissement et l’exploitation sur leur territoire des infrastructures et des réseaux de communications électroniques, au sens des 3° et 15° de l'article L. -

Maison De Verdun Barenton (Au Comté De Mortain) Sont De Possibles Berceaux De La Famille ; a Priori, Boucey (Près Pontorson), Est Une Possession Tardive (XV° S.)
Normandie (Avranchin, Mortanais), Angleterre (Staffordhire, Leicestershire, Buckinghamshire, Warwickshire, Derbyshire), Irlande Extraction chevaleresque : XI° siècle en Normandie maintenue en noblesse (1463 par Monfaut) Branches de Verdun de La Crenne, Ballant, Barenton et Passais - 1) La Crenne Guillaume 1423 ; maintenu noble 1599 et 1624 divisée en 2 branches : a) La Crenne maintenue noble en 1666 ; b) Ballant maintenu noble en 1671 - 2) Barenton et Passais Colin de Verdun 1410 Fougères maintenu noble en 1635 Saint-Martin-des-Champs & Saint-Quentin-sur-le-Homme (Avranchin) ; Maison de Verdun Barenton (au comté de Mortain) sont de possibles berceaux de la famille ; a priori, Boucey (près Pontorson), est une possession tardive (XV° s.). & Verdon/Vardon Armes : en Grande-Bretagne France : «D’or (alias d’argent) fretté de sable (de six pièces)» «D’Argent, fretté de sable, de six pièces» (d’Hozier Grande-Bretagne : «D’or fretté de gueules» Verdun, Verdon, Vardon Verdun (France) Devises : «Coeli Sub Rore Virescens» & «Levius Fit Patientia» (Grande-Bretagne) (Goldstone Hall) ; «Gratia Dei Sum Id Quod Sum» Support : lambrequins d’or & d’azur ou d’or & de gueules Cimier : tête de cerf (Goldstone) Sources complémentaires : Dictionnaire de la Noblesse (F. A. Aubert de La Chesnaye-Desbois, éd. 1775, Héraldique & Généalogie), "Grand Armorial de France" - Henri Jougla de Morenas & Raoul de Warren - Reprint Mémoires & Documents - 1948, tome 6, sites Roglo, Wikipedia, Geneawiki, de-verdon.uk, jcdeval06, Archives de la Manche (AD50), wappenwiki (House -

Le Mortainais Barenton
de la spectaculaire floraison des tunnels et une dizaine de bâtiments À VOIR poiriers, ou lors de la récolte qui qui permettent d’imaginer l’activité LE MORTAINAIS permet d’observer une centaine de d’autrefois. St-Georges-de-Rouelley, variétés préservées. Amusez-vous BARENTON La Fosse Arthour sur le sentier d’interprétation qui 1h00 - 16,7 km révèle les richesses écologiques PRATIQUE du bocage normand. Poursuivez Facile votre promenade sensorielle et Où stationner ma voiture ? n°21 découvrez des espaces dédiés Saint-Cyr-du-Bailleul : aux secrets de la transformation Route Départementale 188 cidricole, sur le territoire même Ancienne gare au lieu-dit du Poiré Domfront AOP. L’ancienne ferme abrite des collections La Rivière ethnographiques qui présentent Bion : les différentes facettes du milieu Place de l’église bocager et des produits issus de la pomme et de la poire. Retrouvez toutes les fiches Enfin dégustez les produits de la Baie du Mont-Saint- savoureux du Domfrontais, Michel : de la fiche N°20 Le site doit sa renommée à son également en vente à la boutique à la fiche N°26 caractère sauvage et à sa beauté. du site. Il se présente comme une gorge profonde de 70 mètres creusée dans une barre rocheuse. Au fond, coule la Sonce. Ce site pittoresque a participé à la création du mythe arthurien puisque le Roi Arthur et la Reine Guenièvre y seraient enterrés. Pour plus Ger, Musée Régional de la d’informations À VISITER poterie e OFFICE DE TOURISME Barenton, Maison de la Au XIX siècle, Ger était un centre potier qui occupait plus MONT-SAINT-MICHEL pomme et de la poire de 700 ouvriers. -

Département De La Manche
CONSEIL MUNICIPAL DU 29 JUIN 2017 *** CONVOCATION DU 22 JUIN 2017 *** L'an deux mil dix-sept, le vingt-neuf juin, à vingt heures trente, le Conseil Municipal de la Commune de La HAYE-PESNEL, régulièrement convoqué, s'est réuni dans le lieu habituel de ses séances sous la présidence de Monsieur NAVARRET Alain, Maire. Etaient présents : Mr NAVARRET Alain, Maire ; Mr TROCHON, Mme THOMAS-BALART, Mme GUESDON, Adjoints ; Mme LEMATTE, Mr DOUASBIN, Mr BEZIERS, Mr EVE, Mme LOISEL-LE PALLEC, Mr ANNE. Absents : Mr THEAULT, Mme DRUGEON, Mme LEMESLE, Mme ROGER, Mr MARQUES de FIGUEIREDO. Secrétaire : Mme LEMATTE Travaux réseaux d’assainissement sous charte qualité : DEL 17-0606 La collectivité de La Haye-Pesnel s’engage à faire réaliser tous travaux d’assainissement en respectant les préconisations de la charte qualité des réseaux d’assainissement de Normandie. Modification des statuts de la Communauté de Communes GTM – Développement de l’action sociale des personnes âgées pour le maintien à domicile : DEL 17-0607 Monsieur le Maire rappelle les compétences exercées par la Communauté de communes GTM en matière d’action sociale d’intérêt communautaire (article 2.5 des statuts) : a. En matière de petite enfance - Accueil de la petite enfance de 0 à 3 ans révolus (Relai Assistantes Maternelles - RAM, Multi accueil, crèche, Maisons d’Assistantes Maternelles, reconnues par la Collectivité). - La limite d’âge est portée jusqu’à 5 ans révolus aux enfants bénéficiaires de l’AEEH (Allocation pour l’Education de l’Enfant Handicapé) afin de faciliter l’accueil d’enfants en situation de handicap dans les services de la petite enfance. -

240 J - Fonds Cornille Liste Établie Dans L’Ordre De Rangement Des Dossiers
Archives départementales de la Manche 240 J - Fonds Cornille liste établie dans l’ordre de rangement des dossiers 152 : correspondance en vrac 1953-1958 153 : A-Z marchés terminés 154 : marchés réglés et non réglés ou douteux (2 chemises de A à fin) 155 : expertise 1900-1919 156 : expertise 1937-1952 157 : expertise de Folligny 1940 158 : devis identique Avranches – dossiers de destructions totales ou partielles 1945 (MRU) 159 : devis identique Barenton – La Bazoge- Bellefontaine – Bion – Fontnay – Mortain – dossiers de destruction totales ou partielles 1945 (MRU) 160 : Le Neufbourg – Romagny – Saint-Barthelemy – Saint-Clément – Saint-Hilaire-du-Harcouët – Saint-Jean- du-Corail – Sourdeval – La Trinité – Le Val-Saint-Père 161 : MRU – décisions et circulaires divers 1949-1955 162 : Département – lotissement et divers 163 : comité départemental de la Reconstruction – P.V. de séance – 1951-52 164 : comité départemental de la Reconstruction – 1953-54 165 : comité départemental d’action pour le logement - 1952-55 166 : armée – instruction des réserves – 1948-1954 167 : armée 1954-1968 168 : Sacre de Mgr. Bernard le 30 juin 1950 à Avranches Budgets et affaires diverses d’Avranches 1937-1940 Eglise de Fatima – Hill à Ceylan 1950 Arts appliqués Vrac… 169 : Commune de Aucey-la-Plaine – église 170 : Avranches – bains douches, centre…d’Avranches, école de l’orphelinat d’Avranches, église Saint-Gervais, hôtel des postes, piscine, prison, projet d’aménagement d’un stade, tout à l’égout, tribunal 171 : Avranches – caisse d’épargne 172 : Avranches, Carmel -

Communaute De Communes De Granville Terre Et Mer
COMMUNAUTE DE COMMUNES DE GRANVILLE TERRE ET MER N° IDENTIFICATION 2000422604 M. Jean-Marie SEVIN PRÉSIDENT Maire de Carolles 197 avenue des Vendéens SIÈGE BP 231 50400 GRANVILLE TÉLÉPHONE 02 33 91 38 60 TÉLÉCOPIE 02 33 91 38 61 COURRIEL [email protected] SITE INTERNET http://www.granville-terre-mer.fr/index.htm > Sommaire > Création .......................................................................................................................2 > Composition..................................................................................................................3 > Arrêtés...........................................................................................................................3 > Compétences................................................................................................................4 A COMPETENCES OBLIGATOIRES .............................................................................................................4 B COMPETENCES OPTIONNELLES ...........................................................................................................5 C COMPETENCES FACULTATIVES .............................................................................................................7 > Création Date de création 01/01/2014 Date d'application 01/01/2014 DDTM/SETRIS/VEP Mise à jour le 30 mars 2016 1 DDTM/SETRIS/VEP Mise à jour le 30 mars 2016 2 > Composition Nombre total de communes membres : 33 POPULATION Source INSEE Population sans doubles comptes CODE SUPERFICIE NOM