Cattleyadomontepessoafelix Di
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

"National List of Vascular Plant Species That Occur in Wetlands: 1996 National Summary."
Intro 1996 National List of Vascular Plant Species That Occur in Wetlands The Fish and Wildlife Service has prepared a National List of Vascular Plant Species That Occur in Wetlands: 1996 National Summary (1996 National List). The 1996 National List is a draft revision of the National List of Plant Species That Occur in Wetlands: 1988 National Summary (Reed 1988) (1988 National List). The 1996 National List is provided to encourage additional public review and comments on the draft regional wetland indicator assignments. The 1996 National List reflects a significant amount of new information that has become available since 1988 on the wetland affinity of vascular plants. This new information has resulted from the extensive use of the 1988 National List in the field by individuals involved in wetland and other resource inventories, wetland identification and delineation, and wetland research. Interim Regional Interagency Review Panel (Regional Panel) changes in indicator status as well as additions and deletions to the 1988 National List were documented in Regional supplements. The National List was originally developed as an appendix to the Classification of Wetlands and Deepwater Habitats of the United States (Cowardin et al.1979) to aid in the consistent application of this classification system for wetlands in the field.. The 1996 National List also was developed to aid in determining the presence of hydrophytic vegetation in the Clean Water Act Section 404 wetland regulatory program and in the implementation of the swampbuster provisions of the Food Security Act. While not required by law or regulation, the Fish and Wildlife Service is making the 1996 National List available for review and comment. -

The Prosopis Juliflora - Prosopis Pallida Complex: a Monograph
DFID DFID Natural Resources Systems Programme The Prosopis juliflora - Prosopis pallida Complex: A Monograph NM Pasiecznik With contributions from P Felker, PJC Harris, LN Harsh, G Cruz JC Tewari, K Cadoret and LJ Maldonado HDRA - the organic organisation The Prosopis juliflora - Prosopis pallida Complex: A Monograph NM Pasiecznik With contributions from P Felker, PJC Harris, LN Harsh, G Cruz JC Tewari, K Cadoret and LJ Maldonado HDRA Coventry UK 2001 organic organisation i The Prosopis juliflora - Prosopis pallida Complex: A Monograph Correct citation Pasiecznik, N.M., Felker, P., Harris, P.J.C., Harsh, L.N., Cruz, G., Tewari, J.C., Cadoret, K. and Maldonado, L.J. (2001) The Prosopis juliflora - Prosopis pallida Complex: A Monograph. HDRA, Coventry, UK. pp.172. ISBN: 0 905343 30 1 Associated publications Cadoret, K., Pasiecznik, N.M. and Harris, P.J.C. (2000) The Genus Prosopis: A Reference Database (Version 1.0): CD ROM. HDRA, Coventry, UK. ISBN 0 905343 28 X. Tewari, J.C., Harris, P.J.C, Harsh, L.N., Cadoret, K. and Pasiecznik, N.M. (2000) Managing Prosopis juliflora (Vilayati babul): A Technical Manual. CAZRI, Jodhpur, India and HDRA, Coventry, UK. 96p. ISBN 0 905343 27 1. This publication is an output from a research project funded by the United Kingdom Department for International Development (DFID) for the benefit of developing countries. The views expressed are not necessarily those of DFID. (R7295) Forestry Research Programme. Copies of this, and associated publications are available free to people and organisations in countries eligible for UK aid, and at cost price to others. Copyright restrictions exist on the reproduction of all or part of the monograph. -

Rubiaceae), and the Description of the New Species Galianthe Vasquezii from Peru and Colombia
Morphological and molecular data confirm the transfer of homostylous species in the typically distylous genus Galianthe (Rubiaceae), and the description of the new species Galianthe vasquezii from Peru and Colombia Javier Elias Florentín1, Andrea Alejandra Cabaña Fader1, Roberto Manuel Salas1, Steven Janssens2, Steven Dessein2 and Elsa Leonor Cabral1 1 Herbarium CTES, Instituto de Botánica del Nordeste, Corrientes, Argentina 2 Plant systematic, Botanic Garden Meise, Meise, Belgium ABSTRACT Galianthe (Rubiaceae) is a neotropical genus comprising 50 species divided into two subgenera, Galianthe subgen. Galianthe, with 39 species and Galianthe subgen. Ebelia, with 11 species. The diagnostic features of the genus are: usually erect habit with xylopodium, distylous flowers arranged in lax thyrsoid inflorescences, bifid stigmas, 2-carpellate and longitudinally dehiscent fruits, with dehiscent valves or indehiscent mericarps, plump seeds or complanate with a wing-like strophiole, and pollen with double reticulum, rarely with a simple reticulum. This study focused on two species that were originally described under Diodia due to the occurrence of fruits indehiscent mericarps: Diodia palustris and D. spicata. In the present study, classical taxonomy is combined with molecular analyses. As a result, we propose that both Diodia species belong to Galianthe subgen. Ebelia. The molecular position within Galianthe, based on ITS and ETS sequences, has been supported by the following morphological Submitted 10 June 2017 characters: thyrsoid, spiciform or cymoidal inflorescences, bifid stigmas, pollen grains Accepted 19 October 2017 with a double reticulum, and indehiscent mericarps. However, both species, unlike the Published 23 November 2017 remainder of the genus Galianthe, have homostylous flowers, so the presence of this Corresponding author type of flower significantly modifies the generic concept. -

IAPT/IOPB Chromosome Data 25 TAXON 66 (5) • October 2017: 1246–1252
Marhold & Kučera (eds.) • IAPT/IOPB chromosome data 25 TAXON 66 (5) • October 2017: 1246–1252 IOPB COLUMN Edited by Karol Marhold & Ilse Breitwieser IAPT/IOPB chromosome data 25 Edited by Karol Marhold & Jaromír Kučera DOI https://doi.org/10.12705/665.29 Tatyana V. An’kova* & Elena Yu. Zykova Franco E. Chiarini,1* David Lipari,1 Gloria E. Barboza1 & Sandra Knapp2 Central Siberian Botanical Garden SB RAS, Zolotodolinskaya Str. 101, 630090 Novosibirsk, Russia 1 Instituto Multidisciplinario de Biología Vegetal (IMBIV), * Author for correspondence: [email protected] CONICET, Universidad Nacional de Córdoba, CC 495 Córdoba 5000, Argentina All materials CHN; vouchers are deposited in NS; collector E.Yu. 2 Department of Life Sciences, Natural History Museum, Zykova. Cromwell Road, London SW7 5BD, U.K. * Author for correspondence: [email protected] The study was supported by the Russian Foundation for Basic Research (grant 16-04-01246 A to E. Zykova). All materials CHN; collectors: FC = Franco Chiarini, GB = Gloria Barboza, JU = Juan Urdampilleta, SK = Sandra Knapp, TS ASTERACEAE = Tiina Särkinen. Anthemis tinctoria L., 2n = 18; Russia, Altay Republic, Z35a, Z37. 2n = 27; Russia, Altay Republic, Z35b. The authors thank Consejo Nacional de Investigaciones Científi- Arctium lappa L., 2n = 36; Russia, Altay Republic, Z38. cas y Técnicas (CONICET, Argentina) for financial support. NSF Plan- Arctium minus (Hill) Bernh., 2n = 36; Russia, Altay Republic, Z41; etary Biodiversity Initiative DEB-0316614 “PBI Solanum: a worldwide Russia, Novosibirskaya Oblast, Z43. treatment”; field work for SK was financed by a National Geographic Senecio vulgaris L., 2n = 40; Russia, Altay Republic, Z56, Z90; Rus- grant to T. -

Repertorium Plantarum Succulentarum LIV (2003) Repertorium Plantarum Succulentarum LIV (2003)
ISSN 0486-4271 IOS Repertorium Plantarum Succulentarum LIV (2003) Repertorium Plantarum Succulentarum LIV (2003) Index nominum novarum plantarum succulentarum anno MMIII editorum nec non bibliographia taxonomica ab U. Eggli et D. C. Zappi compositus. International Organization for Succulent Plant Study Internationale Organisation für Sukkulentenforschung December 2004 ISSN 0486-4271 Conventions used in Repertorium Plantarum Succulentarum — Repertorium Plantarum Succulentarum attempts to list, under separate headings, newly published names of succulent plants and relevant literature on the systematics of these plants, on an annual basis. New names noted after the issue for the relevant year has gone to press are included in later issues. Specialist periodical literature is scanned in full (as available at the libraries at ZSS and Z or received by the compilers). Also included is information supplied to the compilers direct. It is urgently requested that any reprints of papers not published in readily available botanical literature be sent to the compilers. — Validly published names are given in bold face type, accompanied by an indication of the nomenclatu- ral type (name or specimen dependent on rank), followed by the herbarium acronyms of the herbaria where the holotype and possible isotypes are said to be deposited (first acronym for holotype), accord- ing to Index Herbariorum, ed. 8 and supplements as published in Taxon. Invalid, illegitimate, or incor- rect names are given in italic type face. In either case a full bibliographic reference is given. For new combinations, the basionym is also listed. For invalid, illegitimate or incorrect names, the articles of the ICBN which have been contravened are indicated in brackets (note that the numbering of some regularly cited articles has changed in the Tokyo (1994) edition of ICBN). -

Template for Electronic Submission of Organic Letters
Anais VII Simpósio da Amazônia Meridional em Ciências Ambientais: Resumos Expandidos I – Scientific Electronic Archives. Vol 11: 2018, Special Edition ANAIS VII SIMPÓSIO DA AMAZÔNIA MERIDIONAL EM CIÊNCIAS AMBIENTAIS: RESUMOS EXPANDIDOS – VOL I. “Amazônia de transição: Origem, desenvolvimento e perspectivas futuras" Realização Apoio Sinop, MT, 2018 103 Anais VII Simpósio da Amazônia Meridional em Ciências Ambientais: Resumos Expandidos I – Scientific Electronic Archives. Vol 11: 2018, Special Edition UNIVERSIDADE FEDERAL DE MATO GROSSO CÂMPUS UNIVERSITÁRIO DE SINOP INSTITUTO DE CIÊNCIAS NATURAIS, HUMANAS E SOCIAIS PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS AMBIENTAIS NÚCLEO DE ESTUDOS DA BIODIVERSIDADE DA AMAZÔNIA MATO-GROSSENSE COMITÊ CIENTÍFICO VII SIMAMCA ADILSON PACHECO DE SOUZA ANDERSON BARZOTTO ANDRÉA CARVALHO DA SILVA CRISTIANO ALVES DA COSTA DANIEL CARNEIRO DE ABREU DÊNIA MENDES DE SOUZA VALLADÃO DOMINGOS DE JESUS RODRIGUES EDJANE ROCHA DOS SANTOS FABIANA DE FÁTIMA FERREIRA FABIANO ANDRE PETTER FELICIO GUILARDI JUNIOR FLÁVIA RODRIGUES BARBOSA GENEFER ELECIANNE RAIZA DOS SANTOS JACQUELINE KERKHOFF JEAN REINILDES PINHEIRO JULIANE DAMBROS KLEBER SOLERA LARISSA CAVALHEIRO DA SILVA LEANDRO DÊNIS BATTIROLA LUCÉLIA NOBRE CARVALHO LÚCIA YAMAZAKI LUIS FELIPE MORETTI INIESTA MARLITON ROCHA BARRETO MONIQUE MACHINER RAFAEL CAMILO CUSTÓDIO ARIAS RAFAEL SOARES DE ARRUDA RAFAELLA TELES ARANTES FELIPE RENATA ZACHI DE OSTI ROBERTO DE MORAES LIMA SILVEIRA SHEILA RODRIGUES DO NASCIMENTO PELISSARI SOLANGE MARIA BONALDO TALITA BENEDCTA SANTOS KÜNAST URANDI -

National List of Vascular Plant Species That Occur in Wetlands 1996
National List of Vascular Plant Species that Occur in Wetlands: 1996 National Summary Indicator by Region and Subregion Scientific Name/ North North Central South Inter- National Subregion Northeast Southeast Central Plains Plains Plains Southwest mountain Northwest California Alaska Caribbean Hawaii Indicator Range Abies amabilis (Dougl. ex Loud.) Dougl. ex Forbes FACU FACU UPL UPL,FACU Abies balsamea (L.) P. Mill. FAC FACW FAC,FACW Abies concolor (Gord. & Glend.) Lindl. ex Hildebr. NI NI NI NI NI UPL UPL Abies fraseri (Pursh) Poir. FACU FACU FACU Abies grandis (Dougl. ex D. Don) Lindl. FACU-* NI FACU-* Abies lasiocarpa (Hook.) Nutt. NI NI FACU+ FACU- FACU FAC UPL UPL,FAC Abies magnifica A. Murr. NI UPL NI FACU UPL,FACU Abildgaardia ovata (Burm. f.) Kral FACW+ FAC+ FAC+,FACW+ Abutilon theophrasti Medik. UPL FACU- FACU- UPL UPL UPL UPL UPL NI NI UPL,FACU- Acacia choriophylla Benth. FAC* FAC* Acacia farnesiana (L.) Willd. FACU NI NI* NI NI FACU Acacia greggii Gray UPL UPL FACU FACU UPL,FACU Acacia macracantha Humb. & Bonpl. ex Willd. NI FAC FAC Acacia minuta ssp. minuta (M.E. Jones) Beauchamp FACU FACU Acaena exigua Gray OBL OBL Acalypha bisetosa Bertol. ex Spreng. FACW FACW Acalypha virginica L. FACU- FACU- FAC- FACU- FACU- FACU* FACU-,FAC- Acalypha virginica var. rhomboidea (Raf.) Cooperrider FACU- FAC- FACU FACU- FACU- FACU* FACU-,FAC- Acanthocereus tetragonus (L.) Humm. FAC* NI NI FAC* Acanthomintha ilicifolia (Gray) Gray FAC* FAC* Acanthus ebracteatus Vahl OBL OBL Acer circinatum Pursh FAC- FAC NI FAC-,FAC Acer glabrum Torr. FAC FAC FAC FACU FACU* FAC FACU FACU*,FAC Acer grandidentatum Nutt. -

What a Comparison of the Two Flora Conservanda Lists Can Tell Us About Rare Plant Species in the New England Landscape Author(S): Jessica M
Fifteen years of change: What a comparison of the two Flora Conservanda lists can tell us about rare plant species in the New England landscape Author(s): Jessica M. Gerke, Elizabeth J. Farnsworth, and William E. Brumback Source: Rhodora, 116(968):428-493. Published By: The New England Botanical Club, Inc. DOI: http://dx.doi.org/10.3119/13-21 URL: http://www.bioone.org/doi/full/10.3119/13-21 BioOne (www.bioone.org) is a nonprofit, online aggregation of core research in the biological, ecological, and environmental sciences. BioOne provides a sustainable online platform for over 170 journals and books published by nonprofit societies, associations, museums, institutions, and presses. Your use of this PDF, the BioOne Web site, and all posted and associated content indicates your acceptance of BioOne’s Terms of Use, available at www.bioone.org/page/ terms_of_use. Usage of BioOne content is strictly limited to personal, educational, and non-commercial use. Commercial inquiries or rights and permissions requests should be directed to the individual publisher as copyright holder. BioOne sees sustainable scholarly publishing as an inherently collaborative enterprise connecting authors, nonprofit publishers, academic institutions, research libraries, and research funders in the common goal of maximizing access to critical research. RHODORA, Vol. 116, No. 968, pp. 428–493, 2014 E Copyright 2014 by the New England Botanical Club DOI: 10.3119/13-21; first published on-line December 22, 2014. FIFTEEN YEARS OF CHANGE: WHAT A COMPARISON OF THE TWO FLORA CONSERVANDA LISTS CAN TELL US ABOUT RARE PLANT SPECIES IN THE NEW ENGLAND LANDSCAPE 1 JESSICA M. -

Arquivo2747 1.Pdf
UNIVERSIDADE FEDERAL DE PERNAMBUCO CENTRO DE CIÊNCIAS DA SAÚDE DEPARTAMENTO DE CIÊNCIAS FARMACÊUTICAS PROGRAMA DE PÓS-GRADUAÇÃO EM CIÊNCIAS FARMACÊUTICAS DISSERTAÇÃO DE MESTRADO AVALIAÇÃO DE ATIVIDADES FARMACOLÓGICAS DE Mimosa tenuiflora (Willd.) Poir. Lucileide Batista de Oliveira Recife – PE Fevereiro, 2011 LUCILEIDE BATISTA DE OLIVEIRA AVALIAÇÃO DE ATIVIDADES FARMACOLÓGICAS DE Mimosa tenuiflora (Willd.) Poir. Dissertação apresentada ao Programa de Pós- graduação em Ciências Farmacêuticas da Universidade Federal de Pernambuco, como parte dos requisitos para obtenção do grau de Mestre em Ciências Farmacêuticas. Área de Concentração: Avaliação e Obtenção de Produtos Naturais e Bioativos Orientadora: Profª Dra. Ivone Antônia de Souza Coorientadores: Profº Dr. Haroudo Satiro Xavier Prof° Dr. Edvaldo Rodrigues de Almeida Recife-PE Fevereiro, 2011 Oliveira, Lucileide Batista de Avaliação de atividades farmacológicas de Mimosa tenuiflora (Willd.) Poir. / Lucileide Batista de Oliveira. – Recife: O Autor, 2011. 105 folhas: il., fig. tab. Quadro. Graf.; 30 cm. Orientador: Ivone Antônia de Souza Coorientadores: Haroudo Satiro Xavier e Edvaldo Rodrigues de Almeida Dissertação (mestrado) – Universidade Federal de Pernambuco. CCS. Ciências Farmacêuticas, 2011. Inclui bibliografia e apêndice. 1. Mimosa tenuiflora. 2. Fitoquímica. 3. Toxidade aguda. 4. Sistema nervoso central. I. Souza, Ivone Antônia de. II. Xavier, Haroudo Satiro. III. Almeida, Edvaldo Rodrigues de. IV. Título. UFPE 615.7 CDD (20. Ed.) CCS2011-122 UNIVERSIDADE FEDERAL DE PERNAMBUCO -

Bromelicolous Habit of Three Species of Rhinella Fitzinger, 1826 (Anura: Bufonidae) in Northeastern Brazil’S Atlantic Forest
Herpetology Notes, volume 14: 903-906 (2021) (published online on 24 June 2021) Bromelicolous habit of three species of Rhinella Fitzinger, 1826 (Anura: Bufonidae) in Northeastern Brazil’s Atlantic Forest Ubiratã Ferreira Souza1,*, Alan Pedro de Araújo2,3, Alcina Gabriela Maria Medeiros da Fonsêca Santos1, and Marcos Jorge Matias Dubeux4 Understanding habitat types and how organisms bromeliads for breeding can still use them as shelter (i.e., make use of them, is crucial for identifying factors bromelicolous; sensu Peixoto, 1995). Bromelicolous that determine species distribution and community habit can be recurrent (e.g., Scinax pachycrus [Araújo composition (Kopp and Eterovick, 2006; Pittman et et al., 2020], Nyctimantis brunoi [Peixoto, 1995]) or al., 2014). The phytotelmata are plant structures that opportunistic – when the anuran uses this phytotelm accumulate rainwater (e.g., bromeliad tanks, tree holes, occasionally (Peixoto, 1995; Andrade et al., 2009). bamboo internodes, axils and floral bracts; see Kitching, Among the four genera of bufonids occurring in 2000). Such structures provide microhabitats for fungi, the Brazilian Atlantic Forest (Segalla et al., 2019), microalgae, and both invertebrate and vertebrate Dendrophryniscus Jiménez-de-la-Espada, 1870, animals (Maguire, 1971; Ramos et al., 2018, 2019). The Frostius Cannatella, 1986 and Melanophryniscus plants of the Bromeliaceae family are the most common Gallardo, 1961 have strong association with phytotelm phytotelm across the Neotropical region (Ulloa-Ulloa environments, including bromeligenous species (Cruz et al., 2017), being used for shelter, foraging and/or and Peixoto, 1982; Haddad and Prado, 2005; Kwet et reproduction (Pugliese et al., 2009; Nunes et al., 2012). al., 2005; Wells, 2007; Langone et al., 2008; Dias et al., Among Neotropical anurans, more than 168 known 2016; Sabagh et al., 2017). -

An Alphabetical List of Bromeliad Binomials
AN ALPHABETICAL LIST OF BROMELIAD BINOMIALS Compiled by HARRY E. LUTHER The Marie Selby Botanical Gardens Sarasota, Florida, USA ELEVENTH EDITION Published by the Bromeliad Society International June 2008 ii INTRODUCTION TO EDITION XI This list is presented as a spelling guide for validly published taxa accepted at the Bromeliad Identification Center. The list contains the following information: 1) Genus number (the left-hand number) based on the systematic sequence published in the Smith & Downs monograph: Bromeliaceae (Flora Neotropica, number 14, parts 1-3; 1974, 1977, 1979). Whole numbers are as published in the monograph. 2) Species number (the second number) according to its systematic position in the monograph. Note: Taxa not included in the monograph or that have been reclassified have been assigned numbers to reflect their systematic position within the Smith & Downs framework (e.g., taxon 14.1 is related to taxon 14). The utility of this method is that one may assume for example that Tillandsia comarapaensis (150.2) is related to T. didisticha (150) and therefore may have certain horticultural qualities in common with that species. 3) Genus and species names follow the respective numbers. 4) Subspecific taxa (subspecies, varieties, forms) names are indented below the species names. Note: Variety "a" (the type variety) is not listed unless it contains a form (see Aechmea caudata ). Similarly, the type form is not listed. 5) Author name follows the specific and subspecific names. These names are included for the convenience of specialist users of the list. This list does not contain publication data or synonymy, as it is not our intent for it to be a technical nomenclatural guide. -
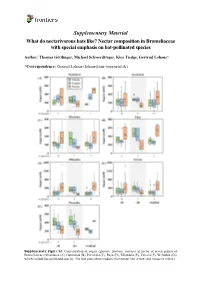
Supplementary Material What Do Nectarivorous Bats Like? Nectar Composition in Bromeliaceae with Special Emphasis on Bat-Pollinated Species
Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S1: Concentration of sugars (glucose, fructose, sucrose) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)) which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S2: Concentration of amino acids (ala, arg, asn, asp, gaba, gln, glu, gly, his, iso, leu, lys, met, phe, pro, ser, thr, trp, tyr, val) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box). Supplementary Material What do nectarivorous bats like? Nectar composition in Bromeliaceae with special emphasis on bat-pollinated species Author: Thomas Göttlinger, Michael Schwerdtfeger, Kira Tiedge, Gertrud Lohaus* *Correspondence: Gertrud Lohaus ([email protected]) Supplementary Figure S3: Cation concentrations (Ca2+, K+, Na+, Mg2+) in nectar of seven genera of Bromeliaceae (Alcantarea (A), Guzmania (B), Pitcairnia (C), Puya (D), Tillandsia (E), Vriesea (F), Werauhia (G)), which include bat-pollinated species. The box plots show medians (horizontal line in box) and means (x in box).