Truuverk Andro Zomagtoo.Pdf
Total Page:16
File Type:pdf, Size:1020Kb
Load more
Recommended publications
-

ANOTHER RECORD for AZALEA AS AFOODPLANT of Satyrilj
• FOUNDED VOL.7 NO.1 1978 MAY'1985 THE OFFICIAL PUBLICATION OF THE SOUTHERN LEPIDOPTERISTS' SOCIETY, ORGANIZED TO PROMOTE SCIENTIFIC INTEREST AND KNOWLEDGE RELATED TO UNDERSTANDING THE LEPIDOPTERA FAUNA OF THE SOUTHERN REGION OF THE UNITED STATES. ANOTHER RECORD FOR AZALEA AS AFOODPLANT 1985 ANNUAL MEETING SATYRIlJ~1 OF LIPAROPS LIPAROPS CB & U NEAR ST I MARKS NWR, FLOR IDA By Bob Cavanaugh By Dave Baggett ON March 16, 1985 while searching over I AM working towards setting up the 1985 the leaves of a wild azalea bush (Rho annual meeting in or near St. Marks NWR dodendron canescens (Michaux)) I found (Inner Big Bend area along the NW Gulf a pale green, slug shaped larva which Coast, about 40 miles south of Tallahassee). reared out to be a male Satyrium ~ There has been very limited exploration in arops liparops. The description of the the area, and I think it is one that holds larva contained in Klots' A FIELD GUIDE a great deal of promise. The date will be TO THE BUTTERFLIES is accurate for this Labor Day weekend (Aug. 30 - Sept. 1). This subspecies. The larva turned a pretty could be a bit early for the area, but then lavender color three days prior to pu again, it might just be right on target. pation. Pupation occurred on April 1st The immediate area adjacent holds a lot of and the adult emerged on the morning of promise for several field trips, especially April 18th. in conjunction with the long holiday week end. The azalea plant was in full bloom and the leaves were young and soft. -

Memoirs of the Queensland Museum | Culture
Memoirs of the Queensland Museum | Culture Volume 7 Part 1 The Leichhardt diaries Early travels in Australia during 1842-1844 Edited by Thomas A. Darragh and Roderick J. Fensham © Queensland Museum PO Box 3300, South Brisbane 4101, Australia Phone: +61 (0) 7 3840 7555 Fax: +61 (0) 7 3846 1226 Web: qm.qld.gov.au National Library of Australia card number ISSN 1440-4788 NOTE Papers published in this volume and in all previous volumes of the Memoirs of the Queensland Museum may be reproduced for scientific research, individual study or other educational purposes. Properly acknowledged quotations may be made but queries regarding the republication of any papers should be addressed to the Editor in Chief. A Guide to Authors is displayed on the Queensland Museum website qm.qld.gov.au A Queensland Government Project 30 June 2013 The Leichhardt diaries. Early travels in Australia during 1842–1844 Diary No 2 28 December - 24 July 1843 (Hunter River - Liverpool Plains - Gwydir Des bords du Tanaïs au sommet du Cédar. - Darling Downs - Moreton Bay) Sur le bronze et le marbre et sur le sein des [Inside the front cover are two newspaper braves cuttings of poetry, The Lost Ship and The Et jusque dans le cœur de ces troupeaux Neglected Wife. Also there are manuscript d’esclaves stanzas of three pieces of poetry. The first Qu’il foulait tremblans sous son char. in German, the second in English from Jacob Faithful by Frederick Maryatt, and the third [On a reef lashed by the plaintive wave in French.] the navigator from afar sees whitening on the shore Die Gestalt, die die erste Liebe geweckt a tomb near the edge, dumped by the Vergisst sich nie billows; Um den grünsten Fleck in der Wüste der time has not yet darkened the narrow Zeit stone Schwebt zögernd sie and beneath the green fabric of the briar From the German poem of an English and of the ivy lady. -

Entomology of the Aucklands and Other Islands South of New Zealand: Lepidoptera, Ex Cluding Non-Crambine Pyralidae
Pacific Insects Monograph 27: 55-172 10 November 1971 ENTOMOLOGY OF THE AUCKLANDS AND OTHER ISLANDS SOUTH OF NEW ZEALAND: LEPIDOPTERA, EX CLUDING NON-CRAMBINE PYRALIDAE By J. S. Dugdale1 CONTENTS Introduction 55 Acknowledgements 58 Faunal Composition and Relationships 58 Faunal List 59 Key to Families 68 1. Arctiidae 71 2. Carposinidae 73 Coleophoridae 76 Cosmopterygidae 77 3. Crambinae (pt Pyralidae) 77 4. Elachistidae 79 5. Geometridae 89 Hyponomeutidae 115 6. Nepticulidae 115 7. Noctuidae 117 8. Oecophoridae 131 9. Psychidae 137 10. Pterophoridae 145 11. Tineidae... 148 12. Tortricidae 156 References 169 Note 172 Abstract: This paper deals with all Lepidoptera, excluding the non-crambine Pyralidae, of Auckland, Campbell, Antipodes and Snares Is. The native resident fauna of these islands consists of 42 species of which 21 (50%) are endemic, in 27 genera, of which 3 (11%) are endemic, in 12 families. The endemic fauna is characterised by brachyptery (66%), body size under 10 mm (72%) and concealed, or strictly ground- dwelling larval life. All species can be related to mainland forms; there is a distinctive pre-Pleistocene element as well as some instances of possible Pleistocene introductions, as suggested by the presence of pairs of species, one member of which is endemic but fully winged. A graph and tables are given showing the composition of the fauna, its distribution, habits, and presumed derivations. Host plants or host niches are discussed. An additional 7 species are considered to be non-resident waifs. The taxonomic part includes keys to families (applicable only to the subantarctic fauna), and to genera and species. -

Insect Survey of Four Longleaf Pine Preserves
A SURVEY OF THE MOTHS, BUTTERFLIES, AND GRASSHOPPERS OF FOUR NATURE CONSERVANCY PRESERVES IN SOUTHEASTERN NORTH CAROLINA Stephen P. Hall and Dale F. Schweitzer November 15, 1993 ABSTRACT Moths, butterflies, and grasshoppers were surveyed within four longleaf pine preserves owned by the North Carolina Nature Conservancy during the growing season of 1991 and 1992. Over 7,000 specimens (either collected or seen in the field) were identified, representing 512 different species and 28 families. Forty-one of these we consider to be distinctive of the two fire- maintained communities principally under investigation, the longleaf pine savannas and flatwoods. An additional 14 species we consider distinctive of the pocosins that occur in close association with the savannas and flatwoods. Twenty nine species appear to be rare enough to be included on the list of elements monitored by the North Carolina Natural Heritage Program (eight others in this category have been reported from one of these sites, the Green Swamp, but were not observed in this study). Two of the moths collected, Spartiniphaga carterae and Agrotis buchholzi, are currently candidates for federal listing as Threatened or Endangered species. Another species, Hemipachnobia s. subporphyrea, appears to be endemic to North Carolina and should also be considered for federal candidate status. With few exceptions, even the species that seem to be most closely associated with savannas and flatwoods show few direct defenses against fire, the primary force responsible for maintaining these communities. Instead, the majority of these insects probably survive within this region due to their ability to rapidly re-colonize recently burned areas from small, well-dispersed refugia. -

Conservation and Management of Eastern Big-Eared Bats a Symposium
Conservation and Management of Eastern Big-eared Bats A Symposium y Edited b Susan C. Loeb, Michael J. Lacki, and Darren A. Miller U.S. Department of Agriculture Forest Service Southern Research Station General Technical Report SRS-145 DISCLAIMER The use of trade or firm names in this publication is for reader information and does not imply endorsement by the U.S. Department of Agriculture of any product or service. Papers published in these proceedings were submitted by authors in electronic media. Some editing was done to ensure a consistent format. Authors are responsible for content and accuracy of their individual papers and the quality of illustrative materials. Cover photos: Large photo: Craig W. Stihler; small left photo: Joseph S. Johnson; small middle photo: Craig W. Stihler; small right photo: Matthew J. Clement. December 2011 Southern Research Station 200 W.T. Weaver Blvd. Asheville, NC 28804 Conservation and Management of Eastern Big-eared Bats: A Symposium Athens, Georgia March 9–10, 2010 Edited by: Susan C. Loeb U.S Department of Agriculture Forest Service Southern Research Station Michael J. Lacki University of Kentucky Darren A. Miller Weyerhaeuser NR Company Sponsored by: Forest Service Bat Conservation International National Council for Air and Stream Improvement (NCASI) Warnell School of Forestry and Natural Resources Offield Family Foundation ContEntS Preface . v Conservation and Management of Eastern Big-Eared Bats: An Introduction . 1 Susan C. Loeb, Michael J. Lacki, and Darren A. Miller Distribution and Status of Eastern Big-eared Bats (Corynorhinus Spp .) . 13 Mylea L. Bayless, Mary Kay Clark, Richard C. Stark, Barbara S. -

2017 City of York Biodiversity Action Plan
CITY OF YORK Local Biodiversity Action Plan 2017 City of York Local Biodiversity Action Plan - Executive Summary What is biodiversity and why is it important? Biodiversity is the variety of all species of plant and animal life on earth, and the places in which they live. Biodiversity has its own intrinsic value but is also provides us with a wide range of essential goods and services such as such as food, fresh water and clean air, natural flood and climate regulation and pollination of crops, but also less obvious services such as benefits to our health and wellbeing and providing a sense of place. We are experiencing global declines in biodiversity, and the goods and services which it provides are consistently undervalued. Efforts to protect and enhance biodiversity need to be significantly increased. The Biodiversity of the City of York The City of York area is a special place not only for its history, buildings and archaeology but also for its wildlife. York Minister is an 800 year old jewel in the historical crown of the city, but we also have our natural gems as well. York supports species and habitats which are of national, regional and local conservation importance including the endangered Tansy Beetle which until 2014 was known only to occur along stretches of the River Ouse around York and Selby; ancient flood meadows of which c.9-10% of the national resource occurs in York; populations of Otters and Water Voles on the River Ouse, River Foss and their tributaries; the country’s most northerly example of extensive lowland heath at Strensall Common; and internationally important populations of wetland birds in the Lower Derwent Valley. -
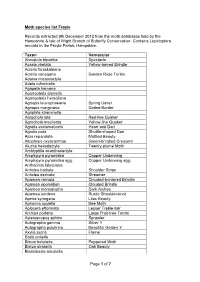
Page 1 of 7 Moth Species List Froyle Records
Moth species list Froyle Records extracted 9th December 2012 from the moth databases held by the Hampshire & Isle of Wight Branch of Butterfly Conservation. Contains Lepidoptera records in the Froyle Parish, Hampshire. Taxon Vernacular Abrostola tripartita Spectacle Acasis viretata Yellow-barred Brindle Acleris forsskaleana Acleris variegana Garden Rose Tortrix Adaina microdactyla Adela rufimitrella Agapeta hamana Agonopterix arenella Agonopterix heracliana Agriopis leucophaearia Spring Usher Agriopis marginaria Dotted Border Agriphila straminella Agrochola lota Red-line Quaker Agrochola macilenta Yellow-line Quaker Agrotis exclamationis Heart and Dart Agrotis puta Shuttle-shaped Dart Alcis repandata Mottled Beauty Allophyes oxyacanthae Green-brindled Crescent Alucita hexadactyla Twenty-plume Moth Amblyptilia acanthadactyla Amphipyra pyramidea Copper Underwing Amphipyra pyramidea agg. Copper Underwing agg. Anthophila fabriciana Anticlea badiata Shoulder Stripe Anticlea derivata Streamer Apamea crenata Clouded-bordered Brindle Apamea epomidion Clouded Brindle Apamea monoglypha Dark Arches Apamea sordens Rustic Shoulder-knot Apeira syringaria Lilac Beauty Aphomia sociella Bee Moth Aplocera efformata Lesser Treble-bar Archips podana Large Fruit-tree Tortrix Asteroscopus sphinx Sprawler Autographa gamma Silver Y Autographa pulchrina Beautiful Golden Y Axylia putris Flame Batia unitella Biston betularia Peppered Moth Biston strataria Oak Beauty Blastobasis adustella Page 1 of 7 Blastobasis lacticolella Cabera exanthemata Common Wave Cabera -

Proceedings of the Tenth Forum Herbulot 2018. Integrative Taxonomy, a Multidisciplinary Approach to Answer Compli- Cated Taxonomic Questions
SPIXIANA 42 2 291-320 München, Dezember 2019 ISSN 0341-8391 Proceedings of the tenth FORUM HERBULOT 2018. Integrative taxonomy, a multidisciplinary approach to answer compli- cated taxonomic questions (Stuttgart, Germany, 11-16 June 2018) Axel Hausmann & Hossein Rajaei (eds) Hausmann, A. & Rajaei, H. (eds) 2019. Proceedings of the tenth FORUM HERBULOT 2018. Integrative taxonomy, a multidisciplinary approach to answer complicated taxonomic questions (Stuttgart, Germany, 11-16 June 2018). Spixiana 42 (2): 291- 320. The tenth International Congress of FORUM HERBULOT on “Integrative taxonomy, a multidisciplinary approach to answer complicated taxonomic questions” took place in the Staatliches Museum für Naturkunde Stuttgart (SMNS), from 11.- 16.06.2018, with 77 participants and 52 scientific presentations. The proceedings provide short information on the meeting and the abstracts of the oral presenta- tions. Axel Hausmann (corresponding author), SNSB – ZSM, Bavarian State Collection of Zoology, Münchhausenstr. 21, 81247 Munich, Germany; e-mail: [email protected] Short report and results Axel Hausmann & Hossein Rajaei Hausmann, A. & Rajaei, H. 2019. Short report and results. Pp. 291-292 in: Hausmann, A. & Rajaei, H. (eds). Proceedings of the tenth FORUM HERBULOT 2018. Integrative taxonomy, a multidisciplinary approach to answer complicated taxonomic questions (Stuttgart, Germany, 11-16 June 2018). Spixiana 42 (2). Axel Hausmann (corresponding author), SNSB – ZSM, Bavarian State Collection of Zoology, Münchhausenstr. 21, 81247 Mu- nich, Germany; e-mail: [email protected] The meeting was organized by an organization The conference started with a lecture on the ground- team of the ‘Staatliches Museum für Naturkunde breaking effects of “Willi Hennig and the synthesis of Stuttgart’ (SMNS). -

Additions, Deletions and Corrections to An
Bulletin of the Irish Biogeographical Society No. 36 (2012) ADDITIONS, DELETIONS AND CORRECTIONS TO AN ANNOTATED CHECKLIST OF THE IRISH BUTTERFLIES AND MOTHS (LEPIDOPTERA) WITH A CONCISE CHECKLIST OF IRISH SPECIES AND ELACHISTA BIATOMELLA (STAINTON, 1848) NEW TO IRELAND K. G. M. Bond1 and J. P. O’Connor2 1Department of Zoology and Animal Ecology, School of BEES, University College Cork, Distillery Fields, North Mall, Cork, Ireland. e-mail: <[email protected]> 2Emeritus Entomologist, National Museum of Ireland, Kildare Street, Dublin 2, Ireland. Abstract Additions, deletions and corrections are made to the Irish checklist of butterflies and moths (Lepidoptera). Elachista biatomella (Stainton, 1848) is added to the Irish list. The total number of confirmed Irish species of Lepidoptera now stands at 1480. Key words: Lepidoptera, additions, deletions, corrections, Irish list, Elachista biatomella Introduction Bond, Nash and O’Connor (2006) provided a checklist of the Irish Lepidoptera. Since its publication, many new discoveries have been made and are reported here. In addition, several deletions have been made. A concise and updated checklist is provided. The following abbreviations are used in the text: BM(NH) – The Natural History Museum, London; NMINH – National Museum of Ireland, Natural History, Dublin. The total number of confirmed Irish species now stands at 1480, an addition of 68 since Bond et al. (2006). Taxonomic arrangement As a result of recent systematic research, it has been necessary to replace the arrangement familiar to British and Irish Lepidopterists by the Fauna Europaea [FE] system used by Karsholt 60 Bulletin of the Irish Biogeographical Society No. 36 (2012) and Razowski, which is widely used in continental Europe. -

Bosco Palazzi
SHILAP Revista de Lepidopterología ISSN: 0300-5267 ISSN: 2340-4078 [email protected] Sociedad Hispano-Luso-Americana de Lepidopterología España Bella, S; Parenzan, P.; Russo, P. Diversity of the Macrolepidoptera from a “Bosco Palazzi” area in a woodland of Quercus trojana Webb., in southeastern Murgia (Apulia region, Italy) (Insecta: Lepidoptera) SHILAP Revista de Lepidopterología, vol. 46, no. 182, 2018, April-June, pp. 315-345 Sociedad Hispano-Luso-Americana de Lepidopterología España Available in: https://www.redalyc.org/articulo.oa?id=45559600012 How to cite Complete issue Scientific Information System Redalyc More information about this article Network of Scientific Journals from Latin America and the Caribbean, Spain and Journal's webpage in redalyc.org Portugal Project academic non-profit, developed under the open access initiative SHILAP Revta. lepid., 46 (182) junio 2018: 315-345 eISSN: 2340-4078 ISSN: 0300-5267 Diversity of the Macrolepidoptera from a “Bosco Palazzi” area in a woodland of Quercus trojana Webb., in southeastern Murgia (Apulia region, Italy) (Insecta: Lepidoptera) S. Bella, P. Parenzan & P. Russo Abstract This study summarises the known records of the Macrolepidoptera species of the “Bosco Palazzi” area near the municipality of Putignano (Apulia region) in the Murgia mountains in southern Italy. The list of species is based on historical bibliographic data along with new material collected by other entomologists in the last few decades. A total of 207 species belonging to the families Cossidae (3 species), Drepanidae (4 species), Lasiocampidae (7 species), Limacodidae (1 species), Saturniidae (2 species), Sphingidae (5 species), Brahmaeidae (1 species), Geometridae (55 species), Notodontidae (5 species), Nolidae (3 species), Euteliidae (1 species), Noctuidae (96 species), and Erebidae (24 species) were identified. -

TIME for SHIFT CHANGE in the FABRIC of EXISTENCE Exploring the Role of Darkness and Artificial Light for Humans and Biodiversity
TIME FOR SHIFT CHANGE IN THE FABRIC OF EXISTENCE Exploring the role of darkness and artificial light for humans and biodiversity Author: Maya Strömgren Supervisor: Mattias Sandberg Master’s thesis in Geography with major in Human Geography Spring semester 2021 Department of Economy and Society Unit for Human Geography School of Business, Economics and Law at University of Gothenburg Student essay: 30 hec Course: GEO230 Level: Master Semester/year: Spring 2021 Supervisor: Mattias Sandberg Examiner: Jerry Olsson Key words: Darkness, artificial light, light pollution, biodiversity, human- non-human relations, all-ecology, non-representational theory. Abstract This thesis departs from the loss of biodiversity due to artificial light at night. The diurnal human has taken over all hours of the day instead of the natural light once, meaning that space and time have become limited for the nocturnal living species. Earlier research concern how darkness and artificial light affect either animals, insects, and plants, or humans’ health. The combination of the two, however, remains largely unresearched. Therefore, this geographical thesis dives into this gap by exploring humans and biodiversity in relation to darkness and artificial light. Building on that exploration, the aim was further to formulate generative ways forward in the matter. A qualitative method was conducted, consisting of a self-written Darkness Diary and walking interviews with a moth-expert, a bat expert, and a light designer and light artist. The theory of all-ecology was applied as an ontological stand and a geographical toolbox. Non- representational theory (NRT) was further applied as a guide in the exploration of experience. -

Desktop Biodiversity Report
Desktop Biodiversity Report Land at Balcombe Parish ESD/14/747 Prepared for Katherine Daniel (Balcombe Parish Council) 13th February 2014 This report is not to be passed on to third parties without prior permission of the Sussex Biodiversity Record Centre. Please be aware that printing maps from this report requires an appropriate OS licence. Sussex Biodiversity Record Centre report regarding land at Balcombe Parish 13/02/2014 Prepared for Katherine Daniel Balcombe Parish Council ESD/14/74 The following information is included in this report: Maps Sussex Protected Species Register Sussex Bat Inventory Sussex Bird Inventory UK BAP Species Inventory Sussex Rare Species Inventory Sussex Invasive Alien Species Full Species List Environmental Survey Directory SNCI M12 - Sedgy & Scott's Gills; M22 - Balcombe Lake & associated woodlands; M35 - Balcombe Marsh; M39 - Balcombe Estate Rocks; M40 - Ardingly Reservior & Loder Valley Nature Reserve; M42 - Rowhill & Station Pastures. SSSI Worth Forest. Other Designations/Ownership Area of Outstanding Natural Beauty; Environmental Stewardship Agreement; Local Nature Reserve; National Trust Property. Habitats Ancient tree; Ancient woodland; Ghyll woodland; Lowland calcareous grassland; Lowland fen; Lowland heathland; Traditional orchard. Important information regarding this report It must not be assumed that this report contains the definitive species information for the site concerned. The species data held by the Sussex Biodiversity Record Centre (SxBRC) is collated from the biological recording community in Sussex. However, there are many areas of Sussex where the records held are limited, either spatially or taxonomically. A desktop biodiversity report from SxBRC will give the user a clear indication of what biological recording has taken place within the area of their enquiry.